
- •1. Материя и ее движение
- •2 Вещества и их изменение. Предмет неорганической химии
- •3. Закон сохранения массы. Основное содержание атомно-молекулярного учения
- •4. Эквивалент. Закон эквивалентности. Важнейшие классы и номенклатура неорганических веществ
- •5. Периодическая система элементов д.И. Менделеева
- •6. Теория химического строения
- •7. Общая характеристика p-, s-, d-элементов
- •8. Ковалентная связь. Метод валентных связей
- •9. Неполярная и полярная ковалентные связи
- •10. Многоцентровые связи
- •11. Ионная связь
- •12. Водородная связь
- •13. Превращение энергии при химических реакциях
- •14. Цепные реакции
- •15. Общие свойства неметаллов
- •16. Водород
- •17. Вода
- •18. Перекись водорода
- •19. Общая характеристика подгруппы галогенов
- •20. Хлор. Хлороводород и соляная кислота
- •21. Краткие сведения о фторе, броме и йоде
- •22. Общая характеристика подгруппы кислорода
- •23. Кислород и его свойства
- •24. Озон и его свойства
- •25. Сера и ее свойства
- •26. Сероводород и сульфиды
- •27. Свойства серной кислоты и ее практическое значение
- •28. Азот. Сигма– и пи-связи
- •29. Общая характеристика подгруппы азота
- •30. Аммиак
- •31. Соли аммония
- •32. Оксиды азота
- •33. Азотная кислота
- •34. Фосфор
- •35. Аллотропные модификации фосфора
- •36. Оксиды фосфора и фосфорные кислоты
- •37. Минеральные удобрения
- •38. Углерод и его свойства
- •39. Аллотропные модификации углерода
- •40. Оксиды углерода. Угольная кислота
- •41. Кремний и его свойства
- •42. Понятие коллоидных растворов
- •43. Соли кремниевой кислоты
- •44. Получение цемента и керамики
- •45. Физические свойства металлов
- •46. Химические свойства металлов
- •47. Металлы и сплавы в технике
- •48. Основные способы получения металлов
- •49. Коррозия металлов
- •50. Защита металлов от коррозии
- •51. Общая характеристика подгруппы лития
- •52. Натрий и калий
- •53. Едкие щелочи
- •54. Соли натрия и калия
- •55. Общая характеристика подгруппы бериллия
- •56. Кальций
- •57. Оксид и гидроксид кальция
- •58. Жесткость воды и способы ее устранения
- •59. Общая характеристика подгруппы бора
- •60. Алюминий. Применение алюминия и его сплавов
- •61. Оксид и гидроксид алюминия
- •62. Общая характеристика подгруппы хрома
- •63. Хром
- •64. Оксиды и гидроксиды хрома
- •65. Хроматы и дихроматы
- •66. Общая характеристика семейства железа
- •67. Железо
- •68. Соединения железа
- •69. Доменный процесс
- •70. Чугун и стали
- •71. Тяжелая вода
- •72. Соли соляной кислоты
23. Кислород и его свойства
Кислород (О) стоит в 1 периоде, VI группе, в главной подгруппе. р-элемент. Электронная конфигурация 1s22s22p4. Число электронов на внешнем уровне – 6. Кислород может принять 2 электрона и в редких случаях отдать. Валентность кислорода 2, степень окисления -2.
Физические свойства: кислород (О2) – бесцветный газ, без запаха и вкуса; в воде малорастворим, немного тяжелее воздуха. При -183 °C и 101,325 Па кислород сжижается, приобретая голубоватый цвет. Строение молекулы: молекула кислорода двухатомна, в обычных условиях прочная, обладает магнитными свойствами. Связь в молекуле ковалентная неполярная. Кислород имеет аллотропную модификацию – озон (О3) – более сильный окислитель, чем кислород.
Химические свойства: до завершения энергетического уровня кислороду нужно 2 электрона, которые он принимает проявляя степень окисления -2, но в соединении со фтором кислород ОF2 -2 и О2F2 -1. Благодаря химической активности кислород взаимодействует почти со всеми простыми веществами. С металлами образует оксиды и пероксиды:
![]()
Кислород не реагирует только с платиной. При повышенных и высоких температурах реагирует со многими неметаллами:
![]()
![]()
Непосредственно кислород не взаимодействует с галогенами. Кислород реагирует со многими сложными веществами:
![]()
Кислороду характерны реакции горения:
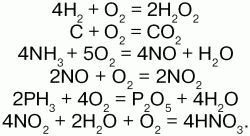
В кислороде горят многие органические вещества:
![]()
При окислении кислородом уксусного альдегида получают уксусную кислоту:
![]()
Получение: в лаборатории: 1) электролизом водного раствора щелочи: при этом на катоде выделяется водород, а на аноде – кислород; 2) разложением бертолетовой соли при нагревании: 2КСlО3?2КСl + 3О2?; 3) очень чистый кислород получают: 2КМnO4?К2МnO4 + МnО2 + О2?.
Нахождение в природе: кислород составляет 47,2 % массы земной коры. В свободном состоянии он содержится в атмосферном воздухе – 21 %. Входит в состав многих природных минералов, огромное его количество содержится в организмах растений и животных. Природный кислород состоит из 3 изотопов: О(16), О(17), О(18).
Применение: используется в химической, металлургической промышленности, в медицине.
24. Озон и его свойства
В твердом состоянии у кислорода зафиксировано три модификации: ?-, ?– и ?– модификации. Озон (О3) – одна из аллотропных модификаций кислорода. Строение молекулы: озон имеет нелинейное строение молекулы с углом между атомами 117°. Молекула озона обладает некоторой полярностью (несмотря на атомы одного рода, образующих молекулу озона), диамагнитна, так как не имеет неспаренных электронов.
Физические свойства: озон – синий газ, имеющий характерный запах; молекулярная масса = 48, температура плавления (твердого) = 192,7 °C, температура кипения = 111,9 °C. Жидкий и твердый озон взрывчат, токсичен, хорошо растворим в воде: при 0 °C в 100 объемах воды растворяется до 49 объемов озона.
Химические свойства: озон – сильный окислитель, он окисляет все металлы, в том числе золото – Au и платину – Pt (и металлы платиновой группы). Озон воздействует на блестящую серебряную пластинку, которая мгновенно покрывается черным пероксидом серебра – Аg2О2; бумага, смоченная скипидаром, воспламеняется, сернистые соединения металлов окисляются до солей серной кислоты; многие красящие вещества обесцвечиваются; разрушает органические вещества – при этом молекула озона отщепляет один атом кислорода, и озон превращается в обыкновенный кислород. Атакже большинство неметаллов, переводит низшие оксиды в высшие, а сульфиды их металлов – в их сульфаты:
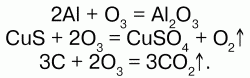
Йодид калия озон окисляет до молекулярного йода:
![]()
Но с пероксидом водорода Н2О2 озон выступает в качестве восстановителя:
![]()
В химическом отношении молекулы озона неустойчивы – озон способен самопроизвольно распадаться на молекулярный кислород:
![]()
Получение: получают озон в озонаторах путем пропускания через кислород или воздух электрические искры. Образование озона из кислорода:
![]()
Озон может образовываться при окислении влажного фосфора, смолистых веществ. Определитель озона: чтобы опознать в воздухе наличие озона, необходимо в воздух погрузить бумажку, пропитанную раствором йодида калия и крахмальным клейстером – если бумажка приобрела синюю окраску, значит, в воздухе присутствует озон. Нахождение в природе: в атмосфере озон образуется во время электрических разрядов. Применение: будучи сильным окислителем озон уничтожает различного рода бактерии, поэтому широко применяется в целях очищения воды и дезинфекции воздуха, используется как белящее средство.
