
- •1. Материя и ее движение
- •2 Вещества и их изменение. Предмет неорганической химии
- •3. Закон сохранения массы. Основное содержание атомно-молекулярного учения
- •4. Эквивалент. Закон эквивалентности. Важнейшие классы и номенклатура неорганических веществ
- •5. Периодическая система элементов д.И. Менделеева
- •6. Теория химического строения
- •7. Общая характеристика p-, s-, d-элементов
- •8. Ковалентная связь. Метод валентных связей
- •9. Неполярная и полярная ковалентные связи
- •10. Многоцентровые связи
- •11. Ионная связь
- •12. Водородная связь
- •13. Превращение энергии при химических реакциях
- •14. Цепные реакции
- •15. Общие свойства неметаллов
- •16. Водород
- •17. Вода
- •18. Перекись водорода
- •19. Общая характеристика подгруппы галогенов
- •20. Хлор. Хлороводород и соляная кислота
- •21. Краткие сведения о фторе, броме и йоде
- •22. Общая характеристика подгруппы кислорода
- •23. Кислород и его свойства
- •24. Озон и его свойства
- •25. Сера и ее свойства
- •26. Сероводород и сульфиды
- •27. Свойства серной кислоты и ее практическое значение
- •28. Азот. Сигма– и пи-связи
- •29. Общая характеристика подгруппы азота
- •30. Аммиак
- •31. Соли аммония
- •32. Оксиды азота
- •33. Азотная кислота
- •34. Фосфор
- •35. Аллотропные модификации фосфора
- •36. Оксиды фосфора и фосфорные кислоты
- •37. Минеральные удобрения
- •38. Углерод и его свойства
- •39. Аллотропные модификации углерода
- •40. Оксиды углерода. Угольная кислота
- •41. Кремний и его свойства
- •42. Понятие коллоидных растворов
- •43. Соли кремниевой кислоты
- •44. Получение цемента и керамики
- •45. Физические свойства металлов
- •46. Химические свойства металлов
- •47. Металлы и сплавы в технике
- •48. Основные способы получения металлов
- •49. Коррозия металлов
- •50. Защита металлов от коррозии
- •51. Общая характеристика подгруппы лития
- •52. Натрий и калий
- •53. Едкие щелочи
- •54. Соли натрия и калия
- •55. Общая характеристика подгруппы бериллия
- •56. Кальций
- •57. Оксид и гидроксид кальция
- •58. Жесткость воды и способы ее устранения
- •59. Общая характеристика подгруппы бора
- •60. Алюминий. Применение алюминия и его сплавов
- •61. Оксид и гидроксид алюминия
- •62. Общая характеристика подгруппы хрома
- •63. Хром
- •64. Оксиды и гидроксиды хрома
- •65. Хроматы и дихроматы
- •66. Общая характеристика семейства железа
- •67. Железо
- •68. Соединения железа
- •69. Доменный процесс
- •70. Чугун и стали
- •71. Тяжелая вода
- •72. Соли соляной кислоты
19. Общая характеристика подгруппы галогенов
Галогены – элементы VII группы – фтор, хлор, бром, йод, астат (астат мало изучен в связи с его радиоактивностью). Галогены – ярко выраженные неметаллы. Лишь йод в редких случаях обнаруживает некоторые свойства, схожие с металлами.
В невозбужденном состоянии атомы галогенов имеют общие электронную конфигурацию: ns2np5. Это значит, что галогены имеют 7 валентных электронов, кроме фтора.

Физические свойства галогенов: F2 – бесцветный, трудно сжижающийся газ; Cl2 – желто-зеленый, легко сжижающийся газ с резким удушливым запахом; Br2 – жидкость красно-бурого цвета; I2 – кристаллическое вещество фиолетового цвета.

Водные растворы галогеноводородов образуют кислоты. НF – фтороводородная (плавиковая); НCl – хлороводородная (соляная); НBr – бромоводородная; НI – йодоводородная. Силы кислот сверху вниз снижаются. Плавиковая кислота является самой слабой в ряду галогеново-дородных кислот, а йодоводородная – самой сильной. Это объясняется тем, что энергия связи Нг сверху уменьшается. В том же направлении уменьшается и прочность молекулы Н Г, что связано с ростом межъядерного расстояния. Растворимость малорастворимых солей в воде тоже уменьшается:
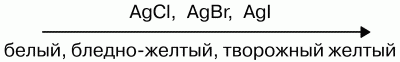
Слева направо растворимость галогенидов уменьшается. АgF хорошо растворим в воде. Все галогены в свободном состоянии – окислители. Сила их как окислителей снижается от фтора к йоду. В кристаллическом, жидком и газообразном состоянии все галогены существуют в виде отдельных молекул. Атомные радиусы возрастают в том же направлении, что приводит к повышению температуры плавления и кипения. Фтор диссоциирует на атомы лучше йода. Электродные потенциалы при переходе вниз по подгруппе галогенов снижаются. У фтора самый высокий электродный потенциал. Фтор – самый сильный окислитель. Любой вышестоящий свободный галоген вытеснит нижестоящий, находящийся в состоянии отрицательного однозарядного иона в растворе.
20. Хлор. Хлороводород и соляная кислота
Хлор (Cl) – стоит в 3-м периоде, в VII группе главной подгруппы периодической системы, порядковый номер 17, атомная масса 35,453; относится к галогенам.
Физические свойства: газ желто-зеленого цвета с резким запахом. Плотность 3,214 г/л; температура плавления -101 °C; температура кипения -33,97 °C, При обычной температуре легко сжижается под давлением 0,6 МПа. Растворяясь в воде, образует хлорную воду желтоватого цвета. Хорошо растворим в органических растворителях, особенно в гексане (C6H14), в четырех-хлористом углероде.
Химические свойства хлора: электронная конфигурация: 1s22s22p63s22p5. На внешнем уровне 7 электронов. До завершения уровня нужен 1 электрон, который хлор принимает, проявляя степень окисления -1. Существуют и положительные степени окисления хлора вплоть до + 7. Известны следующие оксиды хлора: Cl2O, ClO2, Cl2O6 и Cl2O7. Все они неустойчивы. Хлор – сильный окислитель. Он непосредственно реагирует с металлами и неметаллами:
![]()
Реагирует с водородом. При обычных условиях реакция идет медленно, при сильном нагревании или освещении – со взрывом, по цепному механизму:
![]()
Хлор взаимодействует с растворами щелочей, образуя соли – гипохлориты и хлориды:
![]()
При пропускании хлора в раствор щелочи образуется смесь растворов хлорида и гипохлорита:
![]()
Хлор – восстановитель: Cl2 + 3F2 = 2ClF3.
Взаимодействие с водой:
![]()
Хлор не взаимодействует непосредственно с углеродом, азотом и кислородом.
Получение: 2NaCl + F2 = 2NaF + Cl2.
Электролиз: 2NaCl + 2H2O = Cl2 + H2 + 2NaOH.
Нахождение в природе: содержится в составе минералов: галит (каменная соль), сильвин, бишофит; морская вода содержит хлориды натрия, калия, магния и других элементов.
Хлороводород HCl . Физические свойства: бесцветный газ, тяжелее воздуха, хорошо растворим в воде с образованием соляной кислоты.
Получение: в лаборатории:
![]()
В промышленности: сжигают водород в струе хлора. Далее хлороводород растворяют в воде, и получают соляную кислоту (см. выше).
Химические свойства: соляная кислота – сильная, одноосновная, взаимодействует с металлами, стоящими в ряду напряжений до водорода: Zn + 2HCl = ZnCl2 + H2.
Как восстановитель реагирует с оксидами и гидроксидами многих металлов:
![]()
