
- •Лекція № 2. Білки
- •Загальна характеристика та функції білків
- •Амінокислоти
- •Пептиди
- •Класифікація білків
- •Прості білки
- •Складні білки
- •Амінокислотний склад рослинних білків
- •Проблема харчового білка та шляхи її вирішення
- •Загальні шляхи синтезу амінокислот
- •Утворення амінокислот при фотосинтезі
- •Утворення амінів
- •Метилювання амінокислот
- •Пул вільних амінокислот та їхня роль у рослині
- •Біосинтез білка
- •Література:
Амінокислоти
Як відомо, мономерами білків є амінокислоти. У складі білків як рослинних, так і тваринних знайдено 20 амінокислот:
|
Аланін |
Лейцин |
|
Аргінін |
Лізин |
|
Аспарагін |
Метіонін |
|
Аспарагінова кислота |
Пролін |
|
Валін |
Серин |
|
Гістидин |
Тирозин |
|
Гліцин |
Треонін |
|
Глутамін |
Триптофан |
|
Глутамінова кислота |
Фенілаланін |
|
Ізолейцин |
Цистеїн |
Ці амінокислоти називають протеїногенними, тому що вони входять до складу білка. Крім того, вони можуть міститися в клітині й у вільному стані, створюючи пул вільних амінокислот.
У молекулах амінокислот, як і моносахаридів, присутні асиметричні атоми вуглецю, отже, вони оптично активні та мають стереоізомери. Важливою парою стереоізомерів є D- і L-ізомери. Стандартом для визначення приналежності амінокислот до D- або L-ряду є серин, що має тільки один асиметричний атом вуглецю й одну пару стереоізомерів.

Усі природні амінокислоти зазвичай належать до L-ряду. Однак в останні десятиліття в рослинах, грибах і бактеріях були виділені в дуже малій кількості D-амінокислоти. Вони містяться у вільному стані або входять до складу коротких пептидів. Наприклад, D-фенілаланін виявлений у складі антибіотика граміцидину, D-пролін – в алкалоїдах ріжків, декілька D-амінокислот знайдено у Bacillus mesantericus, D-аспарагінова кислота – у водорості Chondria armata. У вищих рослин D-аспарагін виділений і насіння вики, а D-триптофан – із насіння карагани. У наш час встановлено, що D-амінокислоти з'являються в рослинах за несприятливих умов.
У рослинах, крім 20 перерахованих вище, виявлена велика кількість амінокислот (понад 250), що не входять до складу білкових молекул, а перебувають у вільному стані або зустрічаються в складі коротких пептидів. Їх називають непротеїногенними. Ці амінокислоти присутні в рослинах у малих кількостях і звичайно характерні для невеликої групи рослин (родина, рід).
Величезна кількість непротеїногенних амінокислот вимагала упорядкування. їх класифікували за подібністю до протеїногенних, розділивши на три основні групи.
1. Подібність за ізомерією. Непротеїногенні амінокислоти є ізомерами деяких протеїногенних.
α-Аланін – протеїногенна амінокислота, β-аланін не входить до складу білка, а міститься в пулі вільних амінокислот.

Багато його, наприклад, у яблуках. β-Аланін входить до складу пантотенової кислоти і коензиму А. Він є також стимулятором росту дріжджів.
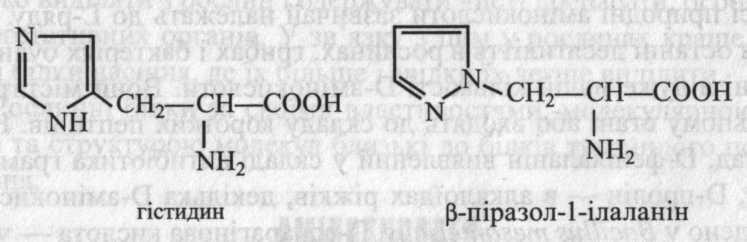
Гістидин входить до складу білка, а його ізомер β-піразол-1-ілаланін зустрічається тільки у вільному стані в рослин родини гарбузових.
2. Подібність за гомологією. Деякі непротеїногенні амінокислоти гомологічні протеїногенним.
Непротеїногенні амінокислоти мають у вуглецевому ланцюгу на один вуглецевий атом більше, ніж відповідні протеїногенні: серин і гомосерин, цистеїн і гомоцистеїн, аргінін і гомоаргінін.
3. Подібність за аналогією. Аналогія може бути двох типів: а) за заміщенням – у цьому разі в молекулі протеїногенної амінокислоти один атом водню заміщений будь-якою групою, в результаті чого утворюється непротеїногенна амінокислота: Цистеїн і S-метилцистеїн, фенілаланін і карбоксифенілаланін.

S-Метилцистеїн поширений у рослинах і може виступати донором метильних груп у реакціях метилювання. Карбоксифенілаланін знайдений в ірисах, резеді;
б) за подібністю у будові молекули:

Будова цих двох амінокислот схожа. α-Метиленциклопропілгліцин – непротеїногенна кислота, яка була виділена з насіння їстівних плодів лічі китайської.
Непротеїногенні амінокислоти виконують у рослинах цілу низку важливих функцій:
1. Деякі непротеїногенні амінокислоти беруть участь в утворенні протеїногенних. Наприклад, із гомосерину утворюються треонін і метіонін, а з непротеїногенної діамінопімелінової кислоти – лізин.

2. Непротеїногенні амінокислоти можуть бути запасною формою азоту і сірки. Амінокислоти, у молекулах яких міститься два і більше атомів азоту, можуть накопичуватися в насінні у вигляді його запасної форми, а при проростанні віддавати азот на утворення необхідних проростку амінокислот. Наприклад, орнітин, цитрулін, гомоаргінін, діаміномасляна кислота, β-піразол-1-ілаланін.
Як запасна сірка в насінні можуть відкладатися похідні цистеїну, наприклад S-метилцистеїн.
3. Ряд непротеїногенних амінокислот є транспортною формою азоту. Це, наприклад, похідні аспарагінової та глутамінової кислот та їхніх амідів.
Вони не накопичуються в насінні, але зустрічаються в провідних тканинах рослин. Такою транспортною формою є похідні -глутамінової кислоти і глутаміну.


4. Захисна функція. Її непротеїногенні амінокислоти виконують по-різному:
а) орнітин і цитрулін беруть участь у знешкодженні аміаку в орнітиновому циклі;
б) за несприятливих умов утворюється ряд непротеїногенних амінокислот, що зв'язують аміак, який накопичується при розпаді білків (діаміномасляна кислота);
в) у несприятливих умовах накопичується «стресовий» фітогормон етилен. Вихідною сполукою для нього служить метіонін, а проміжним продуктом біосинтезу є непротеїногенна амінокислота аміноциклопропілкарбонова. Вона також є транспортною формою етилену.

