
- •Міністерство освіти і науки України
- •Передмова
- •Робоча програма
- •Приклади виконання завдань
- •Контрольні завдання
- •Основні класи неорганічних сполук основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Термохімія та термохімічні розрахунки основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Ентропія, енергія гіббса та напрямленість процесів основні поняття та визначення
- •Приклади виконання завдань
- •Визначити можливість перебігу реакції
- •Визначити, за якої температури настане рівновага в системі
- •Контрольні завдання
- •Хімічна кінетика основні поняття та визначення
- •Приклади виконання завдань
- •Визначити швидкість реакції
- •Контрольні завдання
- •Хімічна рівновага основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •II модуль розчини. Концентрації розчинів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Властивості розчинів неелектролітів. Основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електролітична дисоціація ступінь та константа дисоціації основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Іонний добуток води. Водневий показник основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Іонна рівновага в гетерогенних системах добуток розчинності основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Реакції в розчинах електролітів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Гідроліз солей основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Колоїдні розчини основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Будова атома основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •III модуль окисно-відновні реакції основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Гальванічні елементи основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Корозія металів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Электроліз розплавів і водних розчинів електролітів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Твердість води основні поняття та визначення
- •Приклади виконання завдань
- •Приклад 2. Визначення маси солі, розчиненої в певному об’ємі води, за величиною твердості води.
- •Контрольні завдання
- •Карбонатна рівновага. Форми існування со2 у воді. Основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Список рекомендованої літератури Основна література
- •Додаткова література
- •Додаток абудова речовини а1.Будова атома
- •А2.Періодична система елементів д. І.Менделєєва та електронна теорія будови атомів
- •Головна підгрупа Побічна група
- •Двох періодів.
- •Відносні електронегативності елементів(за шкалою Полінга)
- •А3. Хімічний зв’язок і будова молекул
- •2 Відштовхування rзв.Е, кДж/моль
- •Елементів д.І.Менделєєва
- •Навчальне видання
Гідроліз солей основні поняття та визначення
|
Гідроліз солей |
- реакція обмінної взаємодії між водою і розчиненими в ній солями, що супроводжується зміною рН середовища внаслідок утворення слабкої кислоти (її кислої солі) або слабкої основи (її основної солі). |
Приклади виконання завдань
Приклад 1. Гідроліз солі, утвореної сильною основою і слабкою кислотою.
Скласти іонне та молекулярне рівняння гідролізу солі NaСN.
Відповідь: Натрій ціанід –сіль, утворена слабкою одноосновною кислотою HCN та сильною однокислотною основою NaOH. При розчиненні у воді молекули NaCN повністю дисоціюють на катіони Na+ та аніони CN-. Катіони Na+ не можуть зв’язувати іони ОН– води, бо NaOH сильний електроліт. Аніони CN–зв’язують іони Н+ води, утворюючи молекули слабкого електроліту HCN. Сіль гідролізує за аніоном. Скорочене іонне рівняння гідролізу:
CN –+H2O↔HCN+OH .–
Повне іонне рівняння утворюється при додаванні до лівої і правої частин його іонів Na+:
Na++CN–+H2O↔HCN+OH–+Na+.
Рівняння реакції гідролізу в молекулярній формі:
![]() .
.
У результаті гідролізу в розчині виникає надлишок іонів ОН-, які зумовлюють лужне середовище (рН >7).
Приклад 2. Ступінчастий гідроліз солі, утвореної сильною основою і слабкою багатоосновною кислотою.
Скласти молекулярні та іонні рівняння гідролізу солі К2СО3.
Відповідь.
Калій
карбонат –
сіль,
утворена слабкою двохосновною кислотою
Н2СО3
та сильною однокислотною основою КОН.
У даному випадку аніони солі
![]() ,
зв’язуючи іони Н+
води, утворюють аніони кислої солі
,
зв’язуючи іони Н+
води, утворюють аніони кислої солі
![]() ,
тому що іони
,
тому що іони![]() дисоціюють важче, ніж молекули Н2СО3.
За звичайних умов гідроліз відбувається
за першим ступенем. Сіль гідролізує за
аніоном. Скорочене іонне рівняння
гідролізу:
дисоціюють важче, ніж молекули Н2СО3.
За звичайних умов гідроліз відбувається
за першим ступенем. Сіль гідролізує за
аніоном. Скорочене іонне рівняння
гідролізу:
![]() .
.
Додаючи до лівої та правої частин рівняння іони калію, одержуємо повне іонне рівняння реакції:
![]()
Рівняння реакції гідролізу К2 СО3 в молекулярній формі:
![]()
У результаті гідролізу в розчині виникає надлишок іонів ОН-, які зумовлюють лужне середовище (рН > 7).
Приклад 3. Гідроліз солі, утвореної слабкою основою і сильною кислотою.
Скласти молекулярне та іонне рівняння гідролізу солі NH4Cl.
Відповідь.
Сіль
NH4Cl
утворена
сильною кислотою HCl
та слабкою основою NH4ОН.
У даному випадку катіони солі
![]() зв’язують гідроксид-іони води, утворюючи
молекули слабкого електролітуNH4OH.
Аніони
Cl¯
не
можуть зв’язувати іони Н+,
бо НСl
– сильний
електроліт.
Сіль гідролізує за катіоном. Скорочене
іонне рівняння гідролізу:
зв’язують гідроксид-іони води, утворюючи
молекули слабкого електролітуNH4OH.
Аніони
Cl¯
не
можуть зв’язувати іони Н+,
бо НСl
– сильний
електроліт.
Сіль гідролізує за катіоном. Скорочене
іонне рівняння гідролізу:
![]()
Додаючи до правої і лівої частин рівняння хлорид-іони, одержуємо повне іонне рівняння реакції:
![]()
Рівняння реакції гідролізу в молекулярній формі:
![]() .
.
У результаті гідролізу в розчині виникає надлишок іонів Н+, які зумовлюють кисле середовище (рН < 7).
Приклад 4. Ступінчастий гідроліз солі, утвореної слабкою багатокислотною основою і сильною кислотою.
Скласти молекулярні та іонні рівняння гідролізу солі CdSO4.
Відповідь: Кадмій сульфат – сіль утворена слабкою двокислотною основою Cd(OH)2 та сильною двохосновною кислотою H2SO4. У даному випадку катіони Cd2+ зв’язують гідроксид-іони води, утворюючи катіони основної солі CdOH+. Молекули Cd(OH)2 не утворюються, бо іони CdOH+ дисоціюють важче, ніж молекули Cd(OH)2. За звичайних умов гідроліз відбувається за першим ступенем. Сіль гідролізує за катіоном. Скорочене іонне рівняння гідролізу:
![]()
Додаючи
до лівої та правої частин рівняння іони
![]() ,
одержуємо повне іонне рівняння:
,
одержуємо повне іонне рівняння:
![]()
а в молекулярній формі:
![]()
У результаті гідролізу в розчині виникає надлишок іонів водню, тому розчин CdSO4 має кислу реакцію (рН < 7).
При підвищенні температури відбувається другий ступінь гідролізу, тому що посилюється дисоціація молекул води. Скорочене іонне рівняння гідролізу за другим ступенем:
![]()
Додаючи до правої
і лівої частин рівняння іони
![]() одержуємо повне іонне рівняння реакції:
одержуємо повне іонне рівняння реакції:
![]()
Рівняння реакції гідролізу в молекулярній формі:
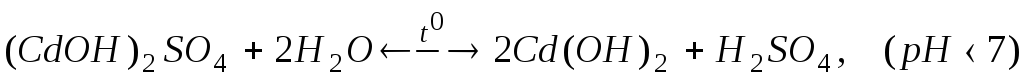
У результаті гідролізу в розчині виникає надлишок іонів Н+, які зумовлюють кисле середовище рН < 7.
Приклад 5. Процеси при змішуванні солей, які взаємно посилюють гідроліз одне одного.
Які продукти утворюються в результаті змішування розчинів Fe(NO3)3 і К2СО3? Скласти іонні та молекулярні рівняння реакцій.
Відповідь: Сіль Fe(NO3)3 гідролізує за катіоном , а К2СО3 – за аніоном:
![]()
![]()
Якщо розчини даних солей знаходяться в одній посудині, то відбувається взаємне посилення гідролізу кожної з солей, тому що іони Н+ і ОН– утворюють молекулу слабкого електроліту Н2О. Тоді рівновага гідролізу зміщується праворуч, і гідроліз кожної солі йде до кінця з утворенням Fe(OH)3 та Н2СО3. Іонне рівняння гідролізу:
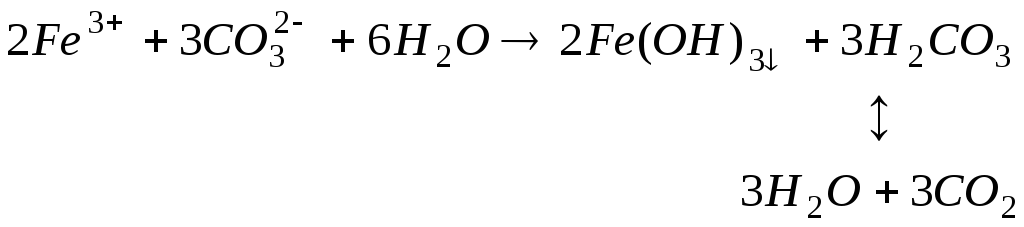 ;
;
і рівняння в молекулярній формі:
![]() .
.
