
- •Міністерство освіти і науки України
- •Робоча програма
- •Приклади виконання задач
- •Швидкість реакції збільшилась у:
- •Варіант тесту до другого модуля
- •Приклади виконання задач
- •Варіант тесту до третього модуля
- •Приклади виконання задач
- •Список літератури
- •1 Основи загальної хімії / р.А. Яковлєва, л.С. Сухорукова, т.І. Курова та ін. – Харків: Консум, 2005. – 152 с.
Міністерство освіти і науки України
ХАРКІВСЬКИЙ ДЕРЖАВНИЙ ТЕХНІЧНИЙ
УНІВЕРСИТЕТ БУДІВНИЦТВА ТА АРХІТЕКТУРИ
МЕТОДИЧНІ ВКАЗІВКИ
ДО ВИКОНАННЯ ТЕСТОВИХ ЗАВДАНЬ З ХІМІЇ
Харків 2008
Міністерство освіти і науки України
ХАРКІВСЬКИЙ ДЕРЖАВНИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ
БУДІВНИЦТВА ТА АРХІТЕКТУРИ
МЕТОДИЧНІ ВКАЗІВКИ
ДО ВИКОНАННЯ ТЕСТОВИХ ЗАВДАНЬ З ХІМІЇ
для студентів усіх спеціальностей
Затверджено
на засіданні кафедри
загальної хімії.
Протокол № 18 від 4.06.2007 р.
Харків
ХДТУБА 2008
Методичні вказівки до виконання тестових завдань з хімії для студентів усіх спеціальностей /Укладачі: Р.А.Яковлєва, Т.М. Обіженко, Ю.М. Данченко та ін. – Харків: ХДТУБА, 2008. – 28 с.
Рецензент Т.О. Костюк
Кафедра загальної хімії
ВСТУП
Методичні вказівки призначені для надання допомоги студентам під час самостійної підготовки до виконання тестових завдань з хімії.
Видання вміщує робочу програму курсу, що розподілена відповідно до модульно-рейтингової системи навчання. Курс загальної хімії містить три змістових модулі, вивчення кожного з яких закінчується виконанням модульної контрольної роботи. Розподіл тем за модулями дає змогу використовувати теоретичні знання, що викладаються під час вивчення курсу хімії, а також виділені для самостійного опрацювання, у процесі підготовки до відповідного модульного контролю.
Методичні вказівки містять приклади розв’язання задач та відповіді на теоретичні питання, з яких складаються тестові завдання, а також варіанти тестів до кожного модуля.
Робоча програма
Робоча програма складена на основі освітньо-професійної програми вищої школи за професійним напрямом “Будівництво”.
ПЕРШИЙ МОДУЛЬ
Предмет хімії та її зв’язок з іншими науками. Основні проблеми сучасної хімії. Значення хімії у формуванні світогляду, у вивченні природи і розвитку техніки. Хімія і охорона навколишнього середовища.
ОСНОВНІ ЗАКОНИ І ПОНЯТТЯ ХІМІЇ
Основні положення атомно-молекулярної теорії. Агрегатні стани речовин. Основні закони хімії. Стехіометричні розрахунки. Закони газового стану. Класифікація та номенклатура хімічних сполук. Основні класи неорганічних сполук.
2 ЗАГАЛЬНІ ЗАКОНОМІРНОСТІ ПЕРЕБІГУ ХІМІЧНИХ
РЕАКЦІЙ
2.1 Енергетика хімічних процесів
Основні поняття термодинаміки. Внутрішня енергія та ентальпія. Теплові ефекти хімічних реакцій. Теплоти утворення та згоряння хімічних сполук. Закони термохімії. Термохімічні розрахунки.
2.2 Напрямленість перебігу хімічних реакцій
Ентропія та ії зміна під час хімічних процесів і фазових перетворень. Енергія Гіббса і енергія Гельмгольца. Критерій можливості і напрямленості хімічних процесів. Термодинамічні умови хімічної рівноваги.
2.3 Хімічна кінетика
Швидкість хімічних реакцій та фактори, що на неї впливають. Закон діючих мас. Залежність швидкості реакції від температури. Енергія активації хімічної реакції.
2.4 Хімічна рівновага
Оборотні й необоротні реакції. Кінетичні уявлення про хімічну рівновагу. Константа рівноваги. Зміщення хімічної рівноваги. Принцип Ле-Шательє.
3 БУДОВА АТОМІВ І ВИДИ ХІМІЧНОГО ЗВ’ЯЗКУ
3.1 Будова атома і систематика хімічних елементів
Квантово-механічна модель атома. Будова багатоелектронних атомів. Періодичний закон та періодична система елементів Д.І.Менделєєва.
3.2 Хімічний зв’язок і будова молекул
Основні види та характеристики хімічного зв’язку. Ковалентний та іонний зв’язки. Будова молекул. Міжмолекулярний зв’язок.
ДРУГИЙ МОДУЛЬ
РОЗЧИНИ. ДИСПЕРСНІ СИСТЕМИ
4.1 Розчини неелектролітів
Характеристика розчинів та способи вираження їхнього складу. Колігативні властивості розчинів.
4.2 Розчини електролітів
Електролітична дисоціація. Ступінь і константа дисоціації. Реакції в розчинах електролітів. Електролітична дисоціація води. Іонний добуток води. Водневий показник. Поняття про індикатори. Гідроліз солей.
4.3 Гетерогенні дисперсні системи
Класифікація дисперсних систем. Стан речовини на межі поділу фаз. Адсорбція. Емульсії, суспензії, колоїдні розчини. Кінетична та агрегативна стійкість дисперсних систем. Коагуляція. Гелі.
ОКИСНО-ВІДНОВНІ РЕАКЦІЇ
Окисно-відновні реакції, їхня класифікація. Найважливіші окисники та відновники. Методи складання рівнянь окисно-відновних реакцій.
ТРЕТІЙ МОДУЛЬ
6 ОСНОВИ ЕЛЕКТРОХІМІЇ
6.1 Електрохімічні процеси
Поняття про електродні потенціали. Стандартний водневий електрод і воднева шкала потенціалів.
Гальванічні елементи. Електрорушійна сила гальванічного елемента. Електроліз. Послідовність електродних процесів. Закони Фарадея.
6.2 Корозія металів
Основні види корозії. Хімічна корозія. Електрохімічна корозія. Методи захисту металів від корозії.
6.3 Електроліз
Електроліз розчинів і розплавів електролітів. Послідовність розрядження іонів. Електроліз з інертними і активними анодами. Закон Фарадея.
7 ХІМІЧНІ ЕЛЕМЕНТИ І МАТЕРІАЛИ, ЩО ВИКОРИСТОВУЮТЬСЯ
В БУДІВНИЦТВІ
7.1 Метали підгрупи берилію та їхні сполуки
Магній та його сполуки. Кальцій та його сполуки. Твердість природних вод. Вапняні та гіпсові в’яжучі.
7.2 Кремній та його сполуки
Оксиди кремнію. Кремнієві кислоти. Солі кремнієвих кислот: силікати, алюмосилікати. Портландцемент. Взаємодія мінералів цементного клінкеру з водою. Корозія бетону. Методи захисту бетону від корозії.
ПРИКЛАДИ РОЗВ’ЯЗАННЯ ТЕСТОВИХ ЗАВДАНЬ
ВАРІАНТ ТЕСТУ ДО ПЕРШОГО МОДУЛЯ
1 Який об’єм водню виділиться за нормальних умов, якщо розчинити алюміній масою 10,8г у надлишку соляної кислоти?
а) 4,48л; б) 13,44л; в) 26,88л; г) 8,68л.
2 Деякий газ масою 160г займає об’єм 20л при температурі 270С та тиску 623,25 кПа. Визначити молярну масу газу.
а) 3г/моль; б) 18г/моль; в) 32 г/моль; г) 31,2г/моль.
3 Знайти молярну масу еквівалента металу, з 4г якого утворюється 6,632г оксиду.
а) 12,16 г/моль; б) 0,08г/моль; в) 4,83г/моль; г) 1,32г/моль.
4 Скільки солей можна одержати під час взаємодії сірчаної кислоти з гідроксидом кальцію? Відповідь підтвердити відповідними формулами та назвами солей.
а) 2; б) 1; в) 3; г) 4.
5 Визначити
тепловий ефект реакції за відомими
величинами стандартних теплот утворення
речовин:
![]() .
.
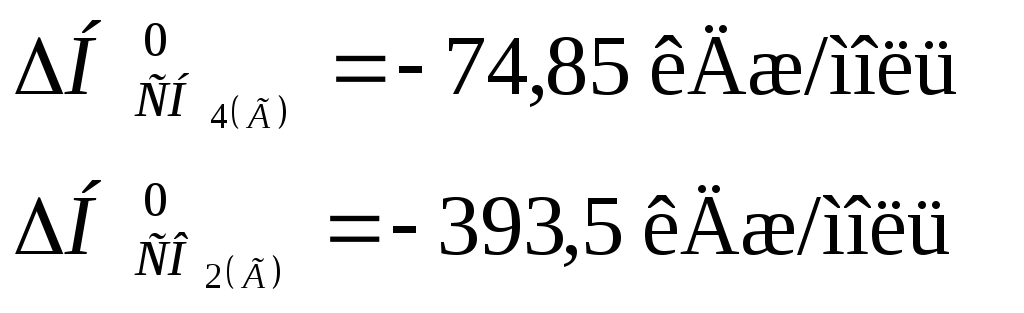
![]() =
–110,5 кДж/моль
=
–110,5 кДж/моль
![]() =
0
=
0
а) – 689,36 кДж; б) 247,36 кДж; в) 357,86 кДж; г) – 247,36 кДж.
6 Як зміниться ентропія під час перетворень
а) води в пару;
б)
![]() ?
Чому?
?
Чому?
а) збільшиться; б) зменшиться; в) не зміниться.
7 Відновлення
![]() воднем відбувається за рівнянням
воднем відбувається за рівнянням
![]()
Розрахувати G реакції за відомими величинами стандартних енергій Гіббса. Чи можлива ця реакція за стандартних умов?
ΔG0(Fe2O3(к)) = – 740,99 кДж/моль
ΔG0(H2O(г)) = – 228,8 кДж/моль
ΔG0(Fe(к)) =0
ΔG0(H2(г)) =0
а) –54,59 кДж, реакція можлива;
б) 512,19 кДж, реакція можлива;
в) – 512,19 кДж, реакція неможлива;
г) 54,59 кДж, реакція неможлива.
8 Як зміниться швидкість
прямої реакції
![]() ,
якщо підвищити тиск у 3 рази?
,
якщо підвищити тиск у 3 рази?
а) збільшиться у 27 разів;
б) зменшиться у 27 разів;
в) збільшиться у 9 разів;
г) зменшиться у 9 разів.
9 У скільки разів збільшиться швидкість реакції з підвищенням температури на 400С, якщо температурний коефіцієнт реакції дорівнює 3?
а) 12; б) 81; в) 2; г) 9.
10
Визначити константу рівноваги гомогенної
системи
![]() ,
якщо рівноважні концентрації реагуючих
речовин становлять:[N2]
= 0,4 моль/л; [Н2]
= 1 моль/л; [NH3]
= 1 моль/л.
,
якщо рівноважні концентрації реагуючих
речовин становлять:[N2]
= 0,4 моль/л; [Н2]
= 1 моль/л; [NH3]
= 1 моль/л.
а) 1; б) 2,5; в) 6,25; г) 0,4.
11 Назвати оптимальні умови, необхідні для збільшення виходу продуктів реакції в системі:
![]() кДж/моль
кДж/моль
а) підвищення температури; зменшення тиску; збільшення концентрації PCl5 або зменшення концентрацій PCl3 і Cl2;
б) зниження температури; зменшення тиску; збільшення концентрації PCl5 або зменшення концентрацій PCl3 і Cl2;
в) підвищення температури; збільшення тиску; збільшення концентрації PCl5 або зменшення концентрацій PCl3 і Cl2;
г) підвищення температури; зменшення тиску; зменшення концентрації PCl5 або збільшення концентрацій PCl3 і Cl2.
12 Яка з представлених електронних формул є формулою іона хлору?
а)
![]() ;
;
б)
![]() ;
;
в)
![]() ;
;
г)
![]() .
.
