
- •Міністерство освіти і науки України
- •Передмова
- •Робоча програма
- •Приклади виконання завдань
- •Контрольні завдання
- •Основні класи неорганічних сполук основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Термохімія та термохімічні розрахунки основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Ентропія, енергія гіббса та напрямленість процесів основні поняття та визначення
- •Приклади виконання завдань
- •Визначити можливість перебігу реакції
- •Визначити, за якої температури настане рівновага в системі
- •Контрольні завдання
- •Хімічна кінетика основні поняття та визначення
- •Приклади виконання завдань
- •Визначити швидкість реакції
- •Контрольні завдання
- •Хімічна рівновага основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •II модуль розчини. Концентрації розчинів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Властивості розчинів неелектролітів. Основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електролітична дисоціація ступінь та константа дисоціації основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Іонний добуток води. Водневий показник основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Іонна рівновага в гетерогенних системах добуток розчинності основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Реакції в розчинах електролітів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Гідроліз солей основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Колоїдні розчини основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Будова атома основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •III модуль окисно-відновні реакції основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Гальванічні елементи основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Корозія металів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Электроліз розплавів і водних розчинів електролітів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Твердість води основні поняття та визначення
- •Приклади виконання завдань
- •Приклад 2. Визначення маси солі, розчиненої в певному об’ємі води, за величиною твердості води.
- •Контрольні завдання
- •Карбонатна рівновага. Форми існування со2 у воді. Основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Список рекомендованої літератури Основна література
- •Додаткова література
- •Додаток абудова речовини а1.Будова атома
- •А2.Періодична система елементів д. І.Менделєєва та електронна теорія будови атомів
- •Головна підгрупа Побічна група
- •Двох періодів.
- •Відносні електронегативності елементів(за шкалою Полінга)
- •А3. Хімічний зв’язок і будова молекул
- •2 Відштовхування rзв.Е, кДж/моль
- •Елементів д.І.Менделєєва
- •Навчальне видання
Контрольні завдання
321. Визначити ступінь дисоціації сульфідної кислоти в 0,1 М розчині, якщо константа дисоціації за першим ступенем дорівнює 1,1·10-7.
Відповідь: 1,05·10-3.
322. Визначити ступінь дисоціації ацетатної кислоти в 1М розчині, якщо константа дисоціації дорівнює 1,75·10-5
Відповідь: 4,2·10-3.
323. Визначити константу дисоціації ацетатної кислоти в 0,1 М розчині, якщо ступінь дисоціації дорівнює 1,34%.
Відповідь: 1,79·10-5.
324. Визначити ступінь дисоціації купрум(II) гідроксиду в 0,1 М розчині, якщо константа дисоціації дорівнює 3,4·10-7.
Відповідь: 0,18%.
325. Визначити константу дисоціації алюміній гідроксиду в 0,1М розчині, якщо ступінь дисоціації дорівнює 1,33%.
Відповідь: 1,77·10-5.
326. Знайти константу дисоціації сульфідної кислоти в 0,1 М розчині, якщо ступінь дисоціації дорівнює 0,105%.
Відповідь: 1,1·10-7.
327. Розрахувати ступінь дисоціації купрум(II) гідроксиду в 0,01 М розчині, якщо константа дисоціації дорівнює 3,4·10-7.
Відповідь: 0,58%.
328. Знайти константу дисоціації нітритної кислоти в 0,01 М розчині, якщо ступінь дисоціації дорівнює 0,22.
Відповідь: 4,84·10-4
329. Розрахувати ступінь дисоціації сульфідної кислоти в 0,1 М розчині, якщо константа дисоціації дорівнює 1,1·10-7.
Відповідь: 0,105%.
330. Розрахувати ступінь дисоціації нітритної кислоти в 0,01 М розчині, якщо константа дисоціації дорівнює 5,1·10-4.
Відповідь: 22,6%.
331. Знайти константу дисоціації ацетатної кислоти в 0,01 М розчині, якщо ступінь дисоціації дорівнює 4,25%.
Відповідь: 1,81·10-5.
332. Знайти константу дисоціації ацетатної кислоти в 1М розчині, якщо ступінь дисоціації дорівнює 0,42.
Відповідь: 1,76·10-5.
333. Визначити ступінь дисоціації фторидної кислоти в 0,1 М розчині, якщо константа дисоціації дорівнює 7,4·10-4.
Відповідь: 8,23%.
334. Визначити ступінь дисоціації мурашиної кислоти НСООН в 0,1 М розчині, якщо константа дисоціації дорівнює 1,8·10-4.
Відповідь: 4,2%.
335. Визначити ступінь дисоціації ціанідної кислоти в 0,05 М розчині, якщо константа дисоціації дорівнює 7,9·10-10.
Відповідь: 0,013%.
336. Визначити ступінь дисоціації хлорнуватистої кислоти HClO в 0,001 М розчині, якщо константа дисоціації дорівнює 5,0·10-8.
Відповідь: 0,07%.
337. Визначити ступінь дисоціації нітритної кислоти в 0,02 М розчині, якщо константа дисоціації дорівнює 4·10-4.
Відповідь: 15,8%.
338. Знайти константу дисоціації мурашиної кислоти в 0,2 М розчині, якщо ступінь дисоціації НСООН дорівнює 3,2%.
Відповідь: 2·10-4.
339. Знайти константу дисоціації HClO в 0,1 М розчині, якщо ступінь дисоціації кислоти дорівнює 0,07%.
Відповідь: 4,9·10-8.
340. Знайти константу дисоціації карбонатної кислоти в 0,15 М розчині, якщо ступінь дисоціації Н2СО3 дорівнює 0,173%.
Відповідь: 4,5·10-7.
341. Визначити ізотонічний коефіцієнт розчину ацетатної кислоти і ступінь її дисоціації, якщо в 1 л 0,01М розчину міститься 6,26·1021 молекул і іонів цієї кислоти.
Відповідь:1,04, 4%.
342. Визначити уявний ступінь дисоціації HNO3, якщо розчин 0,25 моль HNO3 в 2,5 л води замерзає при -0,350С.
Відповідь: 89%.
343.
Осмотичний тиск 0,05 молярного розчину
калій карбонату при 00С
дорівнює 136,3 кПа. Визначити уявний
ступінь дисоціації
![]() в розчині.
в розчині.
Відповідь: 70%.
344. Розчин KNO3 з процентною концентрацією 8,43% закипає при 100,80С. Ебуліоскопічна стала води Е = 0,520С·кг/моль. Обчислити уявний ступінь дисоціації KNO3 в розчині.
Відповідь: 69%
345.
При 1000С
тиск пари над розчином, що містить 0,05
моль
![]() в 450г води, дорівнює 100,78 кПа. Визначити
уявний ступінь дисоціації
в 450г води, дорівнює 100,78 кПа. Визначити
уявний ступінь дисоціації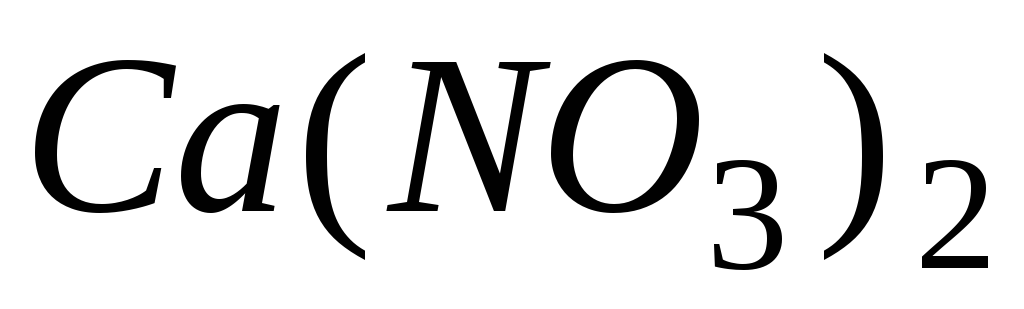 .
.
Відповідь: 80%.
346. Розчин 0,53 г Na2CO3 в 200 г води замерзає при -0,130С. Визначити уявний ступінь дисоціації солі.
Відповідь: 90%
347.
Ізотонічний коефіцієнт 1 молярного
розчину
![]() дорівнює 1,03. Скільки розчинених частинок
міститься в 10-3
л цього розчину.
дорівнює 1,03. Скільки розчинених частинок
міститься в 10-3
л цього розчину.
Відповідь: 6,2·1020.
348. Визначити ізотонічний коефіцієнт розчину, який замерзає при -0,5190С і складається з 2,1 г КОН і 250 г води.
Відповідь: 1,86
349.
Розрахувати відносне зниження тиску
водяної пари при деякій температурі
над розчином, що складається з 7,1 г Na2SO4
і 500 г води. Уявний ступінь дисоціації
![]() в цьому розчині дорівнює 75%.
в цьому розчині дорівнює 75%.
Відповідь: 4,5·10-3.
350. Обчислити ізотонічний коефіцієнт для 2н розчину CaCl2, що має при 200С осмотичний тиск 5600 кПа. Визначити уявний ступінь дисоціації CaCl2 в цьому розчині.
Відповідь: 2,3; 65%.
351. Визначити ступінь дисоціації фторидної кислоти, якщо при розчиненні 0,1 моль HF в 1 л води утворюється 1,81·1022 іонів і 5,12·1022 молекул цієї кислоти.
Відповідь: 15%.
352. Визначити осмотичний тиск розчину MgSO4 з молярною концентрацією 0,1 моль/л, якщо уявний ступінь дисоціації солі дорівнює 0,5.
Відповідь: 187 кПа.
353. Тиск водяної пари над розчином 22,2 г CaCl2 в 1000 г води при 200С становить 2,32 кПа, а тиск пари над водою за тієї самої температури – 2,34 кПа. Визначити уявний ступінь дисоціації солі в розчині.
Відповідь: 69,5%.
354. При розчиненні NaOH масою 12 г в 100 г води температура кипіння підвищилась на 2,650С. Ебуліоскопічна стала води Е=0,520С·кг/моль. Визначити уявний ступінь дисоціації NaOH.
Відповідь: 70%.
355. Чому дорівнює осмотичний тиск 0,1 молярного розчину KCl при 170С, якщо уявний ступінь дисоціації цієї солі становить 85%?
Відповідь: 445,8 кПа.
356. Обчислити ізотонічний коефіцієнт розчину MgCl2, якщо уявний ступінь дисоціації солі складає 75%.
Відповідь: 2,5.
357. Визначити уявний ступінь дисоціації CaCl2 в розчині, який містить 4,47г CaCl2 в 100 г води, і замерзає при -20С.
Відповідь: 80%.
358. Обчислити тиск пари при 1000С над розчином, який складається з 24,8 г КСl і 100 г води. Уявний ступінь дисоціації солі дорівнює 75%.
Відповідь: 91,7 кПа.
359. Визначити уявний ступінь дисоціації NH4Cl, якщо для приготування розчину взяли сіль масою 1,07 г і воду об’ємом 200 мл. Температура кипіння цього розчину дорівнює 100,090С.
Відповідь: 73%.
360.Обчислити ізотонічний коефіцієнт розчину ZnSO4 з молярною концентрацією 0,1 моль/л , якщо уявний ступінь дисоціації складає 40%.
Відповідь: 1,4
