
Научные стремления 2012-1
.pdf
УДК 579.67; 57.089
Дмитрачкова О.В.1,2, Герасимович А.Д.2, Новик Г.И.2
МЕТОДЫ ДЛИТЕЛЬНОГО ХРАНЕНИЯ БАКТЕРИОФАГОВ
LACTOCOCCUS LACTIS
1 Международный государственный экологический университет им.А. Д. Сахарова, Минск
2Институт микробиологии НАН Беларуси, Минск
Вирусы бактерий рода Lactococcus широко распространены на предприятиях молочной промышленности. Благоприятной средой для их развития являются бактериальные закваски, применяемые на молокоперерабатывающих комбинатах с целью получения ферментированных продуктов. Бактериофаги обусловливают лизис бактерий рода Lactococcus, в результате чего снижается активность заквасок, увеличиваются сроки выработки продукта, ухудшается его качество, что выражается в серьезном экономическом ущербе для производства [1, 2].
Создание коллекционного фонда бактериофагов и индикаторных культур молочнокислых бактерий связано с необходимостью получения фагорезистентных заквасок молочнокислых бактерий, используемых для ферментации молока при производстве молочнокислых продуктов. В связи с этим актуальной является проблема длительного сохранения лактофагов, применяемых для фаготипирования бактериальных заквасок и выявления фагоустойчивых культур бактерий.
Основными методами консервации являются: высушивание, лиофилизация, L-высушивание, хранение при низких температурах [3-5]. Каждый метод имеет как достоинства, так и недостатки, поэтому обязательным условием осуществления поддержания культур в коллекциях является использование, как правило, не менее двух методов.
Внастоящее время для длительного хранения культур микроорганизмов
вколлекционных фондах применяются такие методы, как криоконсервация и лиофилизация. Выживаемость вирусов при использовании этих методов зависит от большого количества факторов, недостаточно изученных в
настоящее время. Таким образом, актуальным остается вопрос выбора наиболее оптимальных условий консервации.
Криоконсервация как метод долгосрочного хранения микроорганизмов.
В настоящее время криоконсервация является наиболее перспективным методом долгосрочного хранения микроорганизмов. При криоконсервации удается получить высокий уровень жизнеспособных клеток, титр которых при длительном хранении в жидком азоте сохраняется на исходном уровне, что делает практически неограниченным возможное время хранения. Существенным преимуществом криоконсервации перед высушиванием и лиофилизацией является возможность сохранения высокой биохимической активности и генетической стабильности, что чрезвычайно важно для
241

штаммов-продуцентов, перспективных для использования в биотехнологии
[5].
Криоконсервация обеспечивает сохранение большего количества жизнеспособных клеток по сравнению с другими методами [3, 4], а сохраняемые культуры микроорганизмов оказываются менее поврежденными и имеют более высокий уровень жизнеспособности, чем при высушивании и лиофилизации. Преимущества криоконсервации состоят также в простоте метода подготовки культур для хранения и быстром восстановлении активности микроорганизмов после замораживания. Однако разработка методов криоконсервации для конкретных микробиологических объектов требует предварительной многоплановой исследовательской работы, связанной с изучением механизмов криозащиты и криоповреждения клеток, установлением закономерностей, связанных с изменением физиологобиохимических свойств микроорганизмов после репарации.
Для бактериофагов наиболее эффективным способом длительного хранения является их хранение при температурах ниже -130°С. Чувствительность фагов к действию низких температур и изменению режимов охлаждения–отогрева связана с особенностями их строения. Бактериофаги L. lactis лучше переносят процесс криоконсервирования при низких скоростях замораживания и быстром последующем отогреве. При замораживании в жидком азоте титр фагов снижается на порядок вне зависимости от отогрева. Для сохранения жизнеспособности и вирулентной активности бактериофагов молочнокислых стрептококков требуются следующие условия криоконсервации: медленное охлаждение со скоростью 4 °С/мин в морозильной камере, использование 10 % сахарозы и быстрый отогрев при 37 °С на водяной бане. Замораживание концентрированной суспензии фага также увеличивает выживаемость вирусов [6].
Лиофилизация как метод консервации микроорганизмов. Лиофилизация является одним из самых эффективных и экономичных методов длительного хранения микроорганизмов. Это широко распространенный способ высушивания биоматериалов из замороженного состояния, при котором вода испаряется в условиях вакуума без оттаивания льда, что позволяет полностью сохранять первичную структуру объекта сушки. Преимуществами метода лиофилизации являются: отсутствие воздействия высоких температур на препарат; сохранение дисперсной фазы препарата; возможность использования летучих растворителей. Недостатками лиофилизации являются: необходимость тщательной подготовки препарата к сушке; создание высокого вакуума для полноты высыхания; значительная длительность цикла обработки, т.к. процесс происходит при очень низкой температуре и очень низком давлении; значительное потребление энергии.
Между устойчивостью бактериофагов к процессу лиофилизации и их структурными характеристиками, морфологическими типами и размером существует определенная зависимость [7]. Бактериофаги, имеющие в своей структуре длинный сокращающийся отросток, по современной
242

классификации относящиеся к отряду Caudovirales, семейству Myoviridae, наиболее чувствительны к лиофилизации. Фаги с длинным несокращающимся отростком – семейство Siphoviridae – являются устойчивыми как к сублимационной сушке, так и к замораживанию. Фаги с коротким несокращающимся отростком – Podoviridae, и фаги не имеющие отростков,
относящиеся к семействам Microviridae, Corticoviridae и Tectiviridae обычно устойчивы к процессу лиофилизации. Таким образом лактофаги, относящиеся к семействам Siphoviridae и Podoviridae являются устойчивыми к лиофилизации. Осмотическая устойчивость/чувствительность бактериофагов также влияет на устойчивость/чувствительность вирусов к действию повреждающих факторов лиофилизации [7].
Вирусы лактобактерий отличаются по индивидуальной чувствительности к замораживанию-высушиванию. Так, количество выживших частиц бактериофага L. lactis subsp. cremoris оказывается на порядок выше в сравнении с бактериофагом L. lactis subsp. diacetilactis. Однако в процессе длительного хранения бактериофаг L. lactis subsp. diacetilactis показывает лучшую выживаемость [8].
Присутствие защитной среды при лиофилизации лактофагов повышает жизнеспособность вирусов. Максимальная выживаемость вирусных частиц фага L. lactis subsp. cremoris после 1,5 лет хранения отмечена при использовании сложных защитных сред, таких как сахарозо-желатиновый агар и 14% обезжиренное молоко с добавкой 5% инозита. Максимальное количество вирулентных частиц вируса L. lactis subsp. diacetilactis после 1,5 лет хранения наблюдается при лиофилизации с защитной средой, состоящей из 14% обезжиренного молока с добавкой 5% инозита; но высокая выживаемость частиц этого вируса сохраняется также и при сублимационном высушивании с другими защитными средами [8]. Лучшим защитным действием для вирусов молочнокислых бактерий при лиофилизации обладают протекторы на основе желатина и молока. Кислородсодержащие гетероциклические соединения ряда кумаринов также оказывают положительное влияние на сохранение клеток микроорганизмов при лиофильном высушивании [9]. Применение защитных сред увеличивает количество жизнеспособных частиц бактериофагов не только в процессе лиофилизации, но и при дальнейшем хранении вирусов.
Выводы. Выживаемость бактериальных вирусов при консервации зависит от множества факторов. Существует необходимость проведения исследований, направленных на оптимизацию параметров методов криоконсервации и лиофилизации на каждом из этапов. Необходимость тщательного подбора параметров, защитных сред определяется следующими причинами: различием в выживаемости бактериофагов в зависимости от используемой защитной среды; различием степени устойчивости бактериофагов к лиофилизации в зависимости от морфологической структуры, типа, размера частиц, осмотической резистентности.
243

Литературные источники
1.Moineau, S. Phages of lactic acid bacteria: from genomics to industrial applications—dairy microbiologists seek new ways to protect milk-fermenting microorganisms against damaging phages / S. Moineau, D. Tremblay, S. Labrie // ASM News. – 2002. – V.68 – P. 388-393.
2.Королева, Н. С. Техническая микробиология цельномолочных продуктов / Н. С. Королева. – М.: Пищевая промышленность, 1975. – 271 с.
3.Clark, W. A. Comparison of Several Methods for Preserving Bacteriophages / W. A. Clark // Appl Microbiol. – 1962. – Vol.10, №5. – P. 466–471.
4.Ashwood-Smith, M.J. Preservation of microorganisms by freezing, freezedrying and desiccation. – In: Low temperature preservation in medicine and biology / M. J. AshwoodSmith, J. Farrant. // Pitman Press. London. – 1980. – P. 219–252.
5.Heckly, R. J. Preservation of microorganisms / R. J. Heckly // Adv. Appl. Microbiol. – V. 24. – Acad. Press. – №. 5. – 1978. – P. 1–53.
6.Рахуба, Д. В. Сохранение жизнеспособности бактериофагов молочнокислых стрептококков при хранении в замороженном состоянии / Д. В. Рахуба, А. Д. Гречиха, Г. И. Новик // Пищевая промышленность: наука и технологии. – 2011. – № 4(14). – С. 33-38.
7.Clark, W. A. Preservation of bacteriophages by freezing and freeze-drying / W. A. Clark, D. Geary // Cryobiology. – 1973. – Vol.10. – P. 351–360.
8.Фурик, Н. Н. Влияние состава защитных сред на выживаемость бактериофагов молочнокислых бактерий при лиофилизации / Н. Н. Фурик, Е. М. Кононович, А. Н. Картель // Пищевая промышленность: наука и технологии. – 2009. – №3(5). – С. 36-39.
9.Нечаева, О. В. Антифаговая и антиоксидантная активность замещенных кумаринов / О. В. Нечаева // Известия Саратовского университета. – 2007. Т. 7. Сер. Химия. Биология. Экология. Вып. 2. – С. 3–7.
Dmitrachkova O.V.1, Herasimovich A.D.2, Novik G.I.2
LONG PRESERVATION OF BACTERIOPHAGES OF LACTOCOCCUS LACTIS
1International Sakharov Environmental University, Minsk
2Institute of Microbiology, National Academy of Sciences, Minsk
Summary
The current review contains the analysis of available experimental data about long preservation of bacteriophages of Lactococcus lactis. The advantage of freeze-drying and freezing as a methods of preservation is shown. Considered the influence of freeze-drying and freezing on a viability of bacteriophages, particularly of bacteriophages of L. lactis. Found the need for research designed to optimization parameters of the preservation at each stage of this process.
244

УДК 796.91 + 575.1.2 + 796.01
Ильютик А.В.1, 2, Гайдукевич И.В.3, Гилеп И.Л.1
ИЗМЕНЕНИЕ ПОКАЗАТЕЛЕЙ УГЛЕВОДНОГО ОБМЕНА В КРОВИ КОНЬКОБЕЖЦЕВ С РАЗЛИЧНЫМИ ГЕНОТИПАМИ ГЕНА PPARG
1 Белорусский государственный университет физической культуры
2 НИИ физической культуры и спорта Республики Беларусь
3 Институт биоорганической химии НАН Республики Беларусь
Одним из актуальных направлений современной спортивной науки является генетика физической активности, в рамках которой изучаются гены, полиморфизмы которых ассоциированы с развитием и проявлением физических качеств человека, а также с двигательной активностью [1-2]. Одним из таких генов является ген PPARG, относящийся к генам семейства рецепторов, активируемых пролифераторами пероксисом. Ген PPARG участвует в регуляции углеводного и липидного обмена, в процессах контроля массы тела, роста костей и, следовательно, ассоциирован с развитием и проявлением физических качеств человека [3-4]. Наиболее изученным полиморфизмом гена PPARG является pro12ala полиморфизм.
Цель исследования заключалась в выявлении взаимосвязи pro/alaполиморфизма гена PPARG с биохимическими показателями углеводного обмена в крови конькобежцев при выполнении тестирующей нагрузки, а также изучение распределения аллельных вариантов гена PPARG у конькобежцев.
Материалы и методы исследования. Были исследованы образцы геномной ДНК 88 спортсменов национальной команды Республики Беларусь и спортивного резерва, специализирующихся в скоростном беге на коньках (мужчины, МСМК – 2 человека, МС – 26, КМС – 17, разрядики – 43), а также 64 человек (мужчины), не занимающихся профессионально спортом, которые составили контрольную группу. Определение полиморфизма гена PPARG осуществлялось методом полимеразной цепной реакции (ПЦР) в лаборатории молекулярной диагностики ИБОХ НАН Беларуси. В качестве тестирующей нагрузки применялся субмаксимальный велоэргометрический тест со ступенчатовозрастающей нагрузкой. Был обобщѐн материал, полученный при тестировании конькобежцев высокой квалификации при углубленных комплексных обследованиях в лаборатории биохимии спорта НИИ ФКиС РБ.
Результаты и их обсуждение. На основании анализа результатов ПЦР были определены полиморфные варианты гена PPARG у конькобежцев и у лиц контрольной группы. Частота встречаемости ala аллеля в контрольной группе составила 15,6% и была ниже, чем в группе конькобежцев – 19,9%. При этом частота встречаемости ala аллеля среди высококвалифицированных конькобежцев была 25,6%, что достоверно выше по сравнению с контрольной группой (P<0,05). Частота встречаемости pro/pro-генотипа в контрольной группе (70,3%) выше, чем в группе конькобежцев в целом (65,9%) и в группе высококвалифицированных конькобежцев (57,8%). Генотип ala/ala среди
245
людей, не занимающихся спортом профессионально, отмечен в 1,6% случаев. Среди конькобежцев данный генотип встречался чаще: в 2,3% случаев в группе разрядников (различия недостоверны) и в 8,9% случаев в группе высококвалифицированных спортсменов (различия достоверны по сравнению с контрольной группой, P<0,05).
Таким образом, у конькобежцев с ростом спортивного мастерства отмечена большая частота встречаемости ala аллеля и генотипа ala/ala по сравнению с контрольной группой (P<0,05).
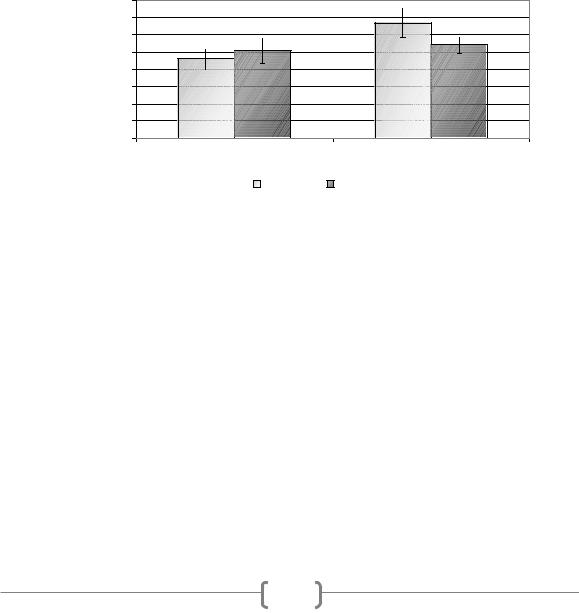
Основной функцией PPARG является регуляция обмена липидов и углеводов. Данный ген участвует в переключении метаболизма с углеводного на жировой [2]. Носительство ala аллеля приводит к понижению активности PPARG, что ассоциируется с подавлением липолиза и усилением утилизации глюкозы в скелетных мышцах. Для изучения особенностей углеводного метаболизма при выполнении физических нагрузок у конькобежцев с различными генотипами гена PPARG были определены среднегрупповые показатели концентрации глюкозы в покое и после выполнения нагрузки субмаксимальной мощности у спортсменов двух групп: носителей генотипа pro/pro (n=59) и носителей генотипа pro/ala (n=13) (рис. 1).
Глюкоза, ммоль/л
8 |
|
|
6,7 |
7 |
|
|
|
|
|
|
|
6 |
|
5,1 |
5,4 |
|
4,6 |
|
|
5 |
|
|
|
|
|
|
|
4 |
|
|
|
3 |
|
|
|
2 |
|
|
|
1 |
|
|
|
0 |
|
|
|
pro/pro (n=59) |
pro/ala (n=13) |
до нагрузки |
после нагрузки |
Рисунок 1. Концентрация глюкозы в крови конькобежцев до и после нагрузки в зависимости от полиморфизма гена PPARG
После выполнения физической нагрузки характер изменения содержания глюкозы в крови конькобежцев разных групп отличался. Так, в группе спортсменов с pro/pro-генотипом наблюдалось увеличение концентрации этого субстрата: с 4,6±0,62 до 5,1±0,73 ммоль/л (рис. 1). Использование критерия Уилкоксона (W) для парных наблюдений выявило, что данные различия являются статистически значимыми (P<0,05). У спортсменов второй группы (pro/ala), напротив, отмечено снижение концентрации глюкозы в крови: с 6,7±0,86 ммоль/л в покое до 5,4±0,5 ммоль/л после нагрузки (статистически значимые различия по критерию W (P<0,05)).
Увеличение концентрации глюкозы в крови конькобежцев первой группы в ответ на нагрузку указывает на мобилизацию гликогена печени и усиление метаболизма глюкозы по медленному аэробному пути через активацию окислительного декарбоксилирования пирувата. Мышцы носителей ala аллеля более чувствительны к инсулину [2, 4], а значит, более
246
эффективно перерабатывают глюкозу. Снижение концентрации глюкозы в крови носителей генотипа pro/ala свидетельствует о высокой скорости транспорта глюкозы через клеточные мембраны в работающие мышцы в ответ на усилившийся в них энергообмен. При этом поглощение глюкозы происходит по пути восстановления пирувата до молочной кислоты (анаэробный гликолиз).
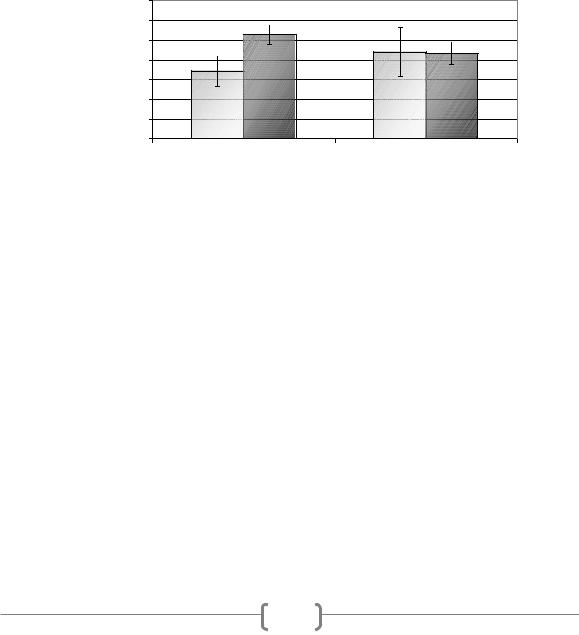
Таким образом, носители ala аллеля характеризуются большим анаэробным потенциалом и предрасположенностью к повышенной утилизации глюкозы по гликолитическому механизму. Это подтверждают и полученные значения максимального уровня лактата в крови при выполнении физических нагрузок (рис. 2). Высококвалифицированные конькобежцы были обследованы на разных этапах годичной подготовки: на этапе общей физической подготовки (ОФП), когда в тренировочном процессе применяются преимущественно средства аэробной направленности, и на этапе специальной физической подготовки (СФП), характеризующимся преобладанием тренировочных нагрузок специальной аэробной и анаэробной направленности.
Лактат макс, ммоль/л
14 |
|
|
|
12 |
10,6 |
|
|
10 |
|
8,8 |
8,7 |
8 |
6,9 |
|
|
6 |
|
|
|
4 |
|
|
|
2 |
|
|
|
0 |
|
|
|
|
этап СФП |
этап ОФП |
|

 pro/pro
pro/pro  pro/ala
pro/ala
Рисунок 2. Макс. накопление лактата в крови конькобежцев после выполнении нагрузки на разных этапах подготовки в зависимости от полиморфизма гена PPARG
Максимальная концентрация лактата в крови конькобежцев разных групп после выполнения велоэргометрической нагрузки на этапе ОФП не отличалась и составила 8,8±2,43 ммоль/л у носителей pro/pro-генотипа и 8,7±1,15 ммоль/л у носителей pro/ala-генотипа (рис. 2). Следовательно, на данном этапе подготовки у спортсменов обеих групп соотношение вклада аэробных и анаэробных механизмов энергообеспечения мышечной деятельности практически одинаково.
На этапе СФП, когда спортсмены совершенствуют специальные физические качества и выходят на высокий уровень их развития, отмечены достоверные различия в уровне максимального накопления лактата после выполнения физической нагрузки у спортсменов разных групп. Конькобежцыносители ala аллеля обладают большим анаэробным потенциалом. Об этом свидетельствовали достоверно более высокие значения концентрации молочной кислоты в крови после тестирования у конькобежцев с генотипом pro/ala (10,6±1,03 ммоль/л) по сравнению со спортсменами с pro/pro-
247

генотипом (6,9±1,54 ммоль/л) (P<0,05). Следовательно, ala аллель может давать его носителям преимущество в нагрузках анаэробного характера.
Выводы. С ростом спортивной квалификации конькобежцев повышалась частота встречаемости ala аллеля и ala/ala-генотипа гена PPARG. Аla аллель и ala/ala-генотип гена PPARG у высококвалифицированных конькобежцев-мужчин выявляли достоверно чаще, чем в контрольной группе.
Конькобежцы, носители ala аллеля, характеризуются большей склонностью к развитию скоростно-силовых двигательных качеств за счѐт повышенной утилизации глюкозы по гликолическому механизму энергообеспечения. Аla аллель гена PPARG является генетическим маркером, ассоциированным с высокой физической работоспособностью человека и предрасполагает к развитию скоростно-силовых качеств.
Литературные источники
1.Bouchard, C. The human gene map for performance and health-related fitness phenotypes: The 2006-2007 Update. / C. Bouchard [et al.] //Med. Sci. Sports and Exercise. – 2009. – Vol. 41. – P. 35-73.
2.Ахметов, И.И. Молекулярная генетика спорта: монография / И.И. Ахметов. – М.: Советский спорт, 2009. – 268 с.
3.Полиморфизм гена PPARG и двигательная деятельность человека / И.И. Ахметов [и др.] // Бюллетень экспериментальной биологии и медицины. – 2008. – Т. 146, N 11. –
С.567-569.
4.Pro12Ala substitution in PPARgamma2 associated with decreased receptor activity, lower body mass index and improved insulin sensitivity / S.S. Deeb [et al.] // Nat. Genet. – 1998.
–Vol. 20. – P. 277-284.
Ilyutsik A.V.1, Gaidukevich I.V.2, Gilep I.L.1, cand. of chem. sc.
CHANGE OF PARAMETERS OF CARBOHYDRATE METABOLISM IN BLOOD OF SPEED SKATERS WITH VARIOUS GENOTYPES OF A PPARG GENE
1 Belarusian State University of Physical Culture, Minsk
2 Institute of Bioorganic Chemistry, National Academy of Sciences, Minsk
Summary
A PPARG gene participates in regulation of a carbohydrate and lipids exchange, power supply of muscular activity. The article contains the information on the peculiarities of carbohydrate metabolism during performance of physical loadings by skaters with various genotypes of a PPARG gene. Skaters with ala allele possess high anaerobic potential at the expense of glycolysis resynthesis of АTP. Muscles of athletes with ala allele process glucose during performance of physical loading effectively. An ala allele PPARG gene is a genetic marker of high work capacity of a person.
248

УДК 579.2+579.6
А.В. Кантерова, Г.И. Новик
ВЫЖИВАЕМОСТЬ ДРОЖЖЕЙ РОДА SACCHAROMYCES ПОСЛЕ ДЛИТЕЛЬНОГО ХРАНЕНИЯ РАЗЛИЧНЫМИ СПОСОБАМИ
Институт микробиологии НАН Беларуси, Минск, Беларусь
Основной задачей коллекций микроорганизмов является сохранение культур в жизнеспособном состоянии с присущими им диагностическими и хозяйственно-ценными свойствами, для чего необходима разработка и применение эффективных методов их длительного хранения.
Дрожжевые грибы в Белорусской коллекции непатогенных микроорганизмов (БКМ) представлены 64-мя видами, относящимися к 32-м родам, 28 штаммов относится к роду Saccharomyces. В спиртовом и винном производстве используют особые расы дрожжей этого рода, которые способны переносить высокое осмотическое давление из-за больших концентраций в среде сахаров и минеральных солей. Такие культуры (7 штаммов) хранятся в БКМ с использованием методов субкультивирования, лиофилизации и криоконсервации [1]. В настоящее работе представлены результаты определения выживаемости и характеристика культуральноморфологических особенностей дрожжей после 2 лет хранения в лиофилизированном состоянии и при -70ºС.
Лиофилизацию культур производили на сублимационной установке «MODULYO-4K» английской фирмы Edwards. Первичная сушка проходила при температуре -55оС и глубине вакуума 8·10-2 mbar в течение 4-х часов; досушивание на гребенке аппарата вторичной сушки при комнатной температуре под вакуумом 8·10-2 mbar – 18 часов. В качестве протекторной среды использовалась сахарозо-желатиновая среда (10% раствор сахарозы с 1,5% желатины и 0,1% агар-агара).
Криоконсервации подвергались культуры, находящиеся в стационарной фазе роста (72 часа). Протекторной средой служил глицерол (10 % об). Первоначально замораживание проводили при -20ºС, затем криопробирки с образцами культуры помещали на хранение при -70ºС [2].
Количество живых клеток дрожжей определялось методом предельных разведений перед лиофилизацией и криоконсервацией, через 1 сутки после закладки на хранение, и через 2 года хранения культур, таблица.
Таблица - Выживаемость ( КОЕ/мл ) дрожжей Saccharomyces cerevisiae после консервации
Штамм |
Способы длительной |
Исходная |
Через |
Через |
дрожжей |
консервации |
культура |
1 сутки после |
2 года хранения |
БИМ |
|
|
консервации |
|
Y- 177 |
Лиофилизация |
8,0×108 |
5,2×108 |
2,8×108 |
|
Криоконсервация |
|
6,4×109 |
5,5×108 |
Y- 178 |
Лиофилизация |
6,0×108 |
4,3×108 |
2,0×107 |
|
Криоконсервация |
|
5,7×108 |
4,5×108 |
Y-179 |
Лиофилизация |
2,5×108 |
9,6×107 |
8,0×107 |
249

|
Криоконсервация |
|
1,0×108 |
9,5×107 |
Y-180 |
Лиофилизация |
3,0×109 |
9,1×108 |
7,2×108 |
|
Криоконсервация |
|
2,3×109 |
1,0×109 |
Y-182 |
Лиофилизация |
7,0×108 |
2,5×108 |
1,0×108 |
|
Криоконсервация |
|
6,8×108 |
5,9×108 |
Y-221 |
Лиофилизация |
4,5×108 |
1,5×108 |
0,5×108 |
|
Криоконсервация |
|
3,2×108 |
2,5×108 |
Y-717 |
Лиофилизация |
5,0×108 |
2,6×108 |
9,4×107 |
|
Криоконсервация |
|
2,2×108 |
1,8×108 |
Культурально-морфологические особенности лиофилизированных и криоконсервированных штаммов после хранения в течение 2-х лет практически не отличались от контрольных (штаммов, хранившихся методом субкультивирования). Клетки дрожжей имели, в основном, овальную форму, располагались одиночно или в парах, наблюдалось активное почкование, размер клеток варьировал от 6х10 до 7х12 мкм. Колонии дрожжей имели диаметр 5-6 мм, круглую форму с ровными краями, светло-палевый цвет, блестящую поверхность, мажущуюся консистенцию.
Показатели выживаемости дрожжей после 2-х лет хранения при -70ºС и лиофилизированных культур достаточно высоки, в связи с чем эти методы можно рекомендовать для длительного сохранения жизнеспособности сахаромицетов.
Литературные источники
1.Kirsop B. Freeze-drying and cryopreservation of yeast cultures / B. Kirsop // Commonwealth Mycological Institute Publication. Kew, Surrey, U.K. 1983
2.Кантерова А.В. Жизнеспособность дрожжей рода Saccharomyces после криоконсервации / А.В. Кантерова, Г.И. Новик // «Актуальные аспекты современной микробиологии».V Молодежная школа-конференция с международным участием (Москва,
26 — 27 октября 2009 г.). С. 29-30.
Kanterova A.V., Novik G.I.
SURVIVAL RATE OF SACCHAROMYCES YEAST AFTER LONG-TERM MAINTENANCE BY DIFFERENT METHODS
Institute of Microbiology, Belarus National Academy of Sciences
Summary
Survival of yeast maintained by freeze-drying and cryopreservation methods is at high level. The methods may be recommended for long-term storage of saccaromycetes.
250
