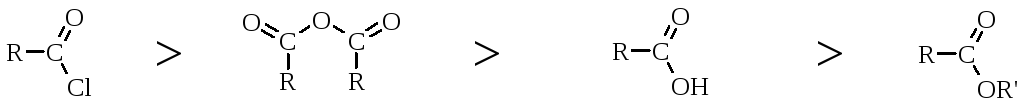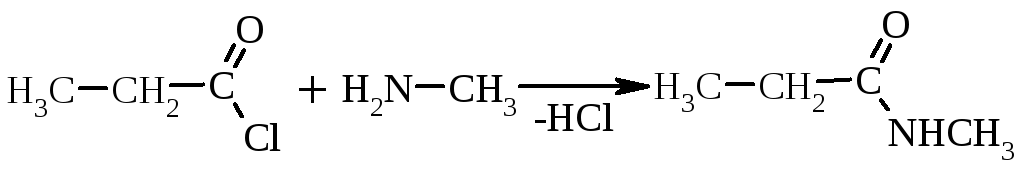5.5. Реакції за участю вуглеводневих радикалів.
5.5.1. В аліфатичних карбонових кислотах при галогенуванні іде заміщення атома гідрогена, що знаходиться в -положенні відносно карбоксильної групи:
|
|
-бромпропіонова кислота |
у випадку радикального галогенування отримують суміш ,,-похідних:
|
| |||
|
|
-хлормасляна кислота |
-хлормасляна кислота |
-хлормасляна кислота |
5.5.2. В ароматичних карбонових кислотах карбоксильна група є потужним електроноакцепторним замісником, що орієнтує вступаючий електрофіл у м-положення ароматичного ядра в реакціях електрофільного заміщення (галогенування, нітрування, сульфування і т.д.):
|
|
м-нітробензойна кислота |
|
м-сульфобензойна кислота |
5.6. Функціональні похідні карбонових кислот.
При перетворенні карбоксильної групи отримують функціональні похідні загальної формули:
|
|
, де Х=Hal (Cl, Br), NH2, NHR тощо. |
Реакційна здатність наведених похідних карбонових кислот визначається +М; -І-ефектами замісника Х: чим менше група подає електронної густини на карбонільну групу, тим більш реакційноздатними є функціональні похідні і тим швидше йде, наприклад, гідроліз з утворенням карбонових кислот.
5.6.1. Галогенангідриди карбонових кислот отримують за схемою:
|
|
хлорангідрид карбонової кислоти |
Назви деяких найбільш поширених радикалів галогенангідридів наведено нижче:
|
|
|
|
|
ацил- |
ацетил- |
бензоїл- |
Галогенангідриди – дуже реакційноздатні сполуки, особливо в реакціях ацилювання (А-Е):
|
|
кислоти |
|
наведені класи реакційних сполук підтверджують високу реакційну здатність хлорангідридів карбонових кислот |
|
аміди кислот | |||
|
естери | |||
|
ангідриди кислот | |||
|
пероксиди кислот |
Як правило, це реакції нуклеофільного заміщення атому галогену, що протікає за механізмом приєднання-відщеплення (А-Е):
|
|
|
І стадія: повільна, лімітуюча |
|
|
|
ІІ стадія: швидка |
По активності ацилюючі реагенти можна розмістити у наступний ряд:
|
| |||
|
галогенангідриди |
ангідриди |
кислоти |
естери |
5.6.2. Ангідриди карбонових кислот можуть бути отримані дегідратацією кислот при дії водопоглинаючих агентів P2O5, або (CF3CO)2O:
|
|
ангідрид оцтової кислоти (оцтовий ангідрид) |
або взаємодією хлорангідридів кислот і солей карбонових кислот:
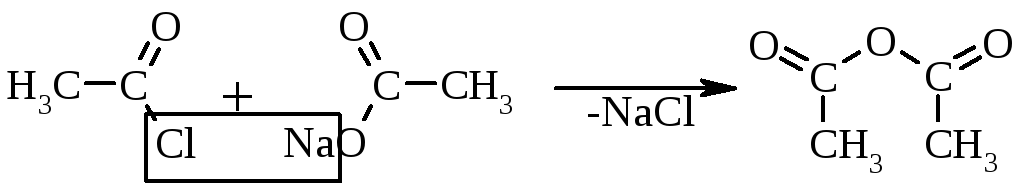
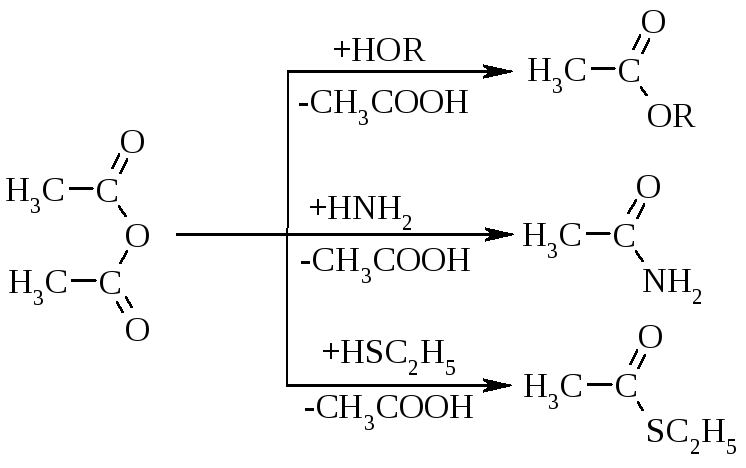
Ангідриди кислот, за рахунок сильної поляризації зв’язку С–О, є також сильними ацилюючими агентами:
|
|
утворення естерів карбонових кислот реакцією О-ацилювання | |
|
утворення амідів карбонових кислот реакцією N-ацилювання | ||
|
утворення естерів тіолкарбонових кислот реакцією S-ацилювання | ||
|
|
етиловий естер тіолоцтової кислоти |
|
5.6.3. Аміди карбонових кислототримують дією ацилюючих агентів на аміак, або його похідні:
|
| ||
|
|
амід оцтової кислоти |
|
|
| ||
|
|
метиламід пропіонової кислоти |
|
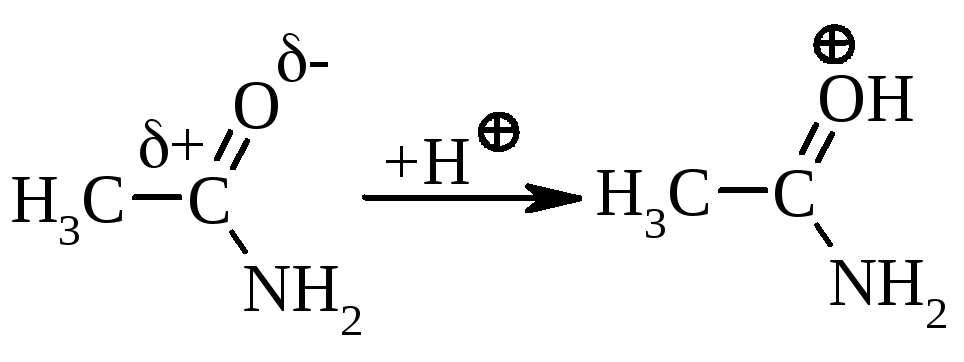
Так як вільна електронна пара атома нітрогена приймає участь у супряженні (+М-ефект), то аміди, на відміну від амінів, майже не мають основних властивостей. Лише в сильнокислому середовищі вони здатні протонуватись, переважно, по атому оксигену карбамідної групи:
При дії води в кислих та лужних середовищах аміди гідролізуються до кислот та амінів: