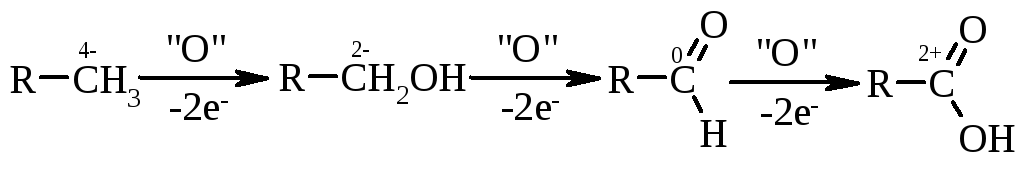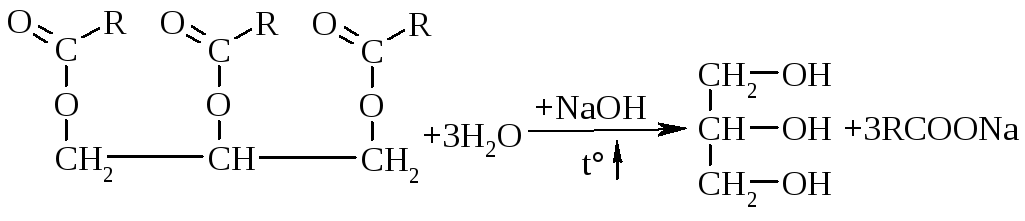17. Монокарбонові кислоти
Монокарбоновими кислотами називають похідні вуглеводнів, до складу яких входить одна карбоксильна група (–СООН).
1. Класифікація. Номенклатура.
Загальна формула
карбонових кислот 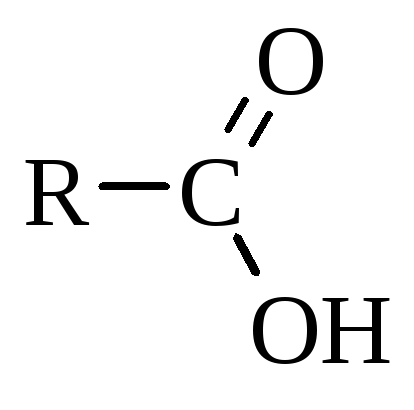 .
В залежності від природи та будови
радикалу R
вони бувають: насичені (аліфатичні),
ненасичені, ароматичні і т.д. Слід
відмітити, що карбонові кислоти можуть
утворювати свої гомологічні ряди. Так,
аліфатичні або кислоти жирного ряду
мають загальну формулу CnH2n+1COOH.
Назви деяких монокарбонових кислот та
їх фізичні константи наведено у табл.
17.1.
.
В залежності від природи та будови
радикалу R
вони бувають: насичені (аліфатичні),
ненасичені, ароматичні і т.д. Слід
відмітити, що карбонові кислоти можуть
утворювати свої гомологічні ряди. Так,
аліфатичні або кислоти жирного ряду
мають загальну формулу CnH2n+1COOH.
Назви деяких монокарбонових кислот та
їх фізичні константи наведено у табл.
17.1.
Таблиця 17.1
Назви і фізичні константи деяких карбонових кислот.
|
Формула |
Номенклатура |
Тпл., С |
| |
|
тривіальна |
IUPAC | |||
|
|
мурашина |
метанова |
101 |
3,75 |
|
|
оцтова |
етанова |
118 |
4,76 |
|
|
пропіонова |
пропанова |
141 |
4,89 |
|
|
масляна |
бутанова |
165 |
4,82 |
|
|
ізомасляна |
2-метилпропанова |
154 |
4,84 |
|
|
валеріанова |
пентанова |
187 |
4,86 |
|
|
капронова |
гексанова |
205 |
|
|
|
акрілова |
пропенова |
142 |
4,26 |
|
|
олеїнова |
9-октадекенова |
– |
|
|
|
пальметінова |
гексадеканова |
– |
|
|
|
стеаринова |
октадеканова |
– |
|
|
|
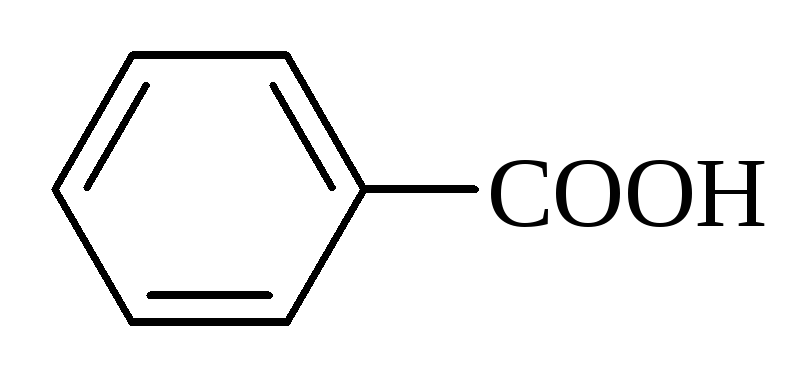
бензойна |
бензолкарбонова |
249 |
4,17 |
|
|
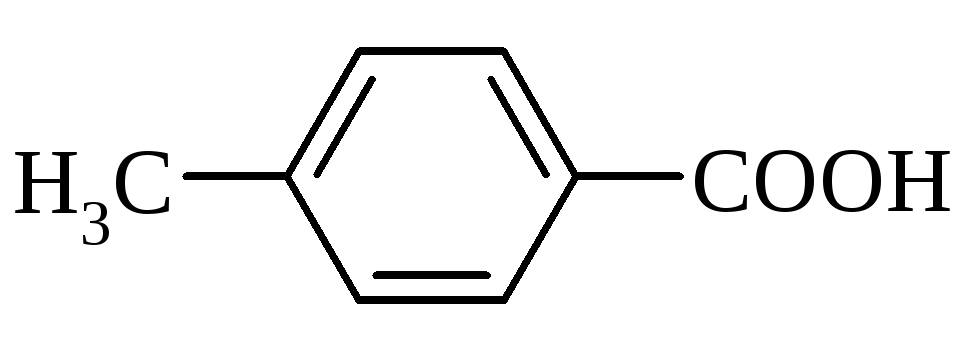
п-толуїлова |
4-метилбензолкарбонова |
– |
|
|
|
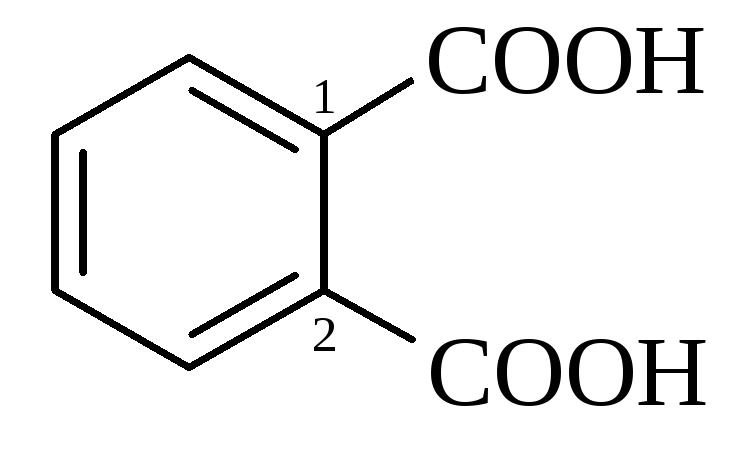
фталева |
1,2-бензолдикарбонова |
207 |
2,95,(5,40) |
|
|
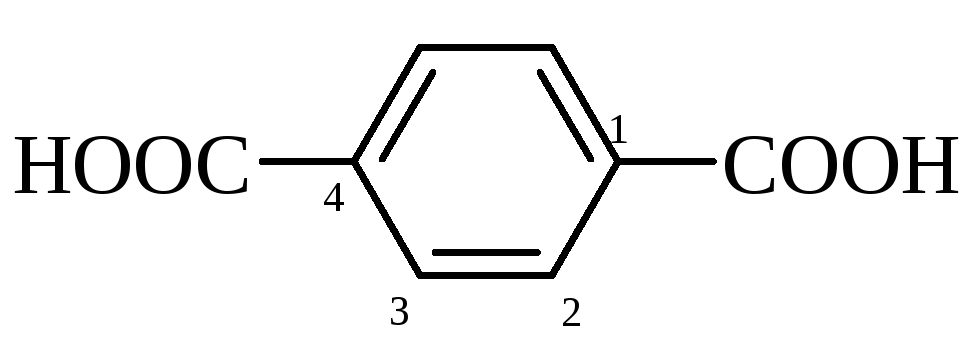
терефталева |
1,4-бензолдикарбонова |
300 (субл.) |
3,54, (4,50) |
До сих пір дуже поширені тривіальні назви деяких карбонових кислот, які наведені у табл. 16.1.
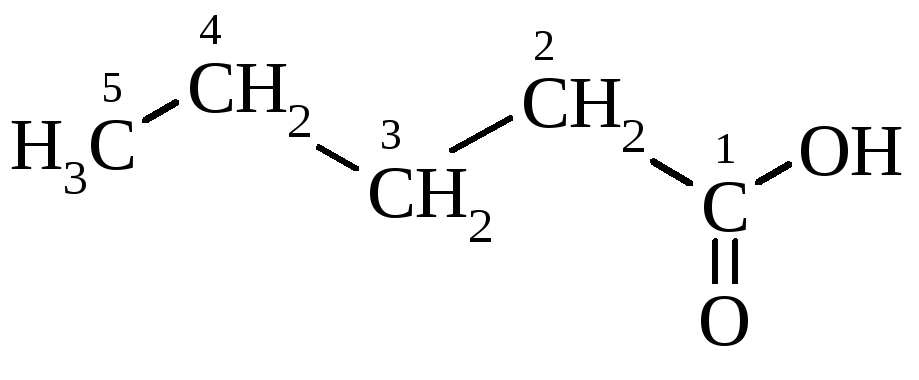
Назва за номенклатурою IUPAC: вуглеводень, включаючи і атом карбону карбоксильної групи + суфікс -ова + кислота:
|
|
пентанова кислота |
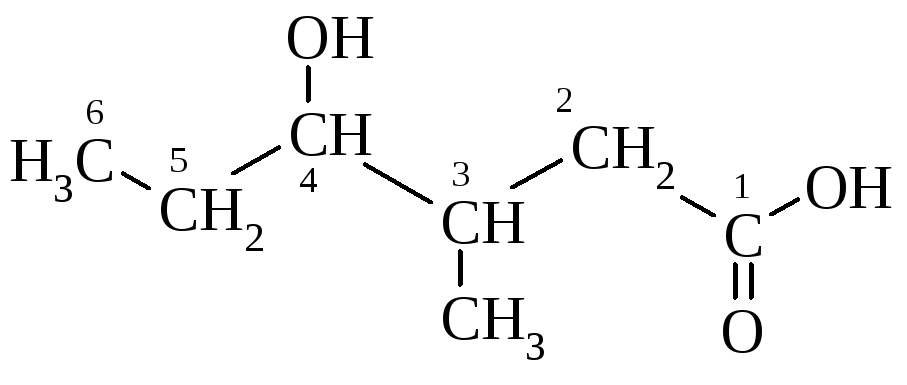
якщо вуглецевий скелет розгалужений, то спочатку називають радикали, указуючи їх місце в головному ланцюзі, а потім саму кислоту:
|
|
3-метил-4-гідроксигексанова кислота |
2. Методи отримання.
2.1. Окиснення насичених вуглеводнів або спиртів та альдегідів. Хімічні перетворення цього ряду можна навести наступною схемою:
|
| |||
|
парафін |
спирт |
альдегід |
кислота |
Якщо ввести термін „умовного ступеню окиснення” атома карбону кінцевої метильної групи, то легко бачити, що кожне наступне перетворення пов’язане з втратою двох електронів атома карбону наведеного ряду відновників. В якості окисників використовують K2Cr2O7,KMnO4в кислому середовищі. Окиснення парафінів проводять киснем повітря в досить жорстких умовах: t=180-200 С; каталізатор – солі Mn2+,Co2+. Це – промисловий метод отримання синтетичних жирних кислот (СЖК) із довжиною вуглеводневого ланцюга С12-С20, які використовують у виробництві синтетичних миючих засобів. При окисненні спиртів до альдегідів використовують такі ж окисники і каталізатори, але при більш високих температурах 300-350 С. Так, оцтову кислоту отримують у промисловості по реакції:

Необхідно відмітити, що стадія окиснення спирту проходить одночасно із дегідруванням.
Алкіларени окиснюються за атомом карбону, що знаходиться у -положенні відносно бензольного ядра, з утворенням ароматичних карбонових кислот:
|
|
бензойна кислота | |
|
толуол |
| |
2.2. Гідроліз нітрилів жирного та ароматичного ряду проходить за схемою (R=Alk):
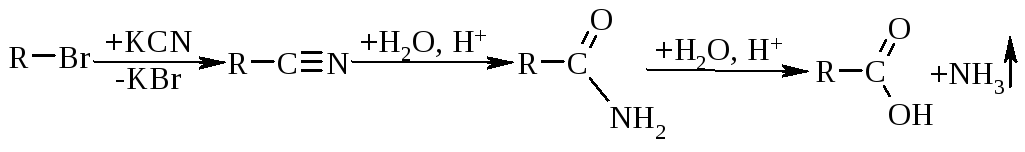
Особливість методу:реакція іде з подовженням вуглеводневого ланцюга.
У випадку нітрилів ароматичного ряду останні отримують через діазосполуки:

2.3. Взаємодією магнійорганічних сполук із оксидом карбону(IV) отримують солі карбонових кислот, при підкисленні яких виділяють відповідні кислоти:
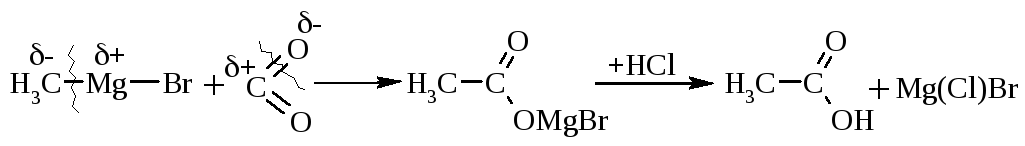
Наведені приклади (2.1-2.3) є найбільш загальними та універсальними для отримання карбонових кислот, але є ще ряд специфічних, важливих методів отримання. Деякі з них наведені нижче.
2.4. Карбонілювання спиртів (оксосинтез)є промисловим методом отримання оцтової кислоти:
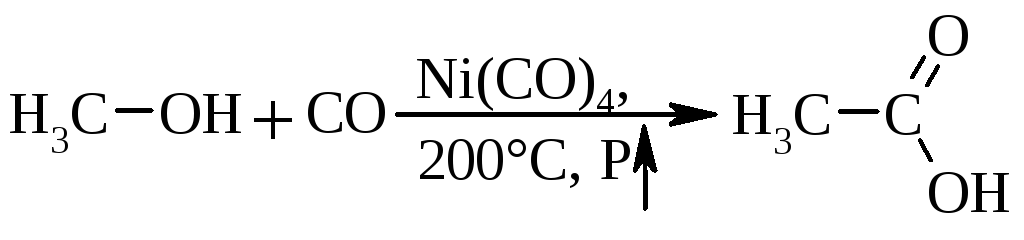
або мурашиної кислоти за схемою:

2.5. Лужний гідроліз гліцеридів насичених та ненасичених карбонових кислотможна навести наступним чином:
|
|
R–кислотний залишок, як правило, пальмітинової – С15Н31СООН, стеаринової – С17Н35СООН або олеїнової – С17Н33СООН кислот. | |||
|
гліцерид кислоти |
|
гліцерин |
мило | |