- •13. Спирти. Феноли
- •1. Класифікація. Номенклатура.
- •2. Методи отримання.
- •2.2. Лабораторні методи.
- •3. Будова спиртів та фенолів.
- •4. Фізичні властивості.
- •5. Хімічні властивості.
- •5.1. Реакції, що йдуть за участю атома гідрогена гідроксильної групи.
- •По механізму – це бімолекулярна реакція приєднання (а2), яка має ряд особливостей:
- •5.2. Реакції, що ідуть із заміщенням або відщепленням всієї гідроксильної групи.
- •5.4. Хімічні властивості фенолів.
- •6. Екологічні питання.
5.2. Реакції, що ідуть із заміщенням або відщепленням всієї гідроксильної групи.
5.2.1. Нуклеофільне заміщення гідроксила на галогенпроходить при дії галогенідів фосфору та сірки, а також галогеноводнів H-Hal (HI>HBr>HCl) за схемою:

З кислотами НІ (50% мас.), HBr (50%
мас.) та H2SO4
(96% мас.) реакція проходить досить легко,
з кислотою HCl значно важче в присутності
каталітичних кількостей ZnCl2.
З первинними спиртами реакція проходить
за механізмом
![]() ,
а з третинними –
,
а з третинними –![]() .
Вторинні спирти реагують як за
.
Вторинні спирти реагують як за![]() ,
так і за
,
так і за![]() механізмами.
механізмами.
Первинні спирти (![]() -механізм):
-механізм):

Третинні спирти (![]() -механізм):
-механізм):

Особливості реакції:
в ряду
 основні властивості спиртів збільшуються,
тому є закономірним зростання швидкості
реакції у тій же послідовності (з
урахуванням протонування спиртів на
першій стадії);
основні властивості спиртів збільшуються,
тому є закономірним зростання швидкості
реакції у тій же послідовності (з
урахуванням протонування спиртів на
першій стадії);для спиртів, у порівнянні із галогеналканами, більш характерним є механізм
 ,
тому, що протонований нейтральний
гідроксил (Н2О) відщеплюється
значно легше, ніж заряджений галогенід-аніон
(Hal–):
,
тому, що протонований нейтральний
гідроксил (Н2О) відщеплюється
значно легше, ніж заряджений галогенід-аніон
(Hal–):

5.2.2. Дегідратація спиртів.
Розрізняють міжмолекулярну та внутрішньомолекулярну дегідратацію спиртів:

Як каталізатор окрім H2SO4! використовують б/в H3PO4, Al2O3 або AlPO4.
Особливості реакції:
для третинних спиртів
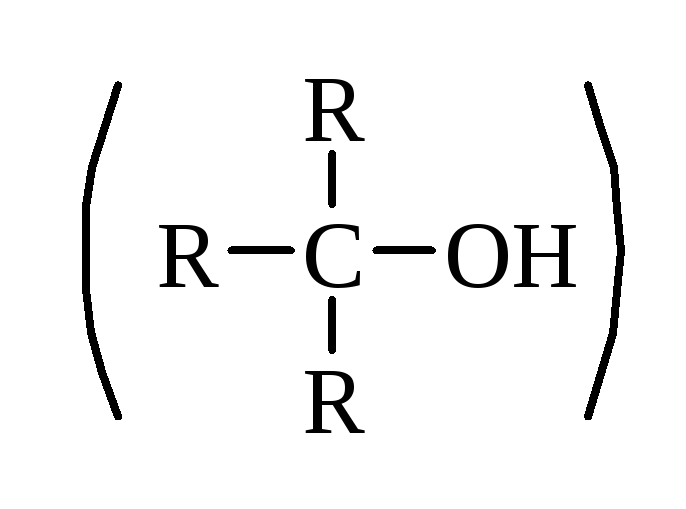 найбільш характерною є реакціявнутрішньомолекулярної дегідратації
– Е1;
найбільш характерною є реакціявнутрішньомолекулярної дегідратації
– Е1;для первинних спиртів (R–CH2OH) – реакціяміжмолекулярної дегідратації– SN; у випадку первинних спиртів за
 механізмом, третинних –
механізмом, третинних – ;
вторинних, як
;
вторинних, як ,
так і
,
так і ;
;при використанні неорганічних кислот на першій стадії утворюються відповідні проміжні естери неорганічних кислот:
![]()
та в залежності від умов реакції кінцеві продукти:

у випадку спиртів розгалуженої структури відщеплення гідрогену в реакціях внутрішньомолекулярної дегідратаціїпроходить заправилом Зайцева:

5.3. Окиснення спиртів проводять, як правило, сильними окисниками: (K2Cr2O7+H2SO4), CrO3, (KMnO4+H2SO4), киснем повітря (у промисловості). При цьому окиснюється атом карбону, який безпосередньо пов’язаний із гідроксильною групою, тому в залежності від того, який спирт окиснюється – первинний, вторинний або третинний, утворюються різні продукти реакції.
Первинні спиртиокиснюються до малостійких альдегідів, які далі легко окиснюються до відповідних карбонових кислот:

Вторинні спиртиокиснюються до кетонів:
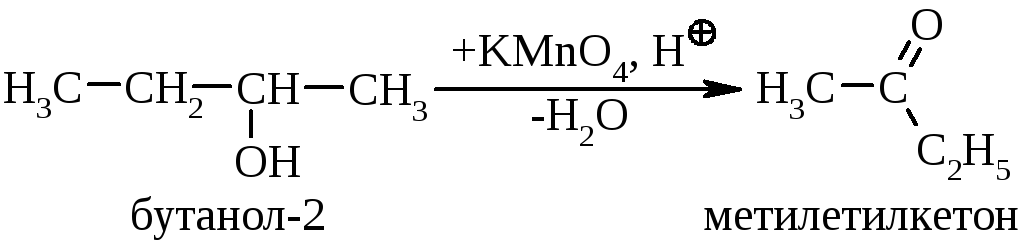
Третинні спиртиокиснюються в жорстких умовах спочатку з утворенням алкенів, а потім з розривом подвійного зв’язку до кетонів та карбонових кислот з меншим, ніж у молекулі вихідного спирта, числом атомів карбону:

Каталітичним дегідруванням спиртіву промисловості отримують альдегіди та кетони за схемою:

5.4. Хімічні властивості фенолів.
Хімічні реакції фенолу можна розділити на дві групи:
реакції, що йдуть за участю групи ОН;
реакції, що йдуть за участю ароматичного ядра.
5.4.1. Реакції за участю гідроксильної групи.
Спряження неподільної пари електронів атома оксигена гідроксильної групи з 6-електронною хмарою бензольного ядра приводить до сильної поляризації зв’язку О-Н. При цьому атом гідрогену гідроксильної групи стає рухливим та досить легко заміщується на інші атоми або атомні групи, проявляючи кислотні властивості. З іншого боку, наявність +М-ефекта гідроксильної групи приводить до скорочення зв’язку С–ОН, що робить практично неможливим реакції заміщення гідроксила.
5.4.1.1. Фенол дисоціює як кислотаз утворенням стабільного фенолят-аніона:

Порівняння константи дисоціації фенола та аліфатичних спиртів (10-16–10-18) показує, що фенол являється значно сильнішою кислотою. Тому для нього є характерною класична реакція нейтралізації:

Вплив замісників в бензольному ядрі на кислотні властивості фенолу має таку ж закономірність (І-ефект), що і для аліфатичних спиртів (табл. 13.4):
Таблиця 13.4
Константи дисоціації деяких заміщених фенолів.
|
Сполука |
|
|
|
|
Ка |
6,710-11 |
6,910-8 |
410-1 |
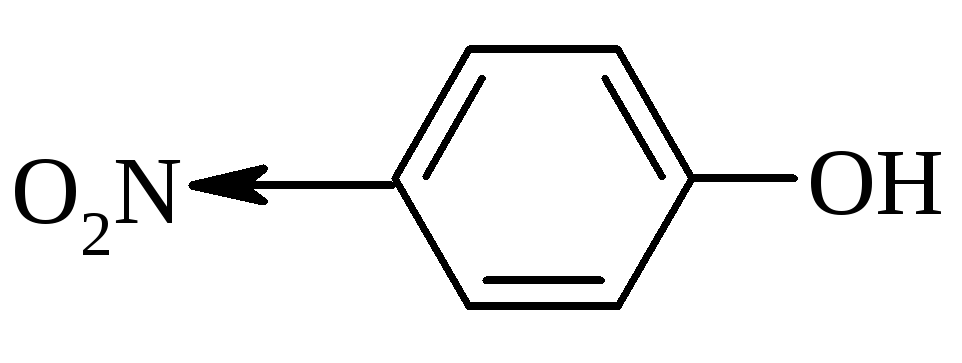
5.4.1.2. Нуклеофільне заміщенняє не характерним для фенолів, на відміну від аліфатичних спиртів:

Воно стає можливим лише при активуванні бензольного ядра відносно нуклеофіла (введення електроноакцепторних замісників, наприклад, NO2):
5.4.1.3. Утворення етерів та естерів фенолупроходить значно важче, у порівнянні з аліфатичними спиртами. У звичайних умовах не йдуть хімічні реакції з кислотами та фенолами. Для проходження таких реакцій необхідно активувати реакційні центри вихідних сполук, переводячи їх в сполуки із іонним або більш полярним зв’язком:

Безпосередньо із фенолу естери можна отримати реакцією О-ацилювання дуже реакційноздатним ангідридом карбонових кислот:

5.4.2. Реакції, що ідуть за участю ароматичного ядра.
Гідроксильна група є електронодонорним замісником (+М-ефект) відносно ароматичного ядра і у випадку реакцій електрофільного заміщення (SE) збільшує швидкість реакції та спрямовує реагент переважно в орто- та пара-положення.
5.4.2.1. Галогенування. Фенол швидко реагує з водним розчином брому, утворюючи суміш моно-, ди-, трибромфенолів:

ще легше проходить хлорування фенолу.
5.4.2.2. Нітрування. Фенол взаємодіє з розведеною нітратною кислотою при кімнатній температурі, утворюючі суміш о- та п-нітрофенолів:

Пряме нітрування фенолу за допомогою концентрованої нітратної кислоти утруднюється окисненням.
5.4.2.3. Сульфування. Фенол легко сульфується концентрованою сульфатною кислотою. Напрямок реакції залежить від температури:
|
|
При нагріванні о-гідроксибензолсульфокислота ізомеризується в п-гідроксибензолсульфокислоту | |||
|
при -80°С |
10% |
90% |
| |
|
при 100°С |
90% |
10% |
| |
5.4.2.4. Реакція з диоксидом карбону (Кольбе-Шмідта).У цій реакції з диоксидом карбону реагує не сам фенол, а більш активний фенолят натрію:

5.4.2.5. Конденсація з альдегідами та кетонами.Конденсація фенола з формальдегідом у кислому середовищі лежить в основі добування фенолформальдегідних смол. Причому при надлишку фенолу утворюються новолачні смоли:

а при надлишку формальдегіду утворюються резольні смоли:

При конденсації фенола з ацетоном утворюється бісфенол А, який широко використовується для синтезу поліконденсованих полімерів, наприклад, полікарбонату, епоксидних смол: