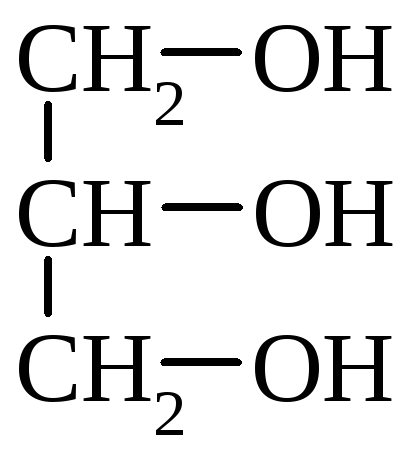
- •13. Спирти. Феноли
- •1. Класифікація. Номенклатура.
- •2. Методи отримання.
- •2.2. Лабораторні методи.
- •3. Будова спиртів та фенолів.
- •4. Фізичні властивості.
- •5. Хімічні властивості.
- •5.1. Реакції, що йдуть за участю атома гідрогена гідроксильної групи.
- •По механізму – це бімолекулярна реакція приєднання (а2), яка має ряд особливостей:
- •5.2. Реакції, що ідуть із заміщенням або відщепленням всієї гідроксильної групи.
- •5.4. Хімічні властивості фенолів.
- •6. Екологічні питання.
2.2. Лабораторні методи.
2.2.1. Гідратацією алкенів отримують первинні, вторинні та третинні спирти:

Роль кислотного каталізатора полягає в поляризації подвійного зв’язку олефіна, що потім полегшує атаку нуклеофільного реагента:
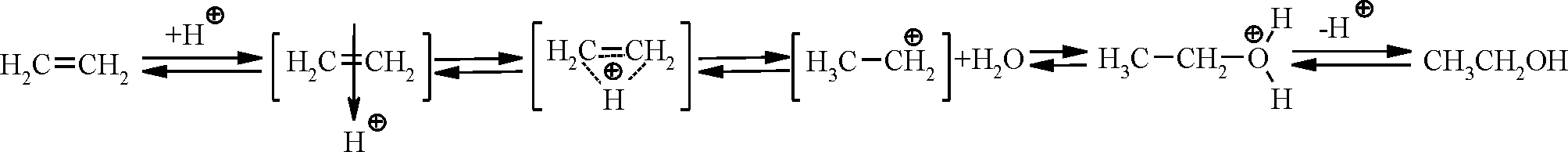
2.2.2. Гідроліз галогеналканівводою йде дуже повільно. Реакція прискорюється при заміні води на розчин гідроксида лужного метала:

Наявність надлишку лугу прискорює процес та нейтралізує кислоту, що робить реакцію не зворотною.
2.2.3. Відновлення альдегідів та кетонів.Каталітичне гідрування можна проводити в різних умовах, отримуючи первинні або вторинні спирти:

2.2.4. Реакцією Гриньяра з альдегідами та кетонами отримують спирти різної будови:

Всі інші альдегіди (окрім формальдегіда) утворюють вторинні спирти:

Кетони та похідні карбонових кислот утворюють третинні спирти:

3. Будова спиртів та фенолів.
|
|
Зв’язок |
Енергія, Е, кДж/моль |
Довжина, l, нм |
Полярність, , D |
Поляризованість, RD, см3 |
|
С–О |
356 |
0,144 |
0,9 |
1,54 | |
|
О–Н |
486 |
0,096 |
1,51 |
1,66 |
Завдяки високій полярності
зв’язків С–О та О–Н, а також наявності
неподіленої електронної пари атома
оксигену спирти дуже реакційноздатні
сполуки. Феноли відрізняються від
аліфатичних спиртів деякими суттєвими
особливостями. Зменшення довжини зв’язку
С–О у фенолах (0,136 нм) у порівнянні із
спиртами (0,144 нм) пов’язано з різницею
у ковалентних радіусах
![]() та
та![]() орбіталей,
що призводить до підвищення міцності
цього зв’язку у фенолах. Частково це
може бути пов’язане із супряженням
–ОН-группи із бензольним кільцем, що
можна навести граничними структурами:
орбіталей,
що призводить до підвищення міцності
цього зв’язку у фенолах. Частково це
може бути пов’язане із супряженням
–ОН-группи із бензольним кільцем, що
можна навести граничними структурами:

Це призводить до того, що зв’язок С–О стає більш міцним і менш полярним, а зв’язок О‑Н – більш полярним і менш міцним у порівнянні із аліфатичними спиртами. Внаслідок цього у фенолів кислотні властивості стають суттєво більш вираженими, ніж у насичених спиртів.
4. Фізичні властивості.
Спирти за фізичними властивостями значно відрізняються від раніше розглянутих вуглеводнів та галогенопохідних сполук з близькою молекулярною масою. Вони мають значно вищі температури плавлення та кипіння, краще розчинні у воді, але із збільшенням молекулярної маси така відмінність зменшується (табл. 13.2). Така різниця у фізичних властивостях пов’язана із високою полярністю гідроксильної групи та утворенням асоціацій молекул спирта за рахунок водневого зв’язку:
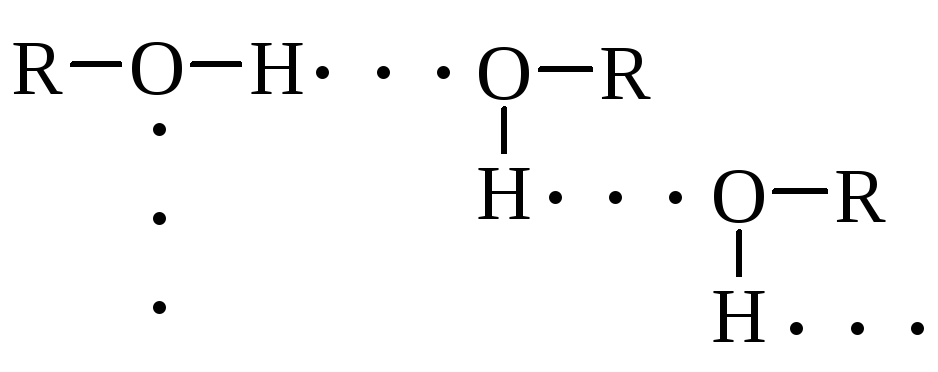
Таблиця 13.2
Фізичні властивості деяких спиртів та фенолів.
|
Формула |
Назва |
Ткип., С |
Густина,
|
Розчинність у воді, % при 20°С |
|
|
метанол |
65 |
0,7924 |
|
|
|
етанол |
78 |
0,7891 |
|
|
|
пропанол-1 |
97 |
0,8044 |
|
|
|
пропанол-2 |
82 |
0,7849 |
|
|
|
бутанол-1 |
118 |
0,8096 |
7,8 |
|
|
бутанол-2 |
100 |
0,8078 |
7,8 |
|
|
2-метилпропанол-2 |
83 |
0,7882 |
9,5 |
|
|
етиленгліколь |
197 |
1,1152 |
|
|
|
глицерин |
290 |
– |
|
|
|
фенол |
182 |
– |
8,2 |
|
|
о-крезол |
192 |
– |
– |
|
м-крезол |
203 |
– |
– | |
|
п-крезол |
202 |
– |
– | |
|
|
пірокатехін |
245 |
– |
6,0 |
|
|
пірогалол |
розкладаються |
– |
– |