- •Комплексные соединения. Физическая химия поверхностных явлений
- •Глава 1. Комплексные соединения
- •1.1. Основные положения координационной теории
- •1.2. Природа химической связи в комплексном ионе
- •1.2.1. Электростатическая теория
- •1.2.2. Метод валентных связей
- •1.2.3. Метод молекулярных орбиталей
- •1.3. Пространственное строение и изомерия комплексных соединений
- •1.4. Классификация комплексных соединений
- •1.5. Номенклатура комплексных молекул
- •1.6. Диссоциация в растворах
- •1 Ступень
- •2 Ступень
- •1.7. Реакции комплексообразования
- •1.8. Хелатирование. Его роль в биологии и медицине
- •Полидентатные лиганды
- •1.9. Хелатотерапия
- •Глава 2. Физическая химия поверхностных явлений
- •2.1. Адсорбция
- •2.1.1. Поверхностная энергия и поверхностное натяжение
- •2.1.2. Поверхностная активность. Поверхностно-активные, поверхностно-неактивные и поверхностно-инактивные вещества
- •2.1.3. Адсорбция на границе раздела жидкость-газ. Уравнение Гиббса
- •2.1.4. Ориентация молекул в поверхностном слое жидкость-газ
- •2.1.5. Адсорбция на границе раздела двух несмешивающихся жидкостей
- •2.1.6. Адсорбция на границе раздела твердое тело-газ
- •2.1.7. Адсорбция на границе раздела твердое тело-раствор
- •2.1.7.1 Молекулярная адсорбция
- •2.1.7.2. Адсорбция электролитов
- •2.1.8. Количественное определение адсорбции
- •2.2. Хроматография
- •2.2.1. Сущность метода. Его применение в биологии и медицине
- •2.2.2. Классификация хроматографических методов
- •2.2.3. Молекулярно-адсорбционная хроматография
- •2.2.4. Проникающая (гель-) хроматография
- •2.2.5. Распределительная хроматография
- •2.2.6. Ионообменная хроматография
- •Основная литература
- •Дополнительная литература
- •Содержание
- •Глава 1. Комплексные соединения 4
- •Глава 2. Физическая химия поверхностных явлений 38
- •Для заметок Для заметок
1.4. Классификация комплексных соединений
Существует несколько способов классификации комплексных соединений, основанных на разных признаках. Наиболее распространённой является классификация по природе лигандов. В зависимости от природы лигандов различают:
аммиакаты (лиганды – молекулы NH3): [Cu(NH3)4]SO4; [Co(NH3)6]Cl3; [Pt(NH3)6]Cl4.
Если роль лигандов выполняют молекулы аминов: этилендиамин – NH2CH2CH2NH2 (обозначаемый как En), метиламин – CH3NH2, этиламин – C2H5NH2 и др. комплексы называют аминатами;
аквакомплексы (лиганды – молекулы Н2О): [Cr(H2O)6]Cl3; [Al(H2O)6]Cl3; [Cu(H2O)4](NO3)2. В кристаллическом состоянии некоторые из аквакомплексов удерживают кристаллизационную воду: [Cu(H2O)4]SO4 ∙ H2O. Кристаллизационная вода не входит в состав внутренней сферы, она связана менее прочно, чем координированная, и легче отщепляется при нагревании;
ацидокомплексы (лиганды – анионы различных кислот). К ним относятся:
комплексы типа двойных солей: K2[PtCl4], K4[Fe(CN)6], которые можно представить как продукты сочетания двух солей: PtCl2 ∙ 2KCl, Fe(CN)2 ∙ 4KCN;
комплексные кислоты: H2[SiF6];
гидроксокомплексы (лиганды – ионы ОН–): Na2[Sn(OH)4], Na2[Sn(OH)6];
переходные ряды комплексов. Включают комплексы с различными по природе лигандами. Запишем переходный ряд между аммиакатами и ацидокомплексами платины (II): [Pt(NH3)4]Cl2; [Pt(NH3)3Cl]Cl; [Pt(NH3)2Cl2]; K[Pt(NH3)Cl3]; K2[PtCl4];
циклические или хелатные комплексные соединения. Содержат би- или полидентатные лиганды, связанные с центральным атомом несколькими связями. Примерами могут служить оксалатный комплекс железа (III) – [Fe(C2O4)3]3– и этилендиаминовый комплекс платины (IV) – [PtEn3]4+:


В группу хелатов входят и внутрикомплексные соединения, в которых центральный атом, включаясь в состав цикла, образует ковалентные связи с лигандами разными способами: донорно-акцепторным и за счёт неспаренных атомных электронов. В организме такие комплексы характерны для ионов Cu или Fe с аминокислотами, например, меди с глицином в глицинате меди:
г де
две связи комплекса донорно-акцепторные,
возникающие за счёт донорно-акцепторного
взаимодействия неподелённых пар
электронов двух аминогрупп кислоты
де
две связи комплекса донорно-акцепторные,
возникающие за счёт донорно-акцепторного
взаимодействия неподелённых пар
электронов двух аминогрупп кислоты![]() со свободными орбиталями возбуждённого
иона меди, две другие – обычные ионные,
получаемые замещением в карбоксильных
группах ионов Н+
на ионы Cu2+.
со свободными орбиталями возбуждённого
иона меди, две другие – обычные ионные,
получаемые замещением в карбоксильных
группах ионов Н+
на ионы Cu2+.
сэндвичевые комплексы. К ним относятся дибензолхром – Cr(C6H6)2, ферроцен – Fe(C5H5)2 и другие. Это открытая в последнее время группа комплексных соединений с аномально высокой растворяющей способностью, за что они получили название краун-эфиров. Отличаются многоцентровыми, делокализованными связями комплексообразователя с лигандами.
Перечисленные комплексные соединения относятся к одноядерным, содержащим один центральный атом. Помимо них существуют полиядерные, в структуре которых одновременно присутствуют два или несколько центральных атома-комплексообразователя. К полиядерным комплексным соединениям относятся:
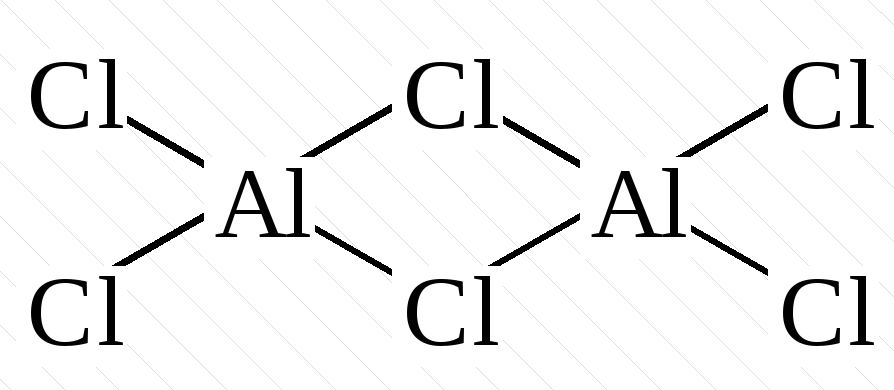
– комплексы с мостиковыми лигандами, где каждые два центральных атома соединены одним, двумя или тремя лигандами одновременно:
|
[Sb2F7]– |
–
|
|
[Al2Cl6] |
|
|
[Co2(OH)2(NH3)8]4+ |
4+
|
– кластерные соединения, в которых центральные атомы связаны между собой непосредственно:
|
[(CO)5Mn – Mn(CO)5] |
|
|
[Re2H2Cl8]2– |
2–
|
В 12–

|
[Ru3O12]12– |
|
– изополисоединения – полиядерные соединения с комплексными анионами, в которых комплексообразователями выступают атомы одного и того же элемента, а в качестве лигандов (в том числе и мостиковых) – оксид-ионы О2–. Наиболее распространенными из комплексов этого типа являются изополикислоты и их соли: Н4Р2О7, K2Cr2O7 и др., с пространственным расположением атомов:


– гетерополисоединения – полиядерные соединения, в комплексных ионах которых содержатся центральные атомы разных элементов, а в качестве лигандов (в том числе и мостиковых) выступают оксид-ионы О2–. К таким соединениям преимущественно относятся гетерополикислоты с общей формулой Н8–n[MnM12VIO40], где n - степень окисления В+3, Si+4, Ge+4, Ti+4, P+5; MVI – Mo или W. Например: Н4[GeMo12O40], H3[PW12O40], H5[BMo12O40].