
- •Комплексные соединения. Физическая химия поверхностных явлений
- •Глава 1. Комплексные соединения
- •1.1. Основные положения координационной теории
- •1.2. Природа химической связи в комплексном ионе
- •1.2.1. Электростатическая теория
- •1.2.2. Метод валентных связей
- •1.2.3. Метод молекулярных орбиталей
- •1.3. Пространственное строение и изомерия комплексных соединений
- •1.4. Классификация комплексных соединений
- •1.5. Номенклатура комплексных молекул
- •1.6. Диссоциация в растворах
- •1 Ступень
- •2 Ступень
- •1.7. Реакции комплексообразования
- •1.8. Хелатирование. Его роль в биологии и медицине
- •Полидентатные лиганды
- •1.9. Хелатотерапия
- •Глава 2. Физическая химия поверхностных явлений
- •2.1. Адсорбция
- •2.1.1. Поверхностная энергия и поверхностное натяжение
- •2.1.2. Поверхностная активность. Поверхностно-активные, поверхностно-неактивные и поверхностно-инактивные вещества
- •2.1.3. Адсорбция на границе раздела жидкость-газ. Уравнение Гиббса
- •2.1.4. Ориентация молекул в поверхностном слое жидкость-газ
- •2.1.5. Адсорбция на границе раздела двух несмешивающихся жидкостей
- •2.1.6. Адсорбция на границе раздела твердое тело-газ
- •2.1.7. Адсорбция на границе раздела твердое тело-раствор
- •2.1.7.1 Молекулярная адсорбция
- •2.1.7.2. Адсорбция электролитов
- •2.1.8. Количественное определение адсорбции
- •2.2. Хроматография
- •2.2.1. Сущность метода. Его применение в биологии и медицине
- •2.2.2. Классификация хроматографических методов
- •2.2.3. Молекулярно-адсорбционная хроматография
- •2.2.4. Проникающая (гель-) хроматография
- •2.2.5. Распределительная хроматография
- •2.2.6. Ионообменная хроматография
- •Основная литература
- •Дополнительная литература
- •Содержание
- •Глава 1. Комплексные соединения 4
- •Глава 2. Физическая химия поверхностных явлений 38
- •Для заметок Для заметок
2.1.2. Поверхностная активность. Поверхностно-активные, поверхностно-неактивные и поверхностно-инактивные вещества
σ
раствора, как правило, отличается от σ
растворителя. Зависимость поверхностного
натяжения раствора от концентрации
растворенного вещества, при условии
![]() ,
называютизотермой
поверхностного натяжения.
Для водных растворов различают три
основных типа изотерм поверхностного
натяжения (рис. 2.4), когда:
,
называютизотермой
поверхностного натяжения.
Для водных растворов различают три
основных типа изотерм поверхностного
натяжения (рис. 2.4), когда:
р
 астворенное
вещество незначительно повышает
поверхностное натяжение растворителя,
кривая 1 (
астворенное
вещество незначительно повышает
поверхностное натяжение растворителя,
кривая 1 ( ,
где σ0
- поверхностное натяжение растворителя;
σ – поверхностное натяжение раствора);
,
где σ0
- поверхностное натяжение растворителя;
σ – поверхностное натяжение раствора);растворенное вещество не изменяет поверхностное натяжение растворителя, прямая 2 (
 );
);растворенное вещество понижает поверхностное натяжение растворителя, кривая 3 (
 ).
).
Способность веществ изменять поверхностное натяжение на границе раздела фаз называют поверхностной активностью. Вещества, уменьшающие поверхностное натяжение растворителя, называются поверхностно-активными веществами (ПАВ); увеличивающие – поверхностно-инактивными (ПИВ); не влияющие на поверхностное натяжение растворителя – поверхностно-неактивными (ПНВ).
Поверхностно-активными, относительно воды, являются многие органические соединения, такие как жирные кислоты, их соли, спирты, амины, кетоны, сложные эфиры, белки, холестерин и др. Характерной особенностью строения их молекул является наличие полярных и неполярных групп: например, уксусная кислота имеет полярную – СООН группу и неполярный углеводородный радикал – СН3 . Полярная группа, обладающая моментом диполя и достаточно интенсивным силовым полем, имеет сродство к полярной фазе растворителя, растворяясь в нем. Полярными свойствами обладают также –ОН, –NO2, –NH2, –CHO, –SO2OH и другие группы. Все они хорошо гидратируются и являются гидрофильными. Неполярная часть ПАВ представляет собой гидрофобную углеводородную цепь или радикал, которые не гидратируются в воде, но могут сольватироваться молекулами неполярных растворителей.
М олекулы
ПАВ, у которых одновременно имеются
гидрофильная и гидрофобная группы,
называютсядифильными.
Схематически дифильные молекулы
изображают в виде символа -------о, в котором
прямой чертой обозначают углеводородный
радикал (хвост молекулы), а кружком –
полярную группу (голову молекулы).
Благодаря дифильному строению ПАВ, их
молекулы самопроизвольно сориентированы
на поверхность раздела, причем полярные
группы (головы) молекул располагаются
в водной (полярной фазе), а гидрофобные
радикалы (хвосты) вытесняются из водной
среды и переходят в менее полярную фазу,
воздух (рис. 2.5). Это приводит к
самопроизвольному накоплению молекул
ПАВ на границах раздела фаз, где их
концентрация в поверхностном слое
всегда значительно больше, чем внутри
объема. Из-за наличия гидрофобных
углеводородных радикалов молекулы ПАВ
слабее взаимодействуют с молекулами
воды, чем молекулы воды друг с другом:
олекулы
ПАВ, у которых одновременно имеются
гидрофильная и гидрофобная группы,
называютсядифильными.
Схематически дифильные молекулы
изображают в виде символа -------о, в котором
прямой чертой обозначают углеводородный
радикал (хвост молекулы), а кружком –
полярную группу (голову молекулы).
Благодаря дифильному строению ПАВ, их
молекулы самопроизвольно сориентированы
на поверхность раздела, причем полярные
группы (головы) молекул располагаются
в водной (полярной фазе), а гидрофобные
радикалы (хвосты) вытесняются из водной
среды и переходят в менее полярную фазу,
воздух (рис. 2.5). Это приводит к
самопроизвольному накоплению молекул
ПАВ на границах раздела фаз, где их
концентрация в поверхностном слое
всегда значительно больше, чем внутри
объема. Из-за наличия гидрофобных
углеводородных радикалов молекулы ПАВ
слабее взаимодействуют с молекулами
воды, чем молекулы воды друг с другом:
![]() ,
что ведет к понижению поверхностного
натяжения поверхностного слоя раствора,
содержащего ПАВ, по сравнению с чистым
растворителем (кривая 3, рис. 2.4).
,
что ведет к понижению поверхностного
натяжения поверхностного слоя раствора,
содержащего ПАВ, по сравнению с чистым
растворителем (кривая 3, рис. 2.4).
Количественной
мерой поверхностной активности, т.е.
способности ПАВ изменять поверхностное
натяжение, служит величина производной
![]() .
Ее обозначают черезg
и выражают в Дж•м/моль или Н•м2/моль:
.
Ее обозначают черезg
и выражают в Дж•м/моль или Н•м2/моль:
![]() .
.
Важность характеристики g в том, что она пропорциональна адсорбционной способности вещества. В узких интервалах концентраций производную заменяют отношением конечных изменений:
![]()
Физический смысл g можно представить как понижение поверхностного натяжения раствора при изменении концентрации ПАВ на единицу.
Поверхностная активность зависит главным образом от химической структуры сорбируемого соединения: природы полярной и строения неполярной частей молекулы ПАВ. Она тем больше, чем сильнее выражена полярная асимметрия молекулы. Например, если в молекуле ароматического соединения присутствуют две полярные группы, более активными будут ортоизомеры (а); если из двух замещающих групп одна полярна, а другая неполярна – большая поверхностная активность будет у параизомера (б).
В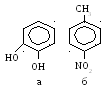 лияние
углеводородного радикала (неполярной
части молекулы) на поверхностную
активность наиболее проявляется в
гомологических рядах ПАВ.Дюкло
и Траубе
сформулировали эту закономерность в
виде правила: поверхностная
активность вещества одного и того же
гомологического ряда в разбавленном
растворе возрастает в 3,0-3,5 раза при
увеличении углеводородной цепи на одну
метиленовую группу:
лияние
углеводородного радикала (неполярной
части молекулы) на поверхностную
активность наиболее проявляется в
гомологических рядах ПАВ.Дюкло
и Траубе
сформулировали эту закономерность в
виде правила: поверхностная
активность вещества одного и того же
гомологического ряда в разбавленном
растворе возрастает в 3,0-3,5 раза при
увеличении углеводородной цепи на одну
метиленовую группу:
![]()
Величина β называется коэффициентом Траубе. Правило Дюкло-Траубе имеет важное теоретическое и практическое значение. Оно указывает верное начальное направление в синтезе высокоактивных ПАВ с длинными цепями (синтетических моющих и других поверхностных соединений).
Поверхностно-инактивными
веществами являются все неорганические
электролиты (кислоты, соли, основания)
и некоторые органические (α-аминокислоты
и др.). Ионы таких соединений хорошо
гидратируются, поскольку энергия
взаимодействия между молекулой воды и
ионом больше, чем молекул воды друг с
другом, что отражает неравенство:![]() .
Из-за высокой энергии гидратации
результирующая силаF
возрастает и поверхностные ионы
интенсивно втягиваются в глубину
раствора. Это приводит к тому, что в
растворах сильных электролитов
пограничный слой толщиной в несколько
молекулярных диаметров состоит
преимущественно из молекул воды, а ионы
солей содержатся в очень малой
концентрации. В итоге, поверхностное
натяжение раствора, по сравнению с
чистым растворителем, повышается
незначительно (кривая 1, рис. 2.4).
.
Из-за высокой энергии гидратации
результирующая силаF
возрастает и поверхностные ионы
интенсивно втягиваются в глубину
раствора. Это приводит к тому, что в
растворах сильных электролитов
пограничный слой толщиной в несколько
молекулярных диаметров состоит
преимущественно из молекул воды, а ионы
солей содержатся в очень малой
концентрации. В итоге, поверхностное
натяжение раствора, по сравнению с
чистым растворителем, повышается
незначительно (кривая 1, рис. 2.4).
При растворении в растворителе неэлектролита (сахароза, глюкоза в ряд других) поверхностное натяжение практически не изменяется (прямая 2, рис. 2.4).
