
- •Ферменты
- •Величина энергии активации с ферментом и без него
- •Сходство и отличия ферментов и неорганических катализаторов
- •2. Особенности ферментативного катализа. Этапы катализа
- •Механизмы катализа
- •Типы ферментативных реакций
- •Активный и аллостерический центры фермента.
- •Изоферменты
- •Мультиферментные комплексы
- •Строение мульферментного комплекса
- •4. Что мы понимаем под "активностью фермента"?
- •Единицы измерения активности и количества фермента.
- •5. От чего зависит активность ферментов?
- •1. Зависимость скорости реакции от температуры
- •2. Зависимость скорости реакции от рН
- •Оптимальные значения рН для некоторых ферментов
- •3. Зависимость от концентрации фермента
- •4. Зависимость скорости реакции от концентрации субстрата
- •5. Кинетика ферментативных реакций.
- •График зависимости скорости ферментативной реакции
- •Механизмы специфичности
- •7. Механизмы регуляции ферментативной активности.
- •2. Компартментализация
- •3. Изменение количества фермента
- •4. Ограниченный (частичный) протеолиз проферментов
- •5. Аллостерическая регуляция
- •Общий принцип аллостерической регуляции
- •Регуляция фосфофруктокиназы конечным продуктом
- •6. Белок-белковое взаимодействие
- •Принципиальная схема активации аденилатциклазы
- •Ингибирование ферментов
- •Необратимое ингибирование
- •Механизм необратимого ингибирования ацетилхолинэстеразы
- •Механизм необратимого ингибирования циклооксигеназы
- •Обратимое ингибирование
- •Конкурентное ингибирование
- •Конкурентное ингибирование сукцинатдегидрогеназы
- •Сходство строения сульфаниламидов и парааминобензойной кислоты, компонента витамина в9
- •Неконкурентное ингибирование
- •9. Различие ферментного состава органов и тканей.
- •11. Применение ферментов в медицине.
- •Энзимодиагностика
- •Электрофореграмма (денситограмма) содержания
- •Изменение активности ферментов в плазме крови при инфаркте миокарда. Энзимотерапия
- •Использование ферментов в медицинских технологиях
- •Использование ингибиторов ферментов
- •12. Классификация и номенклатура ферментов.
- •Iкласс. Оксидоредуктазы
- •Систематическое название образуется:
- •II класс. Трансферазы
- •Систематическое название образуется:
- •Систематическое название образуется:
- •Систематическое название образуется:
- •Систематическое название образуется:
- •Систематическое название образуется:
Ингибирование ферментов
Можно выделить два основных направления ингибирования
по прочности связывания фермента с ингибитором ингибирование бывает обратимыминеобратимым.
по отношению ингибитора к активному центру фермента обратимое ингибирование делят на конкурентное инеконкурентное.
Необратимое ингибирование
При необратимомингибировании происходитковалентноесвязывание илиразрушениефункциональных групп фермента, необходимых для проявления его активности.
Например, вещество диизопропилфторфосфат прочно и необратимо связывается с гидроксигруппой серина в активном центре ферментаацетилхолинэстеразы, гидролизующей ацетилхолин в нервных синапсах. Ингибирование этого фермента предотвращает распад ацетилхолина в синаптической щели, в результате чего медиатор продолжает оказывать воздействие на свои рецепторы, что бесконтрольно усиливает холинергическую регуляцию. Аналогичным образом действуют боевыефосфоорганические вещества(зарин, зоман) иинсектициды(карбофос, дихлофос).

Механизм необратимого ингибирования ацетилхолинэстеразы
Еще один пример связан с ингибированием ацетилсалициловой кислотой(аспирином) ключевого фермента синтеза простагландинов –циклооксигеназы. Эта кислота входит в состав противовоспалительных средств и используется при воспалительных заболеваниях и лихорадочных состояниях. Присоединение ацетильной группы к аминогруппе в активном центре фермента вызывает инактивацию последнего и прекращение синтеза простагландинов.
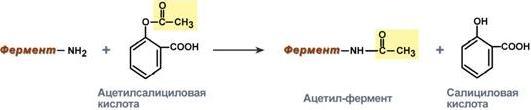
Механизм необратимого ингибирования циклооксигеназы
Одной из разновидностей необратимого ингибирования является суицидальное ингибирование. Этот вид ингибирования особенно интенсивно изучается фармакологами как путьрациональной разработки лекарственных препаратов. Суть его заключается в том, что биологически инертный субстрат, после преобразований в активном центре определённого фермента превращается в реакционную молекулу, необратимо блокирующую работу каталитического центра фермента.
Например, данный вид ингибирования нашёл применение при лечении африканской сонной болезни(African trypanosomiasis), которую вызывает трипаносомыTrypanosomas Brucei gambiense. Важным процессом в жизнедеятельности трипаносомы является синтезполиаминов(спермина и спермидина) для упаковки ДНК. Первым этапом этого процесса является декарбоксилирование аминокислотыорнитинас помощьюпиридоксаль-зависимого ферментаорнитин декарбоксилазы.У трипаносом в отличие от человека этот фермент медленно регенерирует и является долгоживущим. Был синтезирован суицидальный ингибитордифторметилорнитин(DFMO). В результате реакции фтор блокирует активный цент фермента, чем вызывает гибель трипаносомы.
Обратимое ингибирование
При обратимом ингибировании происходит непрочное связывание ингибитора с функциональными группами фермента, вследствие чего активность фермента постепенно восстанавливается.
Примером обратимого ингибитора может служить прозерин, связывающийся с ферментомацетилхолинэстеразойв ее активном центре. Группа ингибиторов холинэстеразы (прозерин, дистигмин, галантамин) используется при миастении, после энцефалита, менингита, травм ЦНС.
Конкурентное ингибирование
При таком виде ингибирования ингибитор по своей структуре похож на субстрат фермента. Поэтому он соперничает с субстратом за активный центр, что приводит к уменьшению связывания субстрата с ферментом и нарушению катализа. В этом состоит особенность конкурентного ингибирования – возможность усилить или ослабить ингибирование через изменение концентрации субстрата.
Например:
1. Конкурентное взаимодействие этанола иметанола за активный централкогольдегидрогеназы. Лечебные мероприятия включают конкурентное вытеснение метанола из активного центра алкогольдегидрогеназы путём медленной внутривенной инфузии этанола. Такая конкурентная замена препятствует образованию формальдегида.
2. Ингибирование сукцинатдегидрогеназы малоновой кислотой, структура которой схожа со структурой субстрата этого фермента – янтарной кислоты (сукцината).

