- •Ферменты
- •Величина энергии активации с ферментом и без него
- •Сходство и отличия ферментов и неорганических катализаторов
- •2. Особенности ферментативного катализа. Этапы катализа
- •Механизмы катализа
- •Типы ферментативных реакций
- •Активный и аллостерический центры фермента.
- •Изоферменты
- •Мультиферментные комплексы
- •Строение мульферментного комплекса
- •4. Что мы понимаем под "активностью фермента"?
- •Единицы измерения активности и количества фермента.
- •5. От чего зависит активность ферментов?
- •1. Зависимость скорости реакции от температуры
- •2. Зависимость скорости реакции от рН
- •Оптимальные значения рН для некоторых ферментов
- •3. Зависимость от концентрации фермента
- •4. Зависимость скорости реакции от концентрации субстрата
- •5. Кинетика ферментативных реакций.
- •График зависимости скорости ферментативной реакции
- •Механизмы специфичности
- •7. Механизмы регуляции ферментативной активности.
- •2. Компартментализация
- •3. Изменение количества фермента
- •4. Ограниченный (частичный) протеолиз проферментов
- •5. Аллостерическая регуляция
- •Общий принцип аллостерической регуляции
- •Регуляция фосфофруктокиназы конечным продуктом
- •6. Белок-белковое взаимодействие
- •Принципиальная схема активации аденилатциклазы
- •Ингибирование ферментов
- •Необратимое ингибирование
- •Механизм необратимого ингибирования ацетилхолинэстеразы
- •Механизм необратимого ингибирования циклооксигеназы
- •Обратимое ингибирование
- •Конкурентное ингибирование
- •Конкурентное ингибирование сукцинатдегидрогеназы
- •Сходство строения сульфаниламидов и парааминобензойной кислоты, компонента витамина в9
- •Неконкурентное ингибирование
- •9. Различие ферментного состава органов и тканей.
- •11. Применение ферментов в медицине.
- •Энзимодиагностика
- •Электрофореграмма (денситограмма) содержания
- •Изменение активности ферментов в плазме крови при инфаркте миокарда. Энзимотерапия
- •Использование ферментов в медицинских технологиях
- •Использование ингибиторов ферментов
- •12. Классификация и номенклатура ферментов.
- •Iкласс. Оксидоредуктазы
- •Систематическое название образуется:
- •II класс. Трансферазы
- •Систематическое название образуется:
- •Систематическое название образуется:
- •Систематическое название образуется:
- •Систематическое название образуется:
- •Систематическое название образуется:
5. От чего зависит активность ферментов?
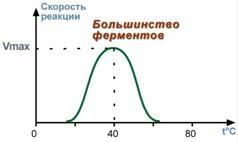
1. Зависимость скорости реакции от температуры
Зависимость активности ферментов (скорости реакции) от температуры описывается колоколообразной кривой с максимумом скорости при значенияхоптимальной температуры для данного фермента.
Закон о повышении скорости реакции в 2-4 раза при повышении температуры на 10°С справедлив и для ферментативных реакций, но только в пределах до 55-60°С, т.е. до температур денатурации белков. Наряду с этим, как исключение, имеются ферменты некоторых микроорганизмов, существующих в воде горячих источников и гейзеров. Это свойство ферментов используется медицинской лабораторной практике при анализе ДНК.
При понижении температуры активность ферментов понижается, но не исчезает совсем. Иллюстрацией может служить зимняя спячка некоторых животных (суслики, ежи), температура тела которых понижается до 3-5°С. Это свойство ферментов также используется в хирургической практике при проведении операций на грудной полости, когда тело больного или орган подвергают охлаждению до 22°С.
|
Зависимость скорости реакции от температуры |
2. Зависимость скорости реакции от рН
Зависимость также описывается колоколообразной кривойс максимумом скорости приоптимальном для данного ферментазначении рН.
Для каждого фермента существует определенный узкий интервал рН среды, который является оптимальным для проявления его высшей активности. Например, оптимальные значения рН для пепсина 1,5-2,5, трипсина 8,0-8,5, амилазы слюны 7,2, аргиназы 9,7, кислой фосфатазы 4,5-5,0, сукцинатдегидрогеназы 9,0.
|
Зависимость скорости реакции от величины pH
|

Оптимальные значения рН для некоторых ферментов
3. Зависимость от концентрации фермента
При увеличении количества молекул фермента скорость реакции возрастает непрерывно и прямо пропорционально количеству фермента, т.к. большее количество молекул фермента производит большее число молекул продукта.
4. Зависимость скорости реакции от концентрации субстрата
При увеличении концентрации субстратаскорость реакции сначала возрастает соответственно подключению к реакции новых молекул фермента, затем наблюдаетсяэффект насыщения, когда все молекулы фермента взаимодействуют с молекулами субстрата. При дальнейшем увеличении концентрации субстрата между его молекулами возникает конкуренция за активный центр фермента и скорость реакции снижается.
|
Зависимость скорости реакции от концентрации субстрата |
Зависимость скорости реакции от концентрации фермента |
5. Кинетика ферментативных реакций.
Уравнение Михаэ́лиса — Ме́нтен — основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата.
|
Maud Menten 1879 - 1960 |
Leonor Michaelis 1875 - 1949 |
В 1903, французский биофизик Victor Henri обнаружил, что ферментативная реакция инициируется после связывания фермента и субстрата. Эта работа была взята за основу немецким биохимиком Михаэлисом (Leonor Michaelis) и канадским физиологом Ментен (Maud Menten) (кстати, первая женщина, получившая докторскую степень по медицине), которые изучали кинетику механизма ферментативной реакции инвертазы при гидролизе сахарозы на фруктозу и глюкозу. В 1913 ими была предложена математическую модель ферментативной реакции. Они основывались на том, что субстрат [S] взаимодействует с ферментом [E] с образованием фермент-субстратного комплекса [ES] который после преобразования распадается на продукт [P] и фермент. Понятие константы Михаэлиса было внесено в 1925 году английским ботаником Бригсом (G. E. Briggs) и британским генетиком Холдейном (J. B. S. Haldane), так как в модели Михаэлиса-Ментен не учитывалась константа скорости распада [ES] с образованием продукта. В настоящее время математическая модель реакции выглядит следующим образом:

где k1, k-1 и k2 обозначены как констатны скорости. Авторы считали, что образование и распад фермент-субстратного комплекса вполне обратимый процесс. Скорость ферментативной реакции определяется скоростью распада фермент-субстратного комплекса:
V0 = k2[ES]
Практическим путём определить экспериментально уровень [ES] весьма затруднительно, поэтому необходимо было найти альтернативный способ его определения. Для этого были применены некоторые вводные:
[Et] – общий уровень фермента участвующий в реакции на данный момент (сумма свободного и связанного с субстратом фермента). Тогда концентрация свободного фермента ровна [Et] - [ES].
так как [S] обычно значительно превосходит концентрацию фермента [Et], можно пренебречь количеством субстрата связанного с ферментом в каждый данный момент реакции.
Расчёт имеет несколько этапов:
1 этап. Скорость образования фермент-субстратного комплекса можно представить используя константы скорости синтеза (k1) и распада (k-1 и k2) фермент-субстратного комплекса:
(Образование) ES = k1([Et] - [ES])[S]
(Распад) ES = k-1[ES] + k2[ES]
2 этап.Начальные этап каталитической реакции характерен наличием постоянной концентрации фермент-субстратного комплекса [ES] (распад равен синтезу) т.е. состояния равновесия. Следовательно можно объединить два предыдущих уровнения:
k1([Et] - [ES])[S] = k-1[ES] + k2[ES]
3 этап. Необходимо провести алгеброические преобразования – разделить обе части уравнения на [ES], получится:
k1[Et][S] - k1[ES][S] = (k-1 + k2)[ES]
Перенесём k1[ES][S]в левую часть уравнения и вынесем за скобки [ES], получим:
k1[Et][S] = (k1[S] + k-1 + k2)[ES]
Решим уравнение, определив [ES]:
![]()
Упростим уравнение разделив числитель и знаменатель на k1:
![]()
Полученное соотношение суммы констант скорости распада к константе скорости синтеза [ES]–(k2 + k-1)/k1 получило название константа Михаэлиса(Km).

Этап 4. Полученный результат вносим в уравнение определения скорости ферментативной реакции:

Если принять во внимание, что максимальная скорость реакции Vmaxвозможна при условии полного насыщения фермента субстратом, т.е [ES] = [Et], то Vmax может быть представлена как k2[Et]. Подставив это в уравнение получаемуравнение Михаэлиса-Ментен как оно выглядит в наши дни:

В классическом виде вместо Kmстоялкоэффициент диссоциации Kd (Kd= k-1/k1) так как авторы основывались на уравнении:k1[E][S]=k-1[ES]. А Лайнвивер и Бэрк внесли новое усовершенствование в уравнение -k1[E][S]=k-1[ES] + k2[ES]