
- •Ферменты
- •Величина энергии активации с ферментом и без него
- •Сходство и отличия ферментов и неорганических катализаторов
- •2. Особенности ферментативного катализа. Этапы катализа
- •Механизмы катализа
- •Типы ферментативных реакций
- •Активный и аллостерический центры фермента.
- •Изоферменты
- •Мультиферментные комплексы
- •Строение мульферментного комплекса
- •4. Что мы понимаем под "активностью фермента"?
- •Единицы измерения активности и количества фермента.
- •5. От чего зависит активность ферментов?
- •1. Зависимость скорости реакции от температуры
- •2. Зависимость скорости реакции от рН
- •Оптимальные значения рН для некоторых ферментов
- •3. Зависимость от концентрации фермента
- •4. Зависимость скорости реакции от концентрации субстрата
- •5. Кинетика ферментативных реакций.
- •График зависимости скорости ферментативной реакции
- •Механизмы специфичности
- •7. Механизмы регуляции ферментативной активности.
- •2. Компартментализация
- •3. Изменение количества фермента
- •4. Ограниченный (частичный) протеолиз проферментов
- •5. Аллостерическая регуляция
- •Общий принцип аллостерической регуляции
- •Регуляция фосфофруктокиназы конечным продуктом
- •6. Белок-белковое взаимодействие
- •Принципиальная схема активации аденилатциклазы
- •Ингибирование ферментов
- •Необратимое ингибирование
- •Механизм необратимого ингибирования ацетилхолинэстеразы
- •Механизм необратимого ингибирования циклооксигеназы
- •Обратимое ингибирование
- •Конкурентное ингибирование
- •Конкурентное ингибирование сукцинатдегидрогеназы
- •Сходство строения сульфаниламидов и парааминобензойной кислоты, компонента витамина в9
- •Неконкурентное ингибирование
- •9. Различие ферментного состава органов и тканей.
- •11. Применение ферментов в медицине.
- •Энзимодиагностика
- •Электрофореграмма (денситограмма) содержания
- •Изменение активности ферментов в плазме крови при инфаркте миокарда. Энзимотерапия
- •Использование ферментов в медицинских технологиях
- •Использование ингибиторов ферментов
- •12. Классификация и номенклатура ферментов.
- •Iкласс. Оксидоредуктазы
- •Систематическое название образуется:
- •II класс. Трансферазы
- •Систематическое название образуется:
- •Систематическое название образуется:
- •Систематическое название образуется:
- •Систематическое название образуется:
- •Систематическое название образуется:
Конкурентное ингибирование сукцинатдегидрогеназы
3. Также к конкурентным ингибиторам относят антиметаболиты или псевдосубстраты, например, антибактериальные средства сульфаниламиды, схожие по структуре сп-аминобензойной кислотой, компонентом фолиевой кислоты. При лечении сульфаниламидами в бактериальной клетке конкурентно нарушается использованиеп-аминобензойной кислоты для синтезафолиевой кислоты, что и вызывает лечебный эффект.

Сходство строения сульфаниламидов и парааминобензойной кислоты, компонента витамина в9

График Лайнвивер-Бэрка. Конкурентное ингибирование (в присутствии
конкурентного ингибитора Vmaxостаётся неизменной).
Неконкурентное ингибирование
Данный вид ингибирования связан с присоединением ингибитора не в активном центре, а в другом месте молекулы. Это может быть аллостерическое ингибирование, когда активность фермента снижается естественными модуляторами, или связывание с ферментом каких-либо токсинов. Как правило этот вид, а также смешанный вид ингибировния присущи ферментам имеющим два и более субстратов.
Например, синильная кислота (цианиды)связывается с гемовым железом ферментов дыхательной цепи и блокирует клеточное дыхание.

График Лайнвивер-Бэрка. Неконкурентное ингибирование (в присутствии неконкурентного ингибитора Vmaxизменяется).
Смешанный тип ингибирования.
При данном виде ингибирования ингибитор присоеденяется к ферменту не только как аллостерический регулятор, но может связываться с фермент-субстратным комплексом [ES]
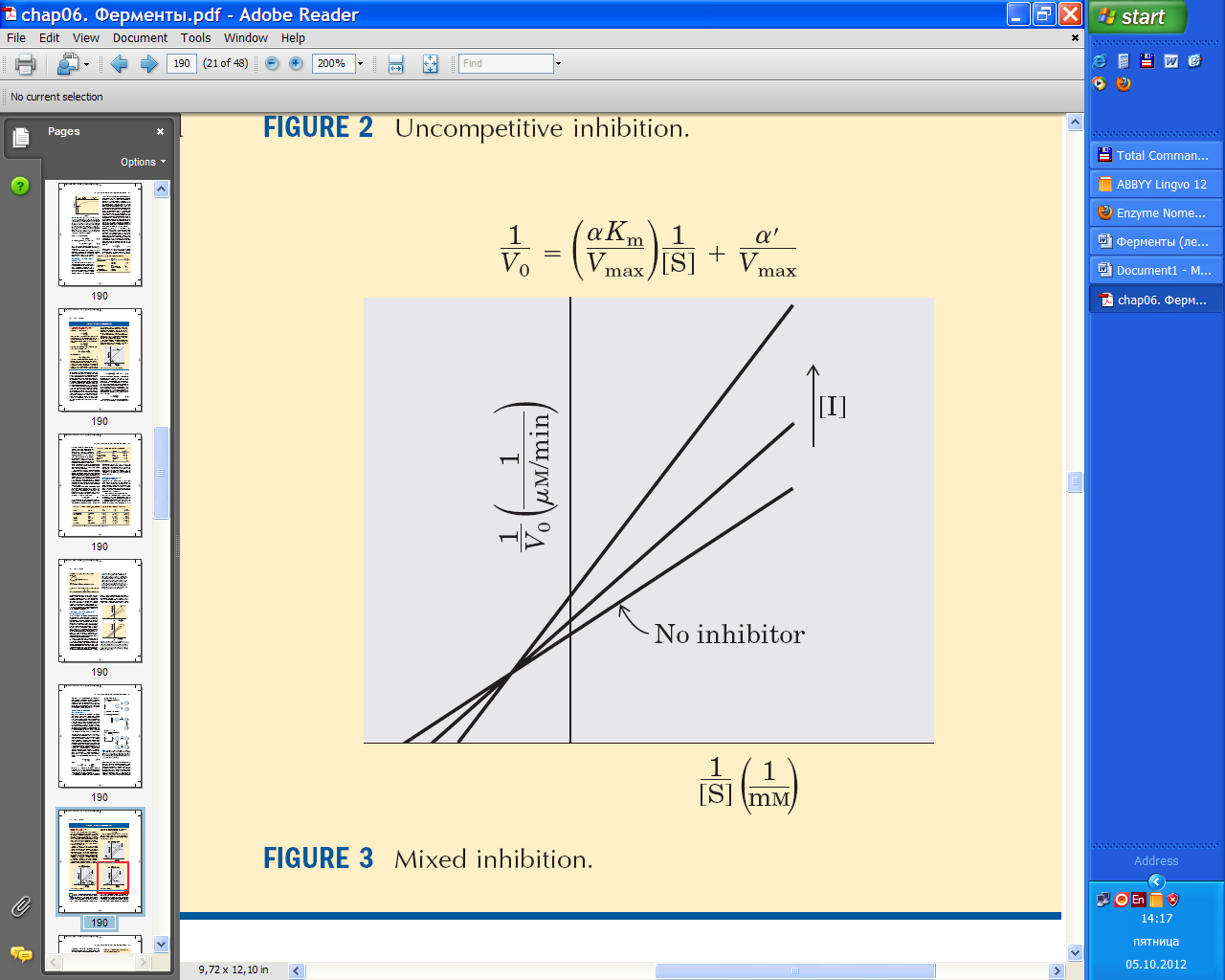
График Лайнвивер-Бэрка. Смешанный тип ингибирования (в присутствии ингибитора изменяется и Vmax иKm).
9. Различие ферментного состава органов и тканей.
Состав энзимов различных клеток тканей неодинаков – это обусловлено различием функций, выполняемых этими тканями. Естественно - ферменты, выполняющие функцию жизнеобеспечения клетки присутствуют во всех клетках организма. В процессе дифференцировки клеток их ферментный набор претерпевает изменения. Например, фермент аргиназа, участвующий в синтезе мочевины, находится только в клетках печени, а кислая фосфатаза – в клетках простаты. Это органоспецифические ферменты. Стоит также вспомнить органоспецифичность изоферментов лактатдегидрогеназы и креатинкиназы.
В некоторых специализированных клетках присутствует высокий уровень ферментов по сравнению с другими клетками. Например, в кардиомиоцитах высокий уровень креатинкиназы (MB изоформа) и аспартатаминотрансферазы (АсАТ), в гепатоцитах – аланинаминотрансферазы (АлАТ) и аспартатаминотрансферазы, в остеобластах – щелочной фосфатазы.
10. Изменение активности ферментов при патологии. Энзимопатии.
В основе большинства заболеваний и патологических состояний лежит нарушение функционирования ферментов в клетке – энзимопатии (энзимопатологии). Различают первичные (наследственные) и вторичные (преобретённые) энзимопатии. Первичные энзимопатии обычно относят к метаболическим болезням.
При наследственной энзимопатии возможны следующие сценарии:
нарушение образования конечного продукта. Например, а) при альбинизме имеет место недостаточность фермента тирозингидроксилазы (тирозиназы), что нарушает синтез меланина. Наблюдается слабая пигментация кожи, волос, красноватый цвет радужки. б) недостаток катехоламинов при паркинсонизме.
накопление субстратов предшественников. Имеет место при алкаптонурии – нарушении активности фермента окисления гомогентизиновой кислоты – диоксигеназы гомогентизиновой кислоты. Гомогентизиновая кислота – промежуточный метаболит катаболизма тирозина. При этом заболевании её уровень растёт и увеличивается выделение с мочой. В присутствии кислорода воздуха гомогентизиновая кислота превращается в соединение чёрного цвета – алкаптон. Фенилкетонурия, связана с дефектом фенилаланин-4-монооксигеназы, которая превращает фенилаланин в тирозин. В результате накапливаются аномальные метаболиты фенилаланина, оказывающие сильный токсический эффект. Заболевание подагра связано с дефектом ферментов метаболизма пуриновых оснований и накоплением мочевой кислоты.свободного билирубина при желтухах новорожденных, некоторых жиров при болезнях лизосомального накопления (липидозы). Кроме указанных, распространенными первичными энзимопатиями являются галактоземия, недостаточность лактазы и сахаразы.
Нарушение образования конечных продуктов и накопление субстратов предшественников. Например, при гликогенозах, сопровождающихся гипогликемией при избытке гликогена в печени. В частности – при болезни Гирке (гликогеноз Iа типа) наблюдается гипогликемия (снижение уровня глюкозы в крови) в перерывах между приёмами пищи. Это связано с нарушением распада гликогена в печени вследствии нарушения фермента глюкозо-6-фосфат фосфатазы и накоплением гликогена в клетках печени (гепатомегалия).
Вторичные (приобретенные) энзимопатии возникают как следствие заболеваний органов, вирусных инфекций и т.п., что приводит к нарушению синтеза фермента или условий его работы, например,гипераммониемияпри заболеваниях печени, при которых ухудшается синтез мочевины и в крови накапливается аммиак. Другим примером может служить недостаточностьферментовжелудочно-кишечного трактапри заболеваниях желудка, поджелудочной железы или желчного пузыря.
Недостаток витаминови их коферментных форм также является причиной приобретенных ферментопатий.
