
- •Қазақстан Республикасы Білім және ғылым министрлігі
- •1. Оқытушы жайлы мәлімет: ___________________________________
- •5. Курстың қысқаша сипаттамасы:
- •6. Пәннің мазмұны
- •8. Әдебиеттер тізімі
- •9. Курстың саясаты
- •10. Білімді бағалау жөніндегі ақпарат
- •11. Бағалау саясаты
- •Пән бойынша студенттің білімін бағалау кестесі
- •Емтиханда студенттің білімін бағалау кестесі
- •Студенттің білімін бағалау шкаласы
- •Кинематика
- •Бақылау сұрақтары
- •Бақылау сұрақтары
- •Бақылау сұрақтары
- •Бақылау сұрақтары
- •Негізгі анықтамалар мен ұғымдар
- •Барометрлік формула. Больцман таралуы
- •Бақылау сұрақтары
- •Бақылау сұрақтары
- •Бақылау сұрақтары
- •Вакуумдегі электр өрісі
- •Бақылау сұрақтары
- •Бақылау сұрақтары
- •Бақылау сұрақтары
- •Бақылау сұрақтары
- •Магнит өрісінің сипаттамалары
- •Бақылау сұрақтары
- •Бақылау сұрақтары
- •Зертханалық жұмыстар Физикалық шамаларды өлшеу және математикалық өңдеу
- •I. Тікелей өлшеу нәтижелерін өңдеу реті
- •Жұмыстың орындалу реті
- •Жұмыстың орындалу реті
- •Бақылау сұрақтары
- •Серіппелі маятниктің тербелісін зерттеу
- •Жұмыстың орындалу реті
- •Бақылау сұрақтары
- •, Немесе:
- •Шыққан теңдеуден физикалық маятниктің о нүктесі арқылы өтетін қозғал-майтын оське қатысты инерция моменті анықталады:
- •Жұмыстың орындалу реті
- •Бақылау сұрақтары
- •Қондырғының сипаттамасы
- •Жұмыстың орындалу реті
- •Бақылау сұрақтары
- •Стокс әдісімен сұйықтың тұтқырлық коэффициентін анықтау
- •Жұмыстың орындалу реті
- •Бақылау сұрақтары
- •Адиабаттық ұлғаю әдісімен газдың меншікті жылу сыйымдылықтарының қатынасын анықтау
- •Жұмыстың орындалу реті
- •Бақылау сұрақтары
- •Жұмыстың орындалу реті
- •Өлшеу нәтижелерін өңдеу
- •Бақылау сұрақтары
- •Тәжірибенің теориясы мен әдісі
- •Тәжірибелік қондырғы
- •Жұмыстың орындалуы
- •Тәжірибенің нәтижелерін өңдеу
- •Бақылау сұрақтары
- •Өткізгіштердің кедергісін көпір схемасының
- •Жұмыстың орындалу реті
- •Бақылау сұрақтары
- •Тәжірибелік қондырғы
- •Жұмыстың орындалу реті
- •Бақылау сұрақтары
- •Жердің магнит өрісі кернеулігінің горизонталь құраушысын анықтау
- •Жұмыстың орындалу реті
- •Бақылау сұрақтары
- •Кедергі арқылы конденсатордың разрядталуын зерттеу
- •Жұмыстың орындалу реті
- •Бақылау сұрақтары
- •Практикалық сабақ есептері
- •Есептердің жауабы
- •Өздік жұмыс тапсырмалары
- •Емтихандық тест сұрақтары
- •Нұсқалардың үлгілері
- •Пайдаланылған әдебиеттер
Жұмыстың орындалу реті
1. Микрометрмен кішкене шардың диаметрін өлшеп алып, оны глицерин
құйылған цилиндр пішіндес шыны ыдысқа тастау керек.
2. Кішкене шардың қозғалысын бақылай отырып, жоғарғы белгіден өте
бергенде секундомерді іске қосып, ал екінші төменгі белгінің тұсынан
өткенде секундомерді тоқтатып, шардың түсу уақытын өлшеу керек.
3.
Белгілердің ара қашықтығын l мм дәлдікпен
өлшеп,
![]() формуласы
формуласы
көмегімен шардың түсу жылдамдығын есептеу керек. Анықталған
шамалардың орташа мәндерін (8) формулаға қойып, глицериннің
тұтқырлық коэффициентін анықтаймыз.
Формуладағы кейбір шамалардың мәндері анықтамадан алынады:
глицериннің тығыздығы r1 =1,26*103кг/м3,
қорғасынның тығыздығы r =11,4*103кг/м3,
еркін түсу үдеуі g= 9,81м/с2.
4. Тәжірибені 3-5 рет қайталап, нәтижелерін кестеге жазу керек.
1-кесте
|
№ |
r, м |
l, м |
t, c |
м/c |
h, кг/(м·с) |
hорт, кг/(м с) |
Dh, кг/(м·с) |
Dhорт, кг/(м·с) |
% |
|
1 |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
| |||
|
3 |
|
|
|
|
|
|
Бақылау сұрақтары
1. Ішкі үйкеліс күші қалайша пайда болады ?
2. Ішкі үйкеліс үшін Ньютон формуласы. Жылдамдық градиенті деген не?
3. Динамикалық және кинематикалық тұтқырлық коэффициенттерінің физикалық мағынасын түсіндіріңіз. Олардың өлшем бірліктері.
4. Тұтқырлық коэффициентінің температурадан тәуелділігі қандай ?
5. Тұтқырлық коэффициентін есептеу формуласын (8) қорытып шығару.
№ 15 зертханалық жұмыс
Адиабаттық ұлғаю әдісімен газдың меншікті жылу сыйымдылықтарының қатынасын анықтау
Ж ұ м ы с т ы ң м а қ с а т ы : бөлме температурасындағы ауаның адиабаттық көрсеткішін тәжірибелік жолмен анықтау.
Қ ұ р а л – ж а б д ы қ т а р : шыны ыдыс, насос, манометр.
Т е о р и я л ы қ м а ғ л ұ м а т т а р
Адиабаттық процестің негізгі заңдылықтары идеал газ қасиетінің кейбір ерекшеліктері арқылы зерттеледі. Идеал газ дегеніміз молекулаларының өлшемі елеусіз аз және олардың арасында тартылыс әрі тебіліс күштері болмайтын, сондай-ақ молекулаларының бір-бірімен соқтығысуы серпімді деп қарастырылатын абстрактылы газ. Кез келген сиретілген нақты газ өзінің қасиеті жағынан идеал газға біршама жақын келеді.
Идеал газдың бір күйден екінші күйге ауысуы оның параметрлерінің өзгеруімен сипатталады. Термодинамиканың 1-бастамасына сәйкес, газға берілген жылу мөлшері dQ оның ішкі энергиясын dU өзгертуге және газдың сыртқы күштерге қарсы термодинамикалық жұмыс dА атқаруына жұмсалады.
![]() .
(1)
.
(1)
Жылу сыйымдылығының анықтамасы бойынша:
С![]() .
(2)
.
(2)
Осы
өрнектен газды қыздыру тәсіліне
байланысты оның жылу сыйымды-лығының
әр түрлі болатынын байқалады. Себебі
температураның
![]() өсімшесінің бір мәніне
өсімшесінің бір мәніне
![]() мен
мен
![]() -ның
бірнеше мәні сәйкес келуі мүмкін.
-ның
бірнеше мәні сәйкес келуі мүмкін.
Меншікті жылу сыйымдылығы - газдың бірлік массасының температу-расын бір градусқа өзгертуге қажетті жылу мөлшері:
![]() .
(2а)
.
(2а)
Мольдік жылу сыйымдылығы – мөлшері 1моль газдың температурасын бір градусқа арттыруға қажет жылу мөлшеріне тең шама:
![]() .
(2б)
.
(2б)
Жылу сыйымдылықтары тұрақты қысымдағы меншікті жылу сыйымды-лығы ср және мольдік жылу сыйымдылығы Ср, тұрақты көлемдегі меншікті жылу сыйымдылығы сv және мольдік жылу сыйымдылығы Сv болып бөлінеді. Газбен салыстырғанда көлемі аз өзгеретін қатты денелер мен сұйықтар үшін ср мен сv мәндерінің шамалары бір–біріне жуық болады. Әр түрлі практикалық есептер үшін оларды бірдей деп санауға болады.
Изобарлық процесте (p=const) газға берілген жылу жұмыс істеуге және газдың ішкі энергиясының өзгеруіне, ал изохорлық процесте (V=const) тек ішкі энергияның өзгеруіне жұмсалады.
Идеал
газдың бір молінің ішкі энергиясы
![]() екенін ескерсек, оның тұрақты көлемдегі
мольдік жылу сыйымдылығы
екенін ескерсек, оның тұрақты көлемдегі
мольдік жылу сыйымдылығы
![]() ,
тұрақты қысымдағы мольдік жылу
сыйымдылығы Майер теңдеуіне сәйкес:
,
тұрақты қысымдағы мольдік жылу
сыйымдылығы Майер теңдеуіне сәйкес:
![]() .
.
Термодинамикалық жүйеде оны қоршаған ортамен жылу алмаспай орындалатын процесс адиабаттық процесс деп аталады. Адиабаттық процеске тез өтетін құбылыстарды жатқызуға болады. Адиабаттық процесс үшін идеал газдың көлемі мен қысымы арасындағы тәуелділік Пуассон теңдеуімен анықталады:
pVg = const.
Мұнда
![]() -
адиабаттық
көрсеткіш –
газдың тұрақты қысымдағы жылу
сыйымдылығының тұрақты көлемдегі жылу
сыйымдылыққа қатынасы:
-
адиабаттық
көрсеткіш –
газдың тұрақты қысымдағы жылу
сыйымдылығының тұрақты көлемдегі жылу
сыйымдылыққа қатынасы:
![]() .
.
Мольдік жылу сыйымдылықтары тек қана молекулалардың еркіндік дәрежесінің саны арқылы анықталатындығын ескерсек:
![]() .
(3)
.
(3)
![]() болғандықтан,
олардың қатынасы әрқашан бірден үлкен.
болғандықтан,
олардың қатынасы әрқашан бірден үлкен.
Адиабаттық процесс (dQ =0) жағдайында:
1)
![]() ,
сыртқы күштердің жұмысы газдың ішкі
энергиясын арттырады, (яғни
,
сыртқы күштердің жұмысы газдың ішкі
энергиясын арттырады, (яғни
![]() ).
).
2)
![]() ,
газ
жүйенің
ішкі энергиясының кемуі есебінен сыртқы
күштерге қарсы жұмыс атқарады (яғни
,
газ
жүйенің
ішкі энергиясының кемуі есебінен сыртқы
күштерге қарсы жұмыс атқарады (яғни
![]() ).
).
Ауаның адиабаттық көрсеткішін анықтаудың қарапайым бір жолы – Клеман-Дезорма әдісі. Эксперименттік қондырғы бір-бірімен қосылған сұйықтық манометрден, насостан және шыны баллоннан тұрады. Баллон кран арқылы атмосферамен байланысқан. Егер баллон ішіне біраз мөлшерде ауа үрлейтін болсақ, онда баллон ішіндегі ауаның қысымы және температурасы артады, бірақ сыртқы ортамен жылу алмасу нәтижесінде біраз уақыттан кейін баллон ішіндегі ауаның температурасы қоршаған ортаның Т1 температурасымен теңеледі, ал қысымы p1=H+h1 болады, мұндағы H - атмосфералық қысым, h1 - манометрдегі сұйық деңгейлерінің айырмасын көрсететін қосымша қысым. Сонымен, газдың
бірінші күйі мына параметрлермен анықталады: p1=H+h1, Т1, V1.
Егер кранды өте аз уақытқа ашсақ, онда баллон ішіндегі ауаның көлемі V2 көлемге дейін ұлғаяды, ал қысымы атмосфералық қысымға Н дейін түседі де, температурасы Т2-ге дейін төмендейді. Бұл газдың екінші күйі болады. 1-күйден 2-күйге өту процесі өте жылдам өтеді, сондықтан да оны адиабаттық процесс деп санауға болады. Пуассон теңдеуіне сәйкес
(H+h1)
Vg
= H Vg2
, немесе
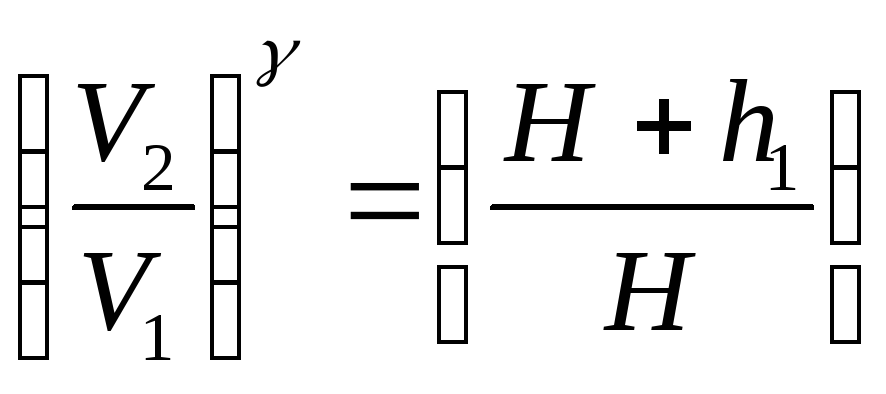 .
(5)
.
(5)
Жылу алмасу нәтижесінде біраз уақыт өткеннен соң газ сыртқы қоршаған орта температурасына Т1 дейін қызады да қысымы p2=H+h2 дейін артады, мұндағы h2 –манометрдегі сұйық деңгейлерінің соңғы айырмасы. Газдың осы үшінші күйі p1, Т1,V1 параметрлерімен сипатталады.
Газдың бірінші және үшінші күйлеріндегі температуралары бірдей болғандықтан, осы күйлердің параметрлерін Бойль-Мариотт теңдеуімен байланыстыруға болады
V1
(H+h1)
= V2
(H+h2)
немесе
![]() .
(6)
.
(6)
(6) теңдеуден көлемдердің қатынасын (5) теңдеуге қойғанда:
 .
.
Осы теңдеуді логарифмдеп, адиабаттық көрсеткішті табамыз:
![]() .
.
Қысымның мәндерінің бір-бірінен айырмашылығы аз болғандықтан, логарифмдер айырмасын шамалардың өз айырмаларымен алмастырамыз
![]() ,
немесе
,
немесе
![]() .
(7)
.
(7)
