
- •Кафедра «Теплоэнергетика»
- •Краткий курс лекций
- •5В071700 - «Теплоэнергетика» направление – «Бакалавриат»
- •Лекция № 1. Тема: основные определения термодинамики.
- •Предмет и метод термодинамики
- •Принцип построения термодинамики
- •Основные понятия и определения термодинамики
- •Лекция № 2. Тема: параметры состояния тела.
- •В настоящее время применяют различные температурные шкалы-Цельсия. Реомюра, Фаренгейта, Ренкина, соотношения между которыми приводятся в таблице 2.3
- •Лекция № 3. Тема: идеальный газ. Основные газовые законы.
- •Лекция № 4. Тема: смеси идеальных газов.
- •Лекция № 5. Тема: теплоемкость газов.
- •Теплоемкость газовой смеси
- •Лекция № 6. Тема: первый закон термодинамики. Внутренняя энергия
- •Теплота
- •Первый закон термодинамики
- •Закон сохранения и превращения энергии :
- •Формулировка и уравнение первого закона термодинамики
- •Энтальпия газов
- •Лекция № 7 Тема: основные термодинамические процессы. Основными термодинамическими процессами являются:
- •Метод исследования процессов состоит в следующем:
- •Политропный процесс ()
- •Тема: второй закон термодинамики.
- •Энтропия идеального газа
- •Тепловая диаграмма (ts-диаграмма)
- •Лекция № 9 Тема: водяной пар. Процессы водяного пара. Уравнение состояния реального газа
- •Водяной пар
- •Сухой насыщенный пар
- •Влажный насыщенный пар
- •Перегретый пар
- •Энтропия пара
- •Лекция № 10 Тема: влажный воздух.
- •Изображение адиабатного процесса
- •Изобарный процесс водяного пара
- •Цикл Карно. Теорема Карно
- •Теорема Карно
- •Лекция № 12. Уравнение первого закона термодинамики для потока. Истечение газов и паров. Дросселирование.
- •Лекция № 13 Тема: циклы поршневых компрессоров, двс, гту.
- •Теоретическая мощность двигателя для привода компрессора
- •Теоретические циклы поршневых двигателей внутреннего сгорания
- •Циклы газотурбинных установок
- •Лекция № 14
- •1 Паросиловой цикл Ренкина
- •2 Теплофикационный цикл
- •3Регенеративный цикл
- •4 Цикл воздушной холодильной установки
- •Лекция № 15
Энтальпия газов
Аналитическое выражение первого закона термодинамики имеет вид:
для любого тела
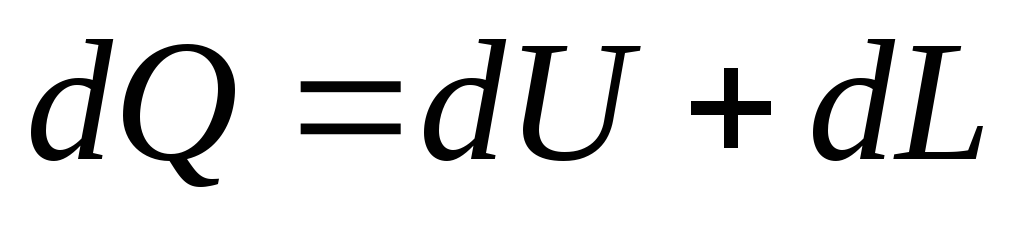 , (13)
, (13)
где
![]() - количество теплоты, сообщённое извне
рабочему телу массой М, кг;
- количество теплоты, сообщённое извне
рабочему телу массой М, кг;
![]() - изменение внутренней энергии рабочего
тела;
- изменение внутренней энергии рабочего
тела;
![]() - работа, совершённая рабочим телом по
преодолению внешнего давления.
- работа, совершённая рабочим телом по
преодолению внешнего давления.
для бесконечно малого изменения состояния 1 кг любого газа
![]() ,
(14)
,
(14)
Так как
![]() ,
то
,
то
![]() ,
(15)
,
(15)
где
![]() - работа расширения 1кг газа.
- работа расширения 1кг газа.
Заменяя в основном
уравнении термодинамики (11) величину
![]() через
через![]() получаем
получаем![]() .
.
Выражение
![]() является параметром состояния и
называетсяэнтальпией i
(теплосодержанием),кДж/кг.
является параметром состояния и
называетсяэнтальпией i
(теплосодержанием),кДж/кг.
![]() ,
(16)
,
(16)
Основное уравнение
первого уравнения термодинамики,
выраженное через энтальпиюимеет вид![]() ,
(17)
,
(17)
для идеальных газов
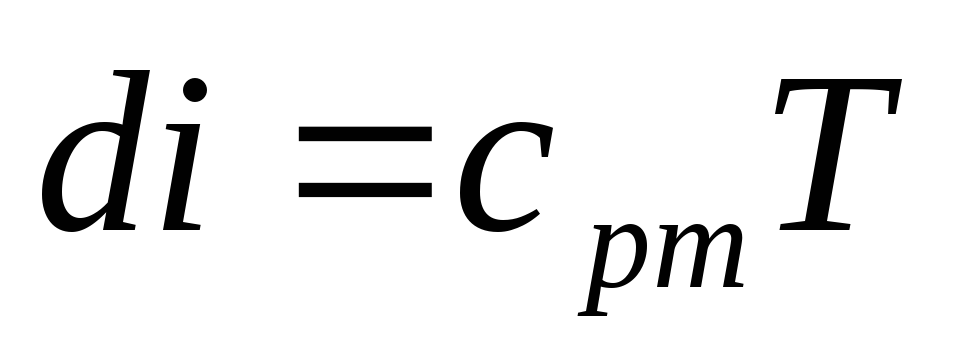 ,
(18)
,
(18)
где
![]() - средняя массовая теплоёмкость приp=constв
пределах от 0 до Т.
- средняя массовая теплоёмкость приp=constв
пределах от 0 до Т.
Обычно в расчётах требуется знать изменение энтальпии, а не её абсолютное значение. Интегрируя уравнение (17) при p=const, получаем:
![]() ,
(19)
,
(19)
то есть количество теплоты в процессе p=constчисленно можно найти как разность энтальпии конечного и начального состояния.
Лекция № 7 Тема: основные термодинамические процессы. Основными термодинамическими процессами являются:
1) Изохорный процесс - процесс сообщения или отнятия теплоты при постоянном объёме газа(V=const);
2) Изобарный процесс- процесс сообщения или отнятия теплоты при постоянном давлении(Р=const);
3) Изотермический процесс- процесс сообщения или отнятия теплоты при постоянной температуре(t=const);
4) Адиабатный процесс– процесс, при котором отсутствует теплообмен с окружающей средой(dq=0);
5) Политропный
процесс- процесс, в котором изменение
параметров подчиняется уравнению
![]() ,
гдеm- величина, постоянная
для данного процесса
,
гдеm- величина, постоянная
для данного процесса
Метод исследования процессов состоит в следующем:
Выводится уравнение процесса, устанавливающее связь между начальными и конечными параметрами рабочего тела в данном процессе;
Вычисляется работа изменения объема газа;
Определяется количество теплоты, подведенной (или отведенной) к газу в процессе;
Определяется изменение внутренней энергии системы в процессе;
Определяется изменение энтропии системы в процессе.
Изохорный процесс (V=const)
Для графического метода исследования процессов используется координатная система p-v.
Изохорный процесс в pv-диаграмме изображается отрезком прямой 1-2, идущим параллельно оси ординат. Прямая 1-2 называетсяизохорой.
При направлении от точки 1 к точке 2 процесс идёт с сообщением теплоты, при направлении от точки 2 к точке 1 – с отводом теплоты.
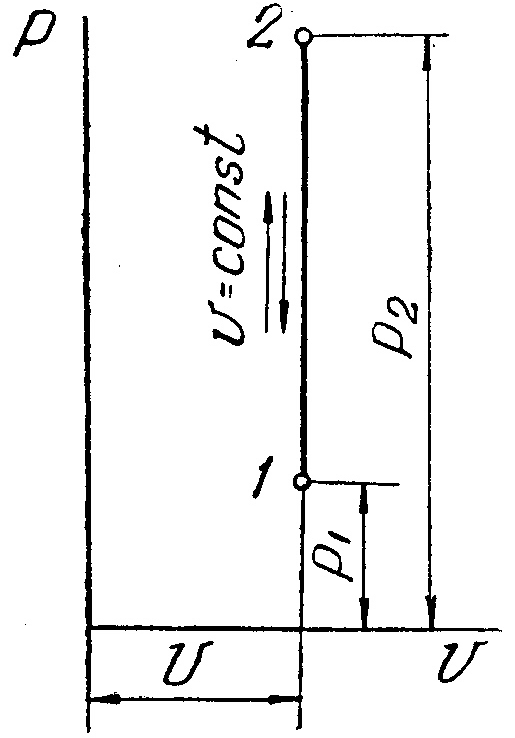
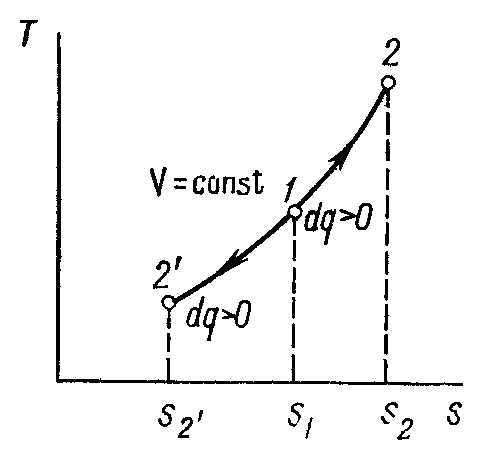
Рисунок 1 – Изохорный процесс в pv- иTS-диаграмме
Уравнение
изохоры имеет вид
![]() ,
(1)
,
(1)
Зависимость между начальными и конечными параметрами процесса выражается
![]() ,
(2)
,
(2)
Изменение внутренней энергииопределяется
![]() ,
(3)
,
(3)
Если в процессе участвует М, кг или Vн, м3газа, токоличество теплоты (изменение внутренней энергии газа)определяется
![]() ,
(4)
,
(4)
где
![]() - количество газа при нормальных условиях,
м3.
- количество газа при нормальных условиях,
м3.
Если количество теплоты необходимо подсчитать, пользуясь нелинейной зависимостью теплоёмкости от температуры, то применяют следующие формулы:
- количество теплоты, затрачиваемой для нагревания 1кг газа в интервале температур отt1доt2 при постоянном объёме
![]() ,
(5)
,
(5)
- если в процессе участвуют М, кг или Vн, м3газа, то
![]() ,
(6)
,
(6)
В изохорном процессе из-за отсутствия расширения газа работа L=0, и подводимая к газу теплота полностью идёт на изменение его внутренней энергии.
Изменение
энтропии в изохорном процессе ![]() (7)
(7)
Изобарный процесс (Р=const)
Изобарный процесс в pv-диаграмме изображается отрезком прямой 1-2, идущим параллельно оси абсцисс. Прямая 1-2 называетсяизобарой.
При направлении от точки 1 к точке 2 процесс идёт с сообщением теплоты. Работа в этом случае имеет положительное значение. При направлении от точки 2 к точке 1 – с отводом теплоты, и работа имеет отрицательное значение.
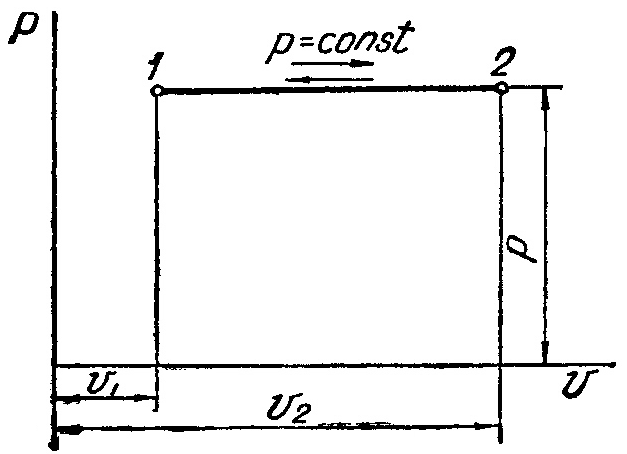
Рисунок 2 – Изобарный процесс в pv- иTS-диаграмме
Уравнение изобарыимеет вид![]() ,
(8)
,
(8)
Зависимость между начальными и конечными параметрами процесса выражается
![]() ,
(9)
,
(9)
Работа 1кг газаопределяется по формуле
![]() ,
(10)
,
(10)
или
![]() ,
(11)
,
(11)
Для М, кг газа работа определяется
![]() ,
(12)
,
(12)
или
![]() ,
(13)
,
(13)
где
![]() - количество газа при нормальных условиях,
м3.
- количество газа при нормальных условиях,
м3.
Если количество теплоты необходимо подсчитать, пользуясь нелинейной зависимостью теплоёмкости от температуры, то применяют формулы
![]() ,
(14)
,
(14)
- если в процессе участвуют М, кг или Vн, м3газа, то
![]() ,
(15)
,
(15)
Изменение внутренней энергииопределяется
![]() ,
(16)
,
(16)
Изменение энтропии в изобарном процессе
![]() (17)
(17)
3 Изотермический процесс (t=const)
Изотермический процесс в pv-диаграмме изображается равнобокой гиперболой 1-2, для которой координатные оси служат асимптотами. Гипербола 1-2 называетсяизотермой.
При направлении от точки 1 к точке 2 процесс идёт с сообщением теплоты. Работа в этом случае имеет положительное значение. При направлении от точки 2 к точке 1 – с отводом теплоты, и работа имеет отрицательное значение.
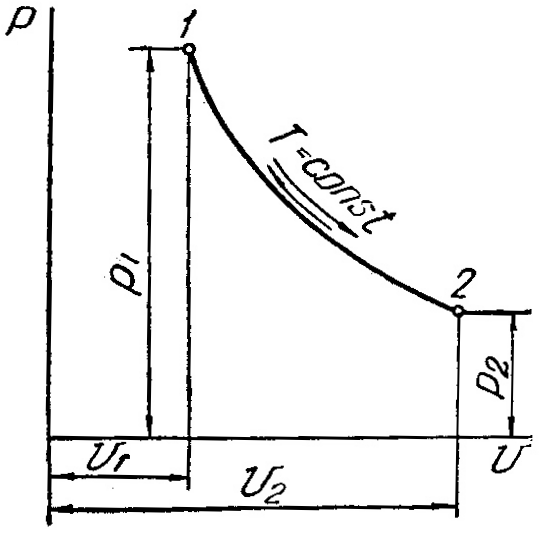
Рисунок 3 – Изотермический процесс в pv- иTS-диаграмме
Уравнение изотермыимеет вид![]() ,
(18)
,
(18)
Зависимость между начальными и конечными параметрами процесса выражается
![]() ,
(19)
,
(19)
Работа 1кг идеального газа определяется уравнениями
![]() ,
(20)
,
(20)
![]() ,
(21)
,
(21)
![]() ,
(22)
,
(22)
![]() ,
(23)
,
(23)
Так как в
изотермическом процессе t=const,
то изменение внутренней энергииопределяется![]() ,
(24)
,
(24)
Количество теплоты, сообщаемой газу или отнимаемой от него, определяется
![]() ,
(25)
,
(25)
для М, кг газа
![]() ,
(26)
,
(26)
Натуральный
логарифм, входящий в формулы, может быть
заменён десятичным по соотношению lgN= 2,303lgN.![]() (27)
(27)
Адиабатный процесс (dq=0)
Основным условием адиабатного процесса является полное отсутствие теплообмена между средой и рабочим телом (газом). Адиабатный процесс в pv-диаграмме изображается неравнобокой гиперболой 1-2, не пересекающую координатных осей. Гипербола называетсяадиабатой.Адиабата располагается круче изотермы.
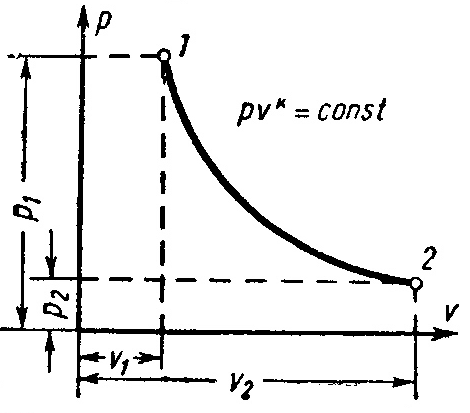
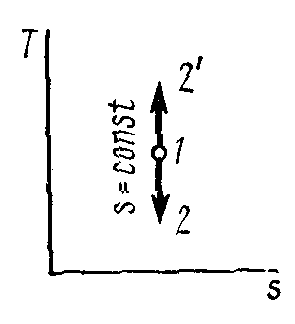
Рисунок 4 – Адиабатный процесс в pv- иTS-диаграмме
Уравнение адиабатыимеет вид![]() ,
где
,
где![]() - показатель адиабаты. (28)
- показатель адиабаты. (28)
Зависимость между начальными и конечными параметрами процесса:
между pиv
![]() ,
(29)
,
(29)
между Т и v
![]() ,
(30)
,
(30)
между pиT
![]() ,
(31)
,
(31)
Работа 1кг газаопределяется по следующим формулам
![]() ,
(32)
,
(32)
![]() ,
(33)
,
(33)
![]() ,
(34)
,
(34)
![]() ,
(35)
,
(35)
Уравнение первого закона термодинамики для адиабатного процессаимеет вид
![]() ,
(36)
,
(36)
![]() ,
(37)
,
(37)
Изменение внутренней энергии газа и работа адиабатного процесса равны по величине и противоположны по знаку.
Изменение энтропии в адиабатном процессе
![]() ,
s=const
(38)
,
s=const
(38)
