
- •Кафедра «Теплоэнергетика»
- •Краткий курс лекций
- •5В071700 - «Теплоэнергетика» направление – «Бакалавриат»
- •Лекция № 1. Тема: основные определения термодинамики.
- •Предмет и метод термодинамики
- •Принцип построения термодинамики
- •Основные понятия и определения термодинамики
- •Лекция № 2. Тема: параметры состояния тела.
- •В настоящее время применяют различные температурные шкалы-Цельсия. Реомюра, Фаренгейта, Ренкина, соотношения между которыми приводятся в таблице 2.3
- •Лекция № 3. Тема: идеальный газ. Основные газовые законы.
- •Лекция № 4. Тема: смеси идеальных газов.
- •Лекция № 5. Тема: теплоемкость газов.
- •Теплоемкость газовой смеси
- •Лекция № 6. Тема: первый закон термодинамики. Внутренняя энергия
- •Теплота
- •Первый закон термодинамики
- •Закон сохранения и превращения энергии :
- •Формулировка и уравнение первого закона термодинамики
- •Энтальпия газов
- •Лекция № 7 Тема: основные термодинамические процессы. Основными термодинамическими процессами являются:
- •Метод исследования процессов состоит в следующем:
- •Политропный процесс ()
- •Тема: второй закон термодинамики.
- •Энтропия идеального газа
- •Тепловая диаграмма (ts-диаграмма)
- •Лекция № 9 Тема: водяной пар. Процессы водяного пара. Уравнение состояния реального газа
- •Водяной пар
- •Сухой насыщенный пар
- •Влажный насыщенный пар
- •Перегретый пар
- •Энтропия пара
- •Лекция № 10 Тема: влажный воздух.
- •Изображение адиабатного процесса
- •Изобарный процесс водяного пара
- •Цикл Карно. Теорема Карно
- •Теорема Карно
- •Лекция № 12. Уравнение первого закона термодинамики для потока. Истечение газов и паров. Дросселирование.
- •Лекция № 13 Тема: циклы поршневых компрессоров, двс, гту.
- •Теоретическая мощность двигателя для привода компрессора
- •Теоретические циклы поршневых двигателей внутреннего сгорания
- •Циклы газотурбинных установок
- •Лекция № 14
- •1 Паросиловой цикл Ренкина
- •2 Теплофикационный цикл
- •3Регенеративный цикл
- •4 Цикл воздушной холодильной установки
- •Лекция № 15
Политропный процесс ()
Политропным процессомописывается любой закономерный процесс или совокупность отдельных закономерных процессов.
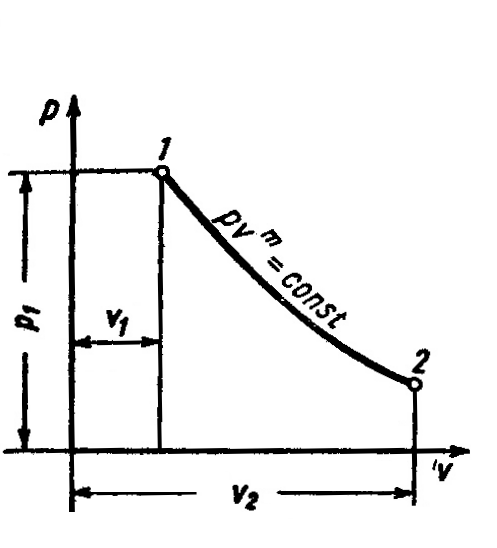
Рисунок 5 – Политропный процесс в pv- диаграмме
Уравнение политропы при постоянной теплоёмкости имеет вид
![]() ,
(39)
,
(39)
где m- показатель политропы.
Характеристикой политропного процесса является величина
![]() ,
(40)
,
(40)
где
![]() .
.
По величине показателя политропы mможно определить её относительное расположение вpv-диграмме и выяснить характер процесса, т.е. есть ли подвод или отвод теплоты, увеличение или уменьшение внутренней энергии газа.
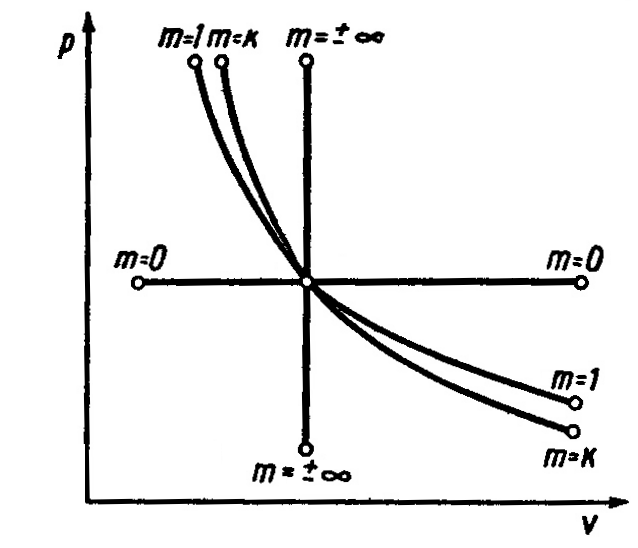
Для процессов расширения:
1) m>1– теплота подводится(q>0),внутренняя энергия газа увеличивается
(![]() >0);
>0);
2) к>m>1– теплота подводится(q>0),внутренняя энергия газа уменьшается
(![]() <0);
<0);
3) m>к– теплота отводится(q<0),внутренняя энергия газа уменьшается(![]() <0).
<0).
Для процессов сжатия:
1) m<1– теплота отводится, внутренняя энергия газа уменьшается;
2) к>m>1– теплота отводится, внутренняя энергия газа увеличивается;
3) m>к– теплота подводится, внутренняя энергия газа увеличивается.
Зависимость между начальными и конечными параметрами процесса:
между pиv
![]() ,
(41)
,
(41)
между Т и v
![]() ,
(42)
,
(42)
между pиT
![]() ,
(43)
,
(43)
Работа 1кг газаопределяется по следующим формулам
![]() ,
(44)
,
(44)
![]() ,
(45)
,
(45)
![]() ,
(46)
,
(46)
![]() ,
(47)
,
(47)
Если количество
теплоты, участвующей в процессе, известно,
то работа может быть определена
![]() ,
(48)
,
(48)
Теплоёмкость
политропного процессаопределяется![]() ,
(49)
,
(49)
Количество теплоты, сообщаемой газу или отнимаемой от него, определяется
![]() ,
(50)
,
(50)
Изменение внутренней энергии газаопределяется
![]() ,
(51)
,
(51)
![]() ,
(52)
,
(52)
![]() ,
(53)
,
(53)
Показатель
политропного процессаопределяется![]() ,
(54)
,
(54)
Изменение энтропии в политропном процессе
s2 –s1 = c ln T2 / T1 , где c = cv [ (m-k) / (m-1) ] (55)
ЛЕКЦИЯ № 8
Тема: второй закон термодинамики.
Первым законом термодинамики устанавливается:
1. эквивалентность взаимных превращений тепла и работы и, следовательно, количественные отношения между теплом и работой при этих превращениях;
2. постоянство энергии изолированной термодинамической системы;
3. взаимная связь между теплом, внутренней энергии системы и работой изменения объёма, совершаемой ею или совершаемой над ней окружающей средой.
Первый закон термодинамикихарактеризует процессы превращения энергии сколичественнойстороны.
Второй закон термодинамикихарактеризуеткачественную сторону этих процессов.
Первый закон ТД утверждает, что в природе теплота и работа эквивалентны и взаимопревращаемы. Но из первого закона ТД не указаны условия, при которых эти превращения теплоты и работы возможны, так как не все процессы в природе осуществимы. Например,Iзакон ТД не определяет направление переноса теплоты и не отвечает на вопрос- вся ли теплота переходит в работу или только какая – то ее часть и т.д.
Из опыта следует, что теплота переходит самопроизвольно только от более нагретого тела к менее нагретому, и работу можно превращать в теплоту, но не наоборот. Поэтому, между преобразованием теплоты в работу и наоборот, работы в теплоту существует различие.
В.Томсон (лорд Кельвин) предложил в 1851 г. следующую формулировку: невозможно при помощи неодушевленного материального агента получить от какой-либо массы вещества механическую работу посредством охлаждения ее ниже температуры самого холодного из окружающих предметов.
М.Планк предложил формулировку более четкую, чем формулировка Томсона: невозможно построить периодически действующую машину, все действие которой сводилось бы к понятию некоторого груза и охлаждению теплового источника. Под периодически действующей машиной следует понимать двигатель, непрерывно (в циклическом процессе) превращающий теплоту в работу. В самом деле, если бы удалось построить тепловой двигатель, который просто отбирал бы теплоту от некоторого источника и непрерывно (циклично) превращал его в работу, то это противоречило бы положению о том, что работа может производиться системой только тогда, когда в этой системе отсутствует равновесие (в частности, применительно к тепловому двигателю – когда в системе имеется разность температур горячего и холодного источников).
Второй закон термодинамики указывает направление передачи теплоты, а также ее долю, которую возможно перевести в работу.
В 1850 году Р. Клаузиус дал следующую формулировку IIзакона ТД:«Теплота не может переходить от холодного тела к более нагретому сама собой».
В 1851 году У. Томсон дал другую формулировку IIзакона ТД:Не вся теплота, полученная от теплоотдатчика, может перейти в работу, а только некоторая её часть. Другая её часть неизбежно должна перейти в теплоприёмник».
В 1892 году В. Оствальд сформулировал IIзакон ТД так:«Осуществление вечного двигателя второго рода невозможно».
Если обобщить все формулировки, то получим следующую формулировку IIзакона ТД:«Любой реальный процесс является необратимым».
Следовательно, для существования теплового двигателя необходимо наличие теплоотдатчика (горячего источника), рабочего тела и теплоприемника (холодного источника).
Второй закон термодинамики определяет:
- направление, в котором протекают процессы;
- устанавливает условия преобразования тепловой энергии в механическую;
- определяет максимальное значение работы, которая может быть произведена тепловым двигателем.
МатематическиIIзакон ТД записывается
в виде:![]() ,
(1)
,
(1)
где
![]() - бесконечно малое приращение энтропии
системы;
- бесконечно малое приращение энтропии
системы;
![]() - бесконечно малое
количество теплоты, полученной системой
от источника теплоты;
- бесконечно малое
количество теплоты, полученной системой
от источника теплоты;
![]() - абсолютная температура источника
теплоты.
- абсолютная температура источника
теплоты.
Знак «>» соответствует необратимым процессам.
Знак «=» соответствует обратимым процессам.
Аналитически
IIзакон ТД имеет вид:![]() или
или![]() (2)
(2)
