
Клиническая стоматология 2004-2 / Биоматериалы для тканевой инженерии и хирургической стоматологии Часть 2
.docБиоматериалы для тканевой инженерии
и хирургической стоматологии
Часть 2
Панасюк А.Ф., д-р биологических наук, зам. директора по научной работе,
ООО «Конектбиофарм»
Саващук Д. А., директор ООО «Конектбиофарм» г. Москва.
Ларионов Е.В., зам. директора по развитию, ООО «Конектбиофарм»
Кравец В.М., руководитель проекта ЗАО «Бруквуд»
З а
счет каких же механизмов это может
происходить? Известно, что в норме
сульфатированные гликозаминогликаны
(сГАГ) практически отсутствуют в свободном
виде. При патологических состояниях,
когда матрикс подвергается разрушению,
идет высвобождение сГАГ и они способны
проявлять свои уникальные свойства.
Именно в свободном состоянии сГАГ
оказывают влияние на многие показатели
обмена соединительной ткани (СТ). Как
показано в экспериментальных и клинических
исследованиях сГАГ снижают активность
протеолитических ферментов, подавляют
синергическое разрушительное действие
на межклеточный матрикс этих ферментов
и кислородных радикалов, блокируют
синтез медиаторов воспаления за счет
маскировки антигенных детерминант
и отмены хемотаксиса, предотвращают
апоптоз клеток, индуцированный
повреждающими факторами, а также
угнетают синтез липидов и с помощью
этого механизма препятствуют процессам
деградации ткани (Панасюк А.Ф., Ларионов
Е.В., 2000, Wendel
M.,
Sommarin
Y.,
1998).
а
счет каких же механизмов это может
происходить? Известно, что в норме
сульфатированные гликозаминогликаны
(сГАГ) практически отсутствуют в свободном
виде. При патологических состояниях,
когда матрикс подвергается разрушению,
идет высвобождение сГАГ и они способны
проявлять свои уникальные свойства.
Именно в свободном состоянии сГАГ
оказывают влияние на многие показатели
обмена соединительной ткани (СТ). Как
показано в экспериментальных и клинических
исследованиях сГАГ снижают активность
протеолитических ферментов, подавляют
синергическое разрушительное действие
на межклеточный матрикс этих ферментов
и кислородных радикалов, блокируют
синтез медиаторов воспаления за счет
маскировки антигенных детерминант
и отмены хемотаксиса, предотвращают
апоптоз клеток, индуцированный
повреждающими факторами, а также
угнетают синтез липидов и с помощью
этого механизма препятствуют процессам
деградации ткани (Панасюк А.Ф., Ларионов
Е.В., 2000, Wendel
M.,
Sommarin
Y.,
1998).
Одновременно эти соединения способны принимать непосредственное участие в построении коллагеновых волокон и межклеточного матрикса в целом, стимулировать пролиферацию хондроцитов и других клеток СТ, повышать их биосинтетическую активность и улучшать сосудистую микроциркуляцию непосредственно в СТ. Кроме того, на ранних этапах повреждения они выступают как инициаторы создания в СТ временного матрикса. Этот феномен реально имеет очень важное значение потому, что позволяет приостановить как распад СТ, так и формирование грубого рубца. В дальнейшем именно последнее и обеспечивает более быстрое замещение рубцовой ткани на обычную, для данного органа СТ.
К сожалению, имеющаяся в литературе информация о роли этих соединений в обмене СТ относится главным образом к хрящевой ткани. С другой стороны, описанные выше свойства этих соединений, скорее всего, универсальны для СТ в целом и поэтому нет серьезных оснований считать, что реализация свойств сГАГ в костной ткани будет иметь качественные отличия от других видов СТ. Действительно, роль сГАГ в регуляции остеогенеза должна быть очень значительна. Подтверждением этому служит ряд данных, имеющихся в литературе.
Так, по мнению А.Я. Фриденштейна основным претендентом на роль индуктора эктопического остеогенеза в модельной системе является мукополисахарид (в современной терминологии протеогликан), секретируемый эпителием мочевого пузыря. К такому же заключению приходит и Г. И. Лавришева, считая, что протеогликаны могут быть включены в контроль микроокружения над гемопоэзом и другими гистогенезами производных мезенхимы и костной ткани в частности. (Фриденштейн А.Я., Лалыкина К.С., 1973; Лаврищева Г.И., Оноприенко Г.А., 1996).
Следовательно, остеоиндуктивные свойства практически всех биокомпозиционных материалов обеспечиваются входящими в их состав либо клетками, либо биоактивными компонентами. Например, это могут быть клетки костного мозга, фибробласты, тромбоциты и/или морфогенетические белки, факторы роста, гормоны, а также другие биоактивные субстанции (Drivdahl R. Н. et.al., 1982; Aspenberg P. et.al., 1991; Ripamonti U. et.al., 1992; Cook S.D. et.al., 1994; Brown R. et.al, 1997; Reddi A.H., 1998; Bruder S.,1998). В нативном костном матриксе свойство индукции костеобразования, как показал Urist М, принадлежит морфогенетическим белкам, способным направленно влиять на дифферен-цировку остеогенных клеток предшественников мезенхимальной ткани (Urist M, 1965, 1983, 1989; Хэм А, Кормак Д., 1983).
Учитывая эти обстоятельства , и то, что восстановление костной ткани в организме реципиента должно происходить как за счет структуры и свойств трансплантата или имплантата, так и за счет активации собственных клеточных элементов организма и усиления регенерации ткани в целом.
Фирмой ООО «Конектбиофарм», был разработан ряд биокомпозиционных материалов на основе костного коллагена и костных сГАГ животных и человека. При этом, следуя стратегии и принципам современной ТИ, разработка этих материалов велась в соответствии с общими требованиями к такого рода продукции, которая должна иметь низкую антигенность и высокие показатели биосовместимости, а также быть безопасной и эффективной при воздействия на ткани мишени (Bruck S.D., Mueller Е.Р., 1989; Friess W.,1998; Vacanti C.A., Pins G., 1992).
Разработанные фирмой ООО «Конектбиофарм» материалы для восстановления костных дефектов на основе костного коллагена и костных сГАГ, защищены патентами и товарными знаками РФ. В настоящее время они представлены следующей группой биоматериалов:
1. «Биоматрикс»® костный ксеноколлаген и костные сГАГ,
2. «Алломатрикс-имплант»® содержащий костный аллоколлаген и костные алло сГАГ,
3. «Остеомарикс»® - биокомпозиция на основе природных костных компонентов: ксено- или аллоколлагена, сГАГ и ГА.
Материалы «Алломатрикс-имплант»® и «Остеоматрикс»® были разработаны фирмой ООО «Конектбиофарм» совместно с ГУН ЦИТО им. Н. Н. Приорова.
Проведенными нами исследованиями по изучению свойств данных материалов было установлено, что полученный по оригинальной технологии костный коллаген из губчатой кости человека и животных сохраняет свои основные природные характеристики, такие как низкая растворимость, высокая эластичность и естественная пористость.
Сохранность костной структуры в материалах, после проведения всех технологических процедур по их получению, была изучена нами с помощью сканирующей электронной техники на микроскопе Cambrige StereoScan (Англия).
На электроннограмме видно, что препараты костного коллагена представляют из себя сеть упорядоченно расположенных пучков и волокон. При этом сами волокна плотно упакованы в пучки второго порядка, без разрывов и дефектов. По своему виду материал имеет классическую пористо-ячеистую структуру, которая полностью соответствует архитектонике нативной губчатой кости и свободна от сосудов, белков, механических и иных включений. Размер пор колеблется от 220 до 700 мкм.
Биосовместимость костного коллагена была оценена нами по стандартным тестам в условиях имплантации их под кожу крысам породы Вистар. С помощью гистоморфологического анализа и сканирущей электронной микроскопии было установлено, что костный коллаген после полуторамесячного пребывания в организме реципиента практически не подвергается разрушению и сохраняет свою структуру. Как видно на рисунке 2 поры, трабекулы и ячейки имплантированного костного коллагена частично заполняются рыхлой волокнистой СТ, волокна которой слабо спаяны с им-плантатом. Хорошо видно, что вокруг него формируется незначительный фиброзный слой, а в самом имплантате отмечается присутствие небольшого количества клеточных элементов, основными из которых являются фибробласты. Характерно, что имплантат практически на всем своем протяжении не спаян с окружающей тканью дермы. Эти результаты однозначно свидетельствуют о высокой устойчивости данного материала к биораспаду и о полной биоинертности в отношении него окружающей СТ.

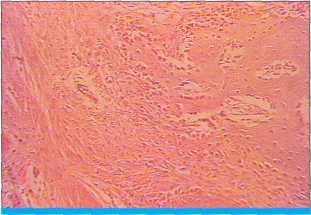
Рис. 2. Сканирующая электронная Рис. 3. Гистологическая картина
микрограмма. Поперечный срез через материала через 2 месяца после операции.
1,5 месяца после операции Активный остеогенез проксимальной
части костного дефекта
Исследования по влиянию материалов «Биоматрикс»®, «Алломатрикс-имплант»® и «Остеоматрикс»® на остеорепарацию мы провели на модели сегментарной остеотомии по общепринятым методикам (Katthagen B.D., Mittelmeeir H., 1984; Schwarz N. et.al.,1991).
В эксперименте были использованы кролики породы Шиншилла массой 1,5—2,0 кг, которым под внутривенным наркозом делали сегментарную остеотомию лучевой кости.
Через два месяца после операции в зоне имплантации было отмечено формирование новой костной ткани. На рисунке 3 результат гистоморфологического исследования материала «Алломатрикс-имплант»® через 2 мес. после операции. В проксимальной зоне дефекта видна хорошо развитая молодая костная ткань. Остеобласты прилежат к костным балкам в большом числе.
В межуточном веществе обнаруживаются остеоциты в лакунах. В новом костном веществе формируются плотно упакованные коллагеновые волокна. Хорошо развито межуточное вещество с активными клетками. Зона имплантата (сверху и слева) активно перестраивается.
В общем, идет более ускоренное созревания костной ткани вокруг зоны имплантата.
Кроме того, оказалось, что пористоячеистая структура костного коллагена обеспечивает не только поддержание объема в дефекте за счет своих упругоэластических качеств, но и оптимальную возможность для врастания в него клеток СТ, развития сосудов и формирования кости при замещении этого дефекта.
Так, например, через 2 месяца после имплантации материала «Алломатрикс-имплант»* большинство пор имплантата заполнены бесклеточным тонковолокнистым материалом, в ряде пор выявляли сформированные сосуды (внизу слева). Стенка сосуда плотная, внутри сосуда видны форменные элементы крови - эритроциты. Коллагеновые волокна имплантата уплотнены, без явлений деструкции (рис. 4).
Очень важным свойством имплантируемого остеопластического материала является его способность индуцировать развитие сосудов потому, что именно оно потенциально определяет его остеоиндуктивные потенции.
Биопластический материал «Биоматрикс»® представляет из себя высо- коочищенный коллаген губчатой кости быка или свиньи и содержит суммарную фракцию костных сГАГ. Он имеет естественную пористость, присущую нативной кости, и изготовляется в виде блоков пластин и дисков. «Биоматрикс»® нетоксичен, обладает хорошей биосовместимостью, с его помощью можно моделировать любую форму костного дефекта, что было доказано нами в экспериментах на животных. Наряду с хорошими остекондуктивными характеристиками «Биоматрикс»* обладает и выраженными остеоиндуктивными свойствами. В условиях in vitro блоки материала «Биоматрикс»* имеют высокую степень устойчивости к растворам кислот и щелочей, а в условиях in vivo и к биораспаду.
Обладая хорошей биосовместимостью, костный коллаген с костными сГАГ имеет высокое сродство с костным ложем реципиента. Проведенные исследования токсикологических показателей данных материалов показали, что они безопасны и соответствуют всем требованиям, предъявляемым к изделиям медицинского назначения.
Р азработанный
в соответствии с принципами ТИ и являясь
в настоящее время уникальным материалом
«Биоматрикс»8
может служить хорошим носителем и
для клеток СТ, и для молекул биоактивных
веществ, таких как морфогенетические
белки, факторы роста, антибиотики и
т.д. Так, было показано, что при переносе
стромальных клеток предшественников,
выращенных в монослойной культуре
костного мозга, на материалах,
содержащих костные коллаген и сГАГ, в
зоне имплантации происходит формирование
эктопической кости с костным мозгом,
что однозначно доказывает
остеоиндуктивные свойства использованного
материала (Иванов СЮ. и соавт., 2001).
азработанный
в соответствии с принципами ТИ и являясь
в настоящее время уникальным материалом
«Биоматрикс»8
может служить хорошим носителем и
для клеток СТ, и для молекул биоактивных
веществ, таких как морфогенетические
белки, факторы роста, антибиотики и
т.д. Так, было показано, что при переносе
стромальных клеток предшественников,
выращенных в монослойной культуре
костного мозга, на материалах,
содержащих костные коллаген и сГАГ, в
зоне имплантации происходит формирование
эктопической кости с костным мозгом,
что однозначно доказывает
остеоиндуктивные свойства использованного
материала (Иванов СЮ. и соавт., 2001).
Рис. 4. Сканирующая электронная микрограмма. Видна пластинчатая упаковка коллагеновых волокон имплантата. Напыление золотом. Увеличение в 12 000 раз
Проведенные клинические исследования материала «Биоматрикс»® показали, что он обладает выраженным действием на процессы регенерации костной ткани без явлений воспаления и фиброза в зоне имплантации (Панин A.M. 2003). Данный материал уже зарекомендовал себя с хорошей стороны при стоматологических операциях и, в частности, при заполнении костных карманов, при синуслифтинге и пластике альвеолярньгх отростков челюстей при дентальной имплантации (Иванов СЮ. 2003, Панин А. М. 2003). Получены первые положительные результаты и по применению материала «Биоматрикс»® в качестве разобщающей биорезорбируемой мембраны для обеспечения эффективной остеоинтеграции (Панин А. М. 2003).
Расширяя возможности применения в клинической практике биоматериалов на основе костного коллагена, нами был разработан материал «Алломатрикс-имплант»®, содержащий аллоколлаген и алло сГАГ. Одним из важных преимуществ этого материла перед «Биоматриксом»® является его источник - донорская костная ткань человека. По всем другим показателям эти материалы имеют сходные характеристики. Как и в случае применения материала «Биоматрикс»®, материал «Алломатрикс-имплант»® хорошо удерживает объем и способен заполнить весь костный дефект. Его пористость обеспечивает проникновение в него клеток СТ и прорастание сосудов. При переносе на нем стромальных клеток предшественников в зонах имплантации в подпочечную капсулу происходит формирование эктопической кости (Иванов СЮ. и соавт., 2001).
Применение материала «Алломатрикс-имплант»® в клинике также продемонстрировало его выраженное действие на остеорепарацию. При этом в постоперационном периоде в зонах имплантации ни в одном исследованном случае не отмечалось явлений воспаления или фиброза. Так, при пластике альвеолярных отростков челюстей при пародонтальных операциях удалось установить, что материал обладает высокой биосовместимостью, оптимизирует процессы репаративной регенерации в области хирургического вмешательства в большей степени, чем проведение традиционной лоскутной операции. Материал обладает противовоспалительным действием, которое выявляется по результатам цитофотометрии. Наиболее высокой эффективностью биокомпозиционный материал «Алломатрикс-имплант»® обладает при устранении трехстеночных костных дефектов (Грудянов А. И. 2003).
Однако, при всех своих достоинствах материалы «Биоматрикс»® и «Алломатрикс-имплант»® имеют один существенный недостаток - они не обладают необходимым показателем прочности, характерным для нативной костной ткани.
Известно, что прочность кости связана с наличием в её составе ГА. Обычно при изготовлении биопластических материалов ГА удаляется из костной ткани для того, чтобы при имплантации были доступны биоактивные молекулы данной ткани. С другой стороны, если готовятся материалы природного ГА, (например BioOss Geistlich Biomaterials Swiss), то они как правило достаточно хрупки и их прочностные характеристики значительно меньше, чем у костного коллагена. Следовательно, прочность костной ткани в первую очередь зависит от структурного взаимодействия обоих её компонентов и коллагена, и ГА.
Для решения этой проблемы фирмой ООО «Конектбиофарм» совместно с ГУН ЦИТО им. Н.Н. Приорова был разработан биокомпозиционный материал нового поколения «Остеоматрикс»®. В состав данного материала кроме костных коллагена и сГАГ входит и природный ГА человека или свиньи. Материал «Остеоматрикс»'* также как и две предыдущие формы имеет пористую структуру близкую к нативной костной ткани, но в отличии от них он обладает высокими показателями прочности и в нем сохранена архитектоника не только коллагеновой составляющей, но и ГА. Последнее качество материала «Остеоматрикс»® является серьезным преимуществом и обуславливает его более выраженные остеогенные потенции.
Действие данного материала на репарацию костных дефектов было четко доказано в эксперименте на модели восстановления сегментарного дефекта лучевой кости у животных. Было найдено, что через 2 мес. после имплантации материала в зоне дефекта формируется костная мозоль. Имплантированный материал, хотя и подвергается частичной деструкции, но при этом он активно замещается молодой костной тканью без фиброзного перерождения (рис. 4). По сравнению с группой контрольньгх животных костная мозоль в опыте формируется быстрее и, как правило, выполняет больший объем дефекта.
В клинической практике материал «Остеоматрикс»® был успешно применен при заполнении костных дефектов после удаления кист и сложных зубов. Было показано, что при использовании материала «Остеоматрикс»® костные дефекты на сроке через 3 месяца после операции заполняются молодой костной тканью (Ленина С.А. и соавт. 2003). В клинике ЦИТО материал «Остеоматрикс»® был использован при пластике больших костных дефектов после удаления кист, хондром, неврогенной опухоли, хронического воспалительного процесса. Анализ результата через 6 месяцев после операции показал, что у всех больных места, куда помещался «Остеоматрикс»® по плотности рентгеновского изображения были не отличимы от окружающей губчатой костной ткани. Результаты проведенного исследования свидетельствуют о том, что биокомпозиционный материал «Остеоматрикс»® при помещении его в костный дефект активно влияет на построение костной ткани на месте бывшего очага поражения у больных с разными видами костной патологии. При этом каких либо воспалительных реакций на имплантацию не наблюдается, что указывает на низкую антигенность и высокую степень биоинтеграции в ткани реципиента.
Авторы показали, что «Остеоматрикс»® является перспективным био- композиционным материалом, способным стимулировать репарацию костной ткани, обеспечивая ее быстрое восстановление (Лекишвили М. В. 2002).
Таким образом, приведенные выше экспериментальные и клинические результаты показывают, что, базируясь на современных принципах ТИ, фирмой ООО «Конектбиофарм» совместно с ГУН ЦИТО им. Н.Н. Приорова был разработан и внедрен в клиническую практику ряд композиционных биоматериалов нового поколения на основе костных коллагенов, сульфатированных гликозаминогликанов и гидроксиапатита. Эти современные, эффективные и безопасные биоматериалы открывают широкие перспективы к решению многих проблем восстановления костной ткани не только в хирургической стоматологии и челюстно-лицевой хирургии, но и в травматологии и ортопедии.
Список литературы находится в редакции.
