
- •Методические указания по химии к лабораторным работам и самостоятельной работе для студентов нехимических специальностей всех форм обучения и направления
- •Введение
- •Основные правила по технике безопасности при работе в химической лаборатории
- •Правила пожарной безопасности
- •Экспериментальная часть
- •3. Вопросы для самоконтроля
- •Лабораторная работа № 2 замерзание растворов
- •Теоретическая часть
- •2. Экспериментальная часть
- •Вопросы для самоконтроля
- •Лабораторная работа № 3 титриметрический метод анализа
- •Теоретическая часть
- •Техника приготовления растворов в мерных колбах из фиксаналов.
- •Порядок работы с бюреткой
- •Экспериментальная часть
- •Вопросы для самоконтроля
- •Приложение
- •Лабораторная работа № 4 адсорбция уксусной кислоты на поверхности активированного угля
- •Теоретическая часть
- •2.Экспериментальная часть
- •Вопросы для самоконтроля
- •Лабораторная работа № 5 коллоидные растворы
- •Теоретическая часть
- •Экспериментальная часть
- •Вопросы для самоконтроля
2. Экспериментальная часть
Задание выполняется на установке, которая представлена на рисунке 1.
В кристаллизаторе 1 приготовьте охлаждающую смесь, состоящую из снега и поваренной соли: 3-5 чайных ложек соли на 5-8 ложек снега.
В стакан 3 налейте 5 -6 мл дистиллированной воды и поместите его в охлаждающую смесь.
Помешивая воду термометром (осторожно, чтобы не разбить термометр), определите температуру замерзания воды. Температурой замерзания считать ту, которую покажет термометр после появления первого кристаллика льда в замораживаемой жидкости.
Аналогично определите температуру замерзания 1 и 2 раствора выданной преподавателем соли. Результаты запишите в таблицу 1.
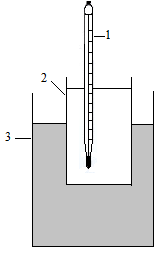
Рис. 1. Схема установки для определения температуры замерзания:
1 - термометр; 2 - стакан с водой или раствором; 3 - охлаждающая смесь.
Таблица 1
|
Система |
tзам |
Δtзам |
Изотонический коэффициент i |
Степень диссоциации α |
|
H2O |
|
- |
- |
- |
|
С1, моляльный раствор |
|
|
|
|
|
С2, моляльный раствор |
|
|
|
|
Рассчитайте изотонический коэффициент i. используя формулу
Δtзам = i∙K∙Cm ,
Δtзам = tзам( р-ля) - tзам( р-ра)
K- криоскопическая константа растворителя, К(H2O)=1,86
Cm- моляльность раствора
По
полученным данным рассчитайте степень
диссоциации раствора KCl
в воде по формуле: α =
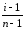
n – число ионов, на которые распадается данная молекула.
Постройте график зависимости температуры замерзания раствора от концентрации растворенной соли.
Сделайте выводы:
Сравните температуру замерзания растворителя и растворов, сравните температуру замерзания двух растворов разной концентрации;
Сравните степени диссоциации двух растворов разной концентрации.
Вопросы для самоконтроля
Вычислить понижение температуры замерзания раствора, если в 550 г бензола растворили 60 г гексана (C6H14), криоскопическая постоянная бензола - Ккр=5,07 К·кг/моль.
Вычислить повышение температуры кипения раствора, если в 320 г воды растворить 15 г этанола (C2H5OН), эбулиоскопическая постоянная воды –Кэб= 0,52 К·кг/моль.
Вычислить молярную массу этанола, если при растворении в 550 г воды 65 г этанола понижение температуры замерзания раствора составило 4,78ºC, криоскопическая постоянная воды - Ккр=1,86 К·кг/моль.
Вычислить осмотическое давление раствора при температуре 26ºC, если в 1 литре раствора содержится 140 г глюкозы.
При растворении в 850 г воды 25 г сульфата марганца экспериментальное значение повышения температуры кипения раствора составило 0,18ºC, эбулиоскопическая постоянная воды – Кэб =0,52 К·кг/моль. Вычислить степень диссоциации сульфата марганца.
Лабораторная работа № 3 титриметрический метод анализа
Цель работы: приобретение навыков в применении одного из методов количественного анализа – титриметрического, и обучение элементарным приемам статистической обработки результатов измерений.
