
метода по химии 1 часть
.pdf
41
|
|
|
|
|
|
|
|
|
|
H+, - H2O |
||||||
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
CH3 |
CH OH |
C2H5 |
OH |
CH3 |
|
CH OC2H5 |
||||||||||
|
|
|||||||||||||||
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
OC2H5 |
|
|
|
|
|
|
OC2H5 |
|||||||
Образование полуацеталей и ацеталей имеет большое значение в химии углеводов: моно-, ди- и полисахаридов. Циклическая форма моносахаридов строится по принципу полуацеталей. Связь между моносахаридами в ди – и полисахаридах – ацетальная. В виде ацеталей происходит выделение из организма чужеродных соединений. Так глюкуроновая кислота (циклический полуацеталь) образует с фенолом ацеталь и в таком виде выводит его.
6. Реакция с водой (гидратация). Альдегиды и в значительно меньшей степени кетоны обратимо присоединяют воду:
|
-O |
|
OH |
|
|
|
|
Н+ |
H |
CH3 |
C H |
+ H2O |
C |
|
CH3 |
|
|||
|
+ |
|
|
|
OH
Полученный двухатомный спирт (диол) неустойчив. Прочность связывания воды, т.е. степень гидратации, зависит от строения и характера радикала в различных альдегидах. Например, трихлоруксусный альдегид (хлораль) хорошо гидратируется благодаря присутствию в радикале трех атомов хлора.
Cl |
O |
|
|
Cl |
OH |
|
|||||||
|
|
|
|
|
|
|
|
|
|||||
|
|
C |
|
H + Н-ОН |
Н+ |
|
|
|
|
|
H |
||
Cl C |
|
|
Cl |
|
C |
|
C |
|
|||||
|
|
|
|
|
|||||||||
|
|
|
|
||||||||||
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
Cl |
OH |
|
|||||
|
|
|
|
|
|
хлоральгидрат |
|
||||||
Хлоральгидрат – один из немногочисленных примеров прочных гидратов альдегидов. Хлоральгидрат – лекарственный препарат снотворного и противосудорожного действия. Галогены усиливают снотворное действие, а гидратация уменьшает токсичность.
II. Реакции за счет -СН2-звена
1. Галогенирование: |
|
|
|
|
CH3-CH2-C=O + Cl2 |
CH3- |
|
CH-C=O |
|
|
||||
H |
-HCl |
|
|
H |
|
||||
Cl |
||||
2. Реакция альдольной конденсации обусловлена подвижностью водорода в -положении в радикале и осуществляется в присутствии разбавленных щелочей. Ее можно рассматривать как реакцию нуклеофильного присоединения одной молекулы альдегида к другой:
+ |
- |
|
H |
OH- 5 4 |
OH |
|||||
|
|
|
|
3 2 1 |
||||||
CH3-CH2-C=O + CH |
|
|
|
|
|
|
||||
3 |
- CH - C =O |
CH -CH -CH-CH-C=O |
||||||||
|
|
|
|
|
|
3 |
2 |
|
|
|
H |
|
|
|
H |
|
|
|
H |
||
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
CH3 |
|
2-метил-3- гидроксипентаналь

42
Поскольку продукт реакции содержит в молекуле гидроксильную (-ол) и альдегидную (-аль) группы, его называют альдоль, а сама реакция получила название альдольной конденсации. Реакции этого типа имеют место в природе, например биосинтез лимонной кислоты в цикле трикарбоновых кислот, нейраминовой кислоты и т. д.
III. Реакции, характерные только для альдегидов
1.Реакция окисления. Она осуществляется за счет водорода альдегидной группы
ипротекает очень легко. Кетоны при действии этих окислителей инертны. Их окисление осуществляется только сильными окислителями и сопровождается разрывом углеродуглеродных связей. Если в качестве окислителей используют мягкие окислители – оксид серебра и гидроксид меди (II) - имеют место качественные реакции на альдегидную группу. Реакция с оксидом серебра называется реакцией «серебряного зеркала»:
O |
NH3 t° |
O |
||||
|
|
|
|
|
|
|
CH3-C-H + Ag2O |
|
CH3-C-OH +2Ag |
||||
Оксид серебра готовят перед опытом и используют в виде аммиачного раствора, представляющего собой комплексное соединение Ag (NH3)2OH (реактив Толленса).
O |
t° |
O |
||||
|
|
|
|
|
|
|
CH3-C-H + 2Cu(OH)2 |
|
CH3-C-OH + 2СuOH + Н2О |
||||
|
|
|
|
|
|
желтый |
|
|
|
|
|
|
гидроксид |
|
|
|
|
|
|
меди (I) |
t°
2 CuOH  Cu2O + H2O
Cu2O + H2O
красный
оксид меди (I)
2. Полимеризация. При длительном хранении формалина, представляющего собой 40 % водный раствор формальдегида, образуется осадок – параформ, представляющий собой линейный полимер формальдегида:
nH2C=O (-CH2–O-)n.
Формалин свертывает белки и поэтому используется для дезинфекции, а также применяется для хранения анатомических препаратов.
Для уксусного альдегида характерна реакция тримеризации:
|
H3C |
O |
|
CH3 |
|||
|
|
|
|
|
|||
3 CH3-C=O |
|
|
|
HC |
|||
CH |
|
|
|
||||
|
|
|
|
|
|||
H |
|
|
|
|
|
|
|
O |
|
|
|
O |
|||
|
|
|
|
||||
|
|
|
|
|
CH |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
||
3. Реакция Канниццаро-Тищенко, или реакция диспропорционирования (дисмутации). Эта реакция характерна для альдегидов, у которых отсутствует водород в-положении. Из двух молекул альдегида в присутствии концентрированного раствора
43
щелочи одна окисляется в кислоту, а другая восстанавливается в спирт. Таким образом, реакция дисмутации является окислительно-восстановительной:
60 % КОН
2 C6H5-C=O |
|
|
|
|
C6H5-CH2OH + C6H5-C=O |
||
|
|
|
|
|
бензиловый |
OK |
|
H |
|
|
|
|
|
спирт |
|
|
|
|
|
|
|
||
бензаль- |
|
|
|
|
|
|
бензоат |
дегид |
|
|
|
|
|
|
калия |
Из алифатических альдегидов в реакцию дисмутации вступают альдегиды с |
|||||||
четвертичным атомом углерода при карбонильной группе: |
|
||||||
R |
|
|
R2 |
|
O |
|
|
|
|
C |
|
C |
|
||
1 |
|
|
|||||
|
|
|
|
H |
|
||
|
|
|
|
|
|
|
|
|
|
|
R 3 |
|
|
||
|
|
|
|
|
|
||
Исключение составляет формальдегид (в силу своей активности). Он вступает в эту реакцию в нейтральной среде:
|
H2O |
2СН2О |
СH3OH + HCOOH |
Поэтому водные растворы формальдегида имеют кислую реакцию. Реакция дисмутации протекает в животных и растительных организмах.
Глоссарий
Полуацетали – продукты взаимодействия альдегида с одной молекулой спирта. Ацетали – с двумя молекулами спирта.
Альдольная конденсация – взаимодействие нескольких молекул альдегидов (или катионов, за счет подвижного атома водорода в - положении.
Реакция Канниццаро-Тищенко (дисмутации, диспропорционирования, окислительновосстановительная) – взаимодействие двух молекул альдегидов, не имеющихводородного атома.
Окислители – нейтральные молекулы или ионы (O2, Fe3+ ), принимающие электроны или атомы водорода от органического вещества.
Восстановители – нейтральные молекулы или ионы (H2, Fe2+, H-), отдающие электроны или атомы водорода органическому веществу.
Тема 4. КАРБОНОВЫЕ КИСЛОТЫ И ИХ ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ
Цель занятия: сформировать знания закономерностей, особенностей химического поведения карбоновых кислот и их функциональных производных, лежащих в основе важнейших биологических процессов.
Конкретные задачи
1. Студент должен знать: классификацию, номенклатуру и изомерию карбоновых кислот; формулы и тривиальные названия наиболее распространенных кислот; физические свойства кислот; электронное строение карбоксильной группы и карбоксилат–аниона; химические свойства карбоновых кислот; особенности поведения непредельных и двухосновных карбоновых кислот.
44
2. Студент должен уметь: писать уравнения реакций, отражающих химические свойства карбоновых кислот; понимать специфичность проявления химических свойств различных кислот – предельных, непредельных, двух- и многоосновных, ароматических; проводить специфические реакции на карбоновые кислоты; владеть практическими навыками по идентификации карбоновых кислот.
Мотивация. Карбоновые кислоты – обширный класс органических соединений, играющих исключительно важную роль в биохимических процессах и входящих в состав биологически важных соединений. Так, в состав жиров и липидов мембран входят высшие жирные карбоновые кислоты. В процессы метаболизма в клетках вовлекаются многие кислоты – пировиноградная, лимонная, янтарная, фумаровая и т.д. Уксусная кислота – ключевой метаболит всех видов обмена в организме. Органические кислоты находят применение в пищевой, лакокрасочной, фармацевтической промышленности и медицине.
Вопросы для самоподготовки
1.Строение, изомерия, номенклатура карбоновых кислот.
2.Общие свойства карбоновых кислот, обусловленные функциональной группой, т.е. реакции образования функциональных производных: солей, сложных эфиров, галогенангидридов, ангидридов, амидов.
3.Способность к диссоциации и сравнение силы кислот на примере муравьиной,
пропионовой, -хлорпропионовой кислот.
4.Реакции с участием радикалов кислот: монокарбоновых предельных, непредельных, ароматических.
5.Специфические свойства многоосновных карбоновых кислот, проявляющиеся при нагревании.
6.С–Н кислотность малоновой кислоты и ее эфиров.
Этапы занятия и контроль усвоения знаний
|
Этапы занятия |
|
Формы проведения этапа |
|
|
Время |
|
|
|
|
|
|
|
1. |
Контроль выполнения |
|
Проверка выполнения домашнего задания в |
|
15 |
мин. |
домашнего задания. |
|
рабочих тетрадях. |
|
|
|
|
2. Контроль самоподготовки. |
|
Тест – контроль и его оценка (0, 5, 10 баллов). |
|
15 |
мин. |
|
3. |
Разбор теоретического |
|
Опрос студентов у доски с коррекцией |
|
90 |
мин |
материала. |
|
ответов преподавателем, демонстрация |
|
|
|
|
|
|
|
плакатов, слайдов. |
|
|
|
4. |
Приобретение |
|
Выполнение лабораторных работ по теме. |
|
30 |
мин. |
практических навыков. |
|
|
|
|
|
|
|
|
|
|
|
|
|
5. |
Оформление протоколов |
|
Оформление графы “Визуальные |
|
15 |
мин. |
|
|
|||||
лабораторных работ. |
|
наблюдения” в протоколах лабораторных |
|
|
|
|
|
|
|
работ в рабочих тетрадях. Самостоятельный |
|
|
|
|
|
|
анализ полученных данных и формулировка |
|
|
|
|
|
|
выводов из проделанной работы. |
|
|
|
6. |
Проверка и защита |
|
Защита студентами протоколов лабораторных |
|
15 |
мин. |
протоколов. |
|
работ и оценка полученных практических |
|
|
|
|
|
|
|
навыков. |
|
|
|
45
Содержание этапов занятия
1-й этап. Преподаватель проверяет выполнение домашнего задания по теме и отвечает на вопросы студентов, выставляет оценку по пятибалльной системе.
2-й этап. Студент письменно отвечает на билет тест – контроля. Ответ оценивается по десятибалльной системе (0, 5, 10 балов).
3-й этап. При опросе теоретического материала студенты у доски разбирают:
–особенности электронного строения карбоксильной группы и связь с химическим поведением;
–способность кислот к диссоциации и сравнение силы различных кислот на примере масляной, 2-оксимасляной, 2-метилмасляной, 2-хлормасляной и янтарной кислот;
–химические свойства кислот, обусловленные реакциями по карбоксильной группе: образование сложных эфиров, ангидридов, галогенангидридов, амидов;
–химические свойства, обусловленные реакциями в радикале: реакции по двойной связи непредельных кислот на примере акриловой кислоты, реакции замещения в радикале предельных кислот на примере пропановой кислоты, реакции замещения в ароматическом кольце на примере бензойной кислоты;
–специфические свойства двухосновных кислот, проявляющиеся при нагревании, на примере пропандиовой, бутандиовой и гександиовой кислот.
4-й этап. Студенты по 2 человека выполняют предложенные лабораторные работы.
5-й этап. Студенты оформляют лабораторные работы по унифицированной форме в виде таблицы, данной в рабочей тетради.
6-й этап. Студент представляет оформленный протокол и объясняет полученные результаты. Преподаватель оценивает его практические навыки.
Теория
Карбоновыми кислотами называются органические соединения, содержащие карбоксильную группу – СООН, общая формула R-(COOH)n
Классификация.
1.По числу функциональных групп (–СООН): одно- и многоосновные.
2.По характеру радикала R:
предельные, |
непредельные, |
ароматические. |
||||||
СН3–СН2–СООН, |
СН2 = СН–СООН; |
|
|
|
|
|
|
COOH |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Одноосновные карбоновые кислоты Номенклатура.
В основе международной номенклатуры ИЮПАК лежат названия нормальных (неразветвленных) углеводородов. Наличие карбоксильной группы отражается в названии кислоты окончанием -овая:
СН3-СООН |
СН3-СН-СООН |
СН2=СН–СН2-СООН |
|
|
|
|
СН3 |
|
этановая кислота |
2-метилпропановая |
бутен-3-овая кислота |
|
кислота |
|
Для двухосновных кислот название строится так же, с окончанием -диовая: НООС–СН2–СН2-СООН (бутандиовая кислота).
В названиях ароматических кислот в качестве родоначальной структуры используется бензойная кислота.

46
COOH |
COOH |
COOH |
COOH |
|
|
||||
|
CH3 |
|
|
|
|
|
CH3 |
CH3 |
|
бензойная |
2-метил- |
3-метил- |
||
4-метил- |
||||
кислота |
бензойная |
бензойная |
бензойная |
|
|
кислота |
кислота |
кислота |
Карбоновые кислоты известны с давних времен, поэтому для многих из них прочно утвердились тривиальные названия. Происхождение таких названий, как правило, связано с природными объектами, из которых они выделены.
Рассмотрим наиболее широко распространенные одноосновные предельные и непредельные карбоновые кислоты.
Формула |
Тривиальное |
|
ИЮПАК |
|
|
|
|
|
название |
||
|
|
||
|
|
|
|
Н-СООН |
Муравьиная |
|
метановая |
СН3-СООН |
Уксусная |
|
этановая |
СН3-СН2-СООН |
Пропионовая |
|
пропановая |
СН3-СН2-СН2-СООН |
Масляная |
|
бутановая |
СН3-СН-СООН |
Изомасляная |
|
2-метилпропановая |
|
|
|
|
СН3 |
|
|
|
СН3-СН2-СН2-СН2-СООН |
Валериановая |
|
пентановая |
СН2=СН-СООН |
Акриловая |
|
пропеновая |
Высшие жирные кислоты (ВЖК)
Предельные:
Пальмитиновая С15Н31СООН
Стеариновая С17Н35СООН
Непредельные: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10 |
9 |
|||||
Олеиновая |
С17Н33СООН |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
13 |
|
|
12 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
10 |
9 |
|
|
|
||||||||||||||
Линолевая |
С17Н31СООН |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
15 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
16 |
13 |
12 |
10 |
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Линоленовая С17Н29СООН |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
COOH
COOH
COOH
COOH
COOH
9 |
8 |
6 |
5 |
||||||
Арахидоновая С19Н31СООН |
|
|
|
|
|
|
|
|
COOH |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||
11 12 14 15
ВЖК имеют наиболее выгодную зигзагообразную конформацию углеродной цепи; ненасыщенные ВЖК содержат одну или несколько двойных связей. Как правило, число атомов углерода в них четное.
Полиненасыщенные ВЖК, в отличие от насыщенных, не синтезируются в организме человека. Они являются незаменимыми и должны поступать с пищей, в основном с растительными маслами. Для профилактики и лечения некоторых заболеваний, связанных с недостатком ненасыщенных ВЖК, применяют препарат

47
«Линетол», представляющий собой смесь этиловых эфиров жирных кислот, получаемых из льняного масла.
Важную роль в организме играет арахидоновая кислота. Она является предшественником эйкозаноидов – сильнодействующих биорегуляторов клетки.
ВЖК входят в состав жиров (триацилглицеролов), выполняющих резервную функцию, а также фосфолипидов, составляющих основу мембраны клетки.
Изомерия
Структурная изомерия карбоновых кислот обусловлена разветвлением углеродного скелета (бутановая и 2-метилпропановая кислота) и взаимным расположением заместителей и карбоксильной группы в ароматических кислотах (три изомера метилбензойной кислоты).
Стереоизомерия карбоновых кислот обусловлена различным расположением заместителей относительно двойной связи для непредельных кислот или относительно плоскости кольца для алициклических с образованием цис- и транс-изомеров. Простейшая непредельная бутендиовая кислота существует в виде стереоизомеров: цис-изомера – малеиновой кислоты и транс-изомера – фумаровой:
H |
COOH |
H |
|
|
COOH |
||
C |
|
|
|
||||
|
|
C |
|||||
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
C |
|
|
C |
||||
H |
COOH |
HOOC |
|
|
H |
||
малеиновая |
фумаровая кислота |
||||||
кислота |
|
транс–изомер |
|||||
цис–изомер |
|
|
|
|
|||
Ненасыщенные ВЖК чаще всего имеют цис-конфигурацию:
CH3 


 COOH
COOH
линолевая кислота Большей энергетической устойчивостью обладают транс-изомеры.
Физические свойства.
Молекулы карбоновых кислот полярны. Они способны, как и спирты, образовывать водородные связи. Температура кипения кислот значительно выше, чем спиртов и альдегидов, так как кислоты образуют ассоциаты за счет межмолекулярных водородных связей линейной и циклической структуры.
|
|
H |
|
|
H |
H |
|||
O …… HO |
|
|
|
|
|
|
|
|
|
CH3 - C |
C - CH |
C |
|
|
C |
C |
|||
3 |
|
|
|
|
|
|
|
||
|
|
|
OH |
O |
|
|
|
|
|
OH …… O |
|
... O |
|
OH … O |
|
OH |
|||
|
… … |
|
|
|
|||||
димерный ассоциат |
|
|
линейный ассоциат |
|
|
||||
Низшие карбоновые кислоты (С1 – С9) представляют собой жидкости, высшие алифатические и ароматические кислоты – твердые вещества. Первые гомологи – муравьиная, уксусная и пропионовая кислоты – обладают резким раздражающим запахом, при попадании на слизистые оболочки вызывают ожоги, с водой смешиваются в любых соотношениях. По мере увеличения гидрофобной углеводородной части молекулы растворимость в воде уменьшается. Двухосновные кислоты – бесцветные кристаллические вещества, растворимые в воде.
48
Химические свойства
Карбоксильная группа карбоновых кислот имеет сложное строение: она состоит из карбонильной группы С=О и гидроксильной группы –ОН, которые влияют друг на друга.
Благодаря +M –эффекту ОН-группы в карбоксильной группе возникает р - сопряжение, происходит выравнивание электронной плотности в ней и сведение полярности карбонильной группы до минимума. Этим объясняется инертность карбонильной группы в кислотах. +М –эффект гидроксильной группы объясняет также смещение электронной плотности в ней в сторону более электроотрицательного атома кислорода и диссоциацию кислот.
(- I) – эффект гидроксильной группы поляризует связь С ОН и делает возможным
ееотщепление: группа ОН может отщепляться, что обусловливает реакции
нуклеофильного замещения. Таким образом, главные реакции идут либо за счет
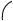 O R
O R  C
C
O H
..
замещения ОН - группы, либо за счет водорода этой группы.
1. Кислотные свойства Сила карбоновых кислот зависит от стабильности аниона, образующегося после отрыва протона. Стабильность аниона определяется, прежде всего, степенью делокализации отрицательного заряда: чем выше степень делокализации, тем стабильнее анион.
В карбоксилат-анионе заряд делокализуется по сопряженной системе, т. е. равномерно распределяется между двумя атомами кислорода карбоксилат–аниона, что придает ему стабильность:
O |
|
O |
|
R -C |
|
R C |
+ Н+ |
O |
H |
O |
|
.. |
|
|
|
O |
|
|
O |
|
|
|
|
R -C |
|
R – C |
(-) |
O |
(–) |
|
O |
В рамках класса сила кислот зависит от строения углеводородных радикалов и заместителей в них. Электронодонорные заместители ослабляют кислотные свойства, так как дестабилизируют карбоксилат–анион; электроноакцепторные заместители, оттягивая электронную плотность, способствуют делокализации заряда в карбоксилат – анионе и тем самым стабилизируют его, т.е. усиливают кислотные свойства.
Так, при введении в углеводородный радикал уксусной кислоты атомов хлора кислотность будет увеличиваться за счет электроноакцепторных свойств атома хлора:
|
|
|
|
|
Cl |
|
|
|
|
|
|
СН3 СООН СН2 СООН |
|
СlСН СООН |
|
СlС СООН |
|
|
|
|
|
|
|
|
Сl |
|
Cl |
|
Cl |
рКа 4,76 |
2,85 |
|
1,25 |
|
0,66 |
49
Ароматические кислоты имеют более сильные кислотные свойства, чем незамещенные алифатические (для бензойной кислоты С6Н5-СООН рКа=4,19) – сказывается электронное влияние фенильного радикала (-I).
Кислотные свойства проявляются в реакции нейтрализации:
СН3 – СООН + NaOH |
|
|
CH3COONa + H2O |
|
|
|
|
|
|
|
|||||||||||
2. Реакции нуклеофильного замещения (SN ): |
|
|
|
|
|
|
|
||||||||||||||
а) реакция этерификации: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
O |
|
|
|
+Н+ |
|
|
|
O |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
H |
|
C |
+ |
|
|
|
Н2О |
|
|||||
|
H |
|
C + С2Н5 – ОН |
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
O-C2H5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
этилформиат |
|
|
|
|
|
|
|
||||||
|
|
|
Механизм реакции: |
|
|
|
|
|
|
|
|
|
|
OH |
|
||||||
|
|
|
O |
|
|
|
|
|
|
.. |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
||||||
|
|
|
|
|
|
|
|
|
OH НОС2Н5 |
|
|
|
|
|
-Н2О |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
R |
|
C |
|
+ Н+ |
|
|
+ |
|
|
|
|
|
|
|
R - C - O -C2H5 |
|
|||||
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
OH |
R |
|
|
C |
|
|
|
|
|
|
|
|
H |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
OH |
|
|
|||||
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
+ |
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
-Н |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
R - C |
|
|
|
R |
|
|
|
C |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
OC H |
5 |
|
|
|
|
|
|
|
|
OC2H5 |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Реакция этерификации – обратимый процесс: прямая реакция – образование сложного эфира, обратная – его кислотный или щелочной гидролиз. Чтобы сдвинуть равновесие вправо, необходимо из реакционной смеси удалить воду
б) образование галогенангидридов:
Среди галогенангидридов наибольшее значение имеют хлорангидриды, которые получают при действии хлоридов фосфора (III) или фосфора (V):
|
|
|
|
O |
|
O |
|
|
|
|
CH |
|
|
C |
+ PCl5 |
CH3 |
C |
+ |
POCl3 + |
HCl |
|
3 |
||||||||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
OH |
|
Cl |
|
|
|
|
|
|
|
|
|
хлористый ацетил |
|
|
|
||
в) образование ангидридов кислот:
При действии сильных водоотнимающих агентов (P2O5, Al2O3) образуются ангидриды кислот:
|
|
|
|
O |
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
C |
___ |
CH3 |
|
|
|
C |
|
|
|
|
|||||||||
|
|
|
|
|||||||
|
|
|
|
|
|
|
. |
|
||
|
|
|
|
OH |
|
|
|
+ H2O |
||
|
|
|
|
Al2O3 |
|
|
|
|
O. |
|
|
|
|
|
OH |
CH3 |
|
|
C |
|
|
CH3 |
|
|
C |
|
|
|
|
|||
|
|
|
|
|
|
|||||
|
|
O |
|
|
|
|
O |
|
||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|

50
Большое практическое значение имеет уксусный ангидрид, используемый для получения волокон (ацетатный шелк), многих лекарственных веществ. Применяется также для ацетилирования соединений.
Галогенангидриды и ангидриды очень реакционноспособны. При взаимодействии галогенангидридов с соединениями, содержащими атом металла или активный атом водорода, происходит замена его кислотным остатком. Подобные реакции называются ацилированием, в частности ацетилированием, если в молекулу входит ацетил, остаток уксусной кислоты.
В организме ацетилирующим реагентом является ацетилкофермент А - ключевой метаболит всех видов обмена в клетке.
O
CH3 C
S - KoA
г) образование амидов:
 O O
O O
CH3 |
|
C + NH3 |
CH |
3 |
- C |
+ |
HCl |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
NH2 |
|
|
|
|
|
|
(амид уксусной |
|
|
|
|||
|
|
|
|
кислоты) |
|
|
|
||
|
|
O |
|
|
|
O |
t° С |
|
O |
|
|
|
|
|
|
|
|||
CH3 - C |
+ NH3 |
CH3 – C |
|
|
CH3 - C |
+ H2O |
|||
|
|
|
|
ONH4 |
|
|
|||
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH2 |
|
|
|
|
|
|
|
|
|
|
|
Амиды можно получить взаимодействием карбоновых кислот с аммиаком. Вначале образуются аммонийные соли, которые при нагревании теряют воду и превращаются в амиды. Амиды кислот подвержены различным превращениям. При нагревании с Р2О5 отщепляется вода и образуются нитрилы кислот:
__
|
|
|
|
O t°, P2O5 |
|
|
|
|
|
|
CH |
3 |
- C |
CH3–C=N + H2O |
|||||||
|
|
|
|
нитрил |
|
|
|
|
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
уксусной |
|
|
|||
|
|
|
|
NH2 |
кислоты |
|
|
|||
|
|
|
|
|
|
|
|
|||
Все функциональные производные способны гидролизоваться с образованием |
||||||||||
карбоновых кислот: |
|
|
|
|
|
|||||
|
|
O |
|
|
|
|
|
O |
|
|
R - C |
|
|
|
+ Н2О |
R - C |
+ |
НХ |
|||
|
|
|
|
|
|
|
|
|||
|
|
X |
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
___ |
|
||
|
|
______ |
|
|
OH |
O |
||||
|
|
|
H OH |
|
|
|
||||
|
|
|
|
|||||||
R-C= N + H OH |
R - C |
|
OH |
R - C |
||||||
|
||||||||||
|
|
|
||||||||
|
|
|
|
H OH -NH3 |
|
OH |
-H2O |
|||
|
|
|
|
|
|
|
OH |
|||
|
|
|
|
|
|
|
|
|
|
|
