
- •Глава 4 Основы электрохимии
- •4.1 Теория электролитов.
- •4.1.1.Электролиты и их свойства.
- •4.1.2 Основные положения теории Аррениуса.
- •4.1.3 Ионное равновесие в растворах электролитов
- •4.1.3 Недостатки классической теории электролитической диссоциации
- •4.1.4 Механизм образования растворов электролитов
- •4.1.5 Распределение ионов в растворах электролитов. Теория сильных электролитов.
- •4.2 Электропроводность растворов электролитов.
- •4.2.1.Основные понятия.
- •4.2.3 Числа переноса ионов
- •4.3 Электрохимические системы.
- •4.3.1. Химические и электрохимические реакции.
- •4.3.2 Электрохимические системы
- •4.3.3 Происхождение электрического тока в электрических системах. Закон Фарадея.
- •4.4 Электрохимический потенциал и равновесия на границах раздела фаз.
- •4.4.1 Электрохимический потенциал
- •4.4.2 Электрохимические равновесия на границах раздела фаз.
4.2.3 Числа переноса ионов
Одним из важнейших понятий в электрохимии является число переноса ионов. В электролитах электричество переносится одновременно положительными и отрицательными ионами, поэтому естественно, возникает вопрос, каково участие в этом процессе ионов каждого знака.
Количество переносимого электричества определяется концентрацией ионов и скоростью их движения. Поскольку в одно - одновалентном электролите концентрация катионов и анионов одинаковы, участие их в переносе электричества зависит лишь от относительной скорости их движения. Так как скорости их движения могут быть существенно различными, поэтому и числа переноса будут различными.
Числом переноса иона называется доля прошедшего через электролит электричества, переносимая данным видом ионов, т.е. число переноса иона – это отношение количества электричества, переносимого ионами данного рода сквозь какое либо поперечное сечение электролита, к общему количеству электричества, прошедшего через электролит сквозь это сечение.
Для полностью диссоциированного бинарного электролита, число переноса катиона равно
t+=![]()
Для аниона t- =
![]()
Используя значения токов I+и I- и формулы (2.5) и (2.10), можно записать:
t+= =
=![]() (2.16)
(2.16)
t- =
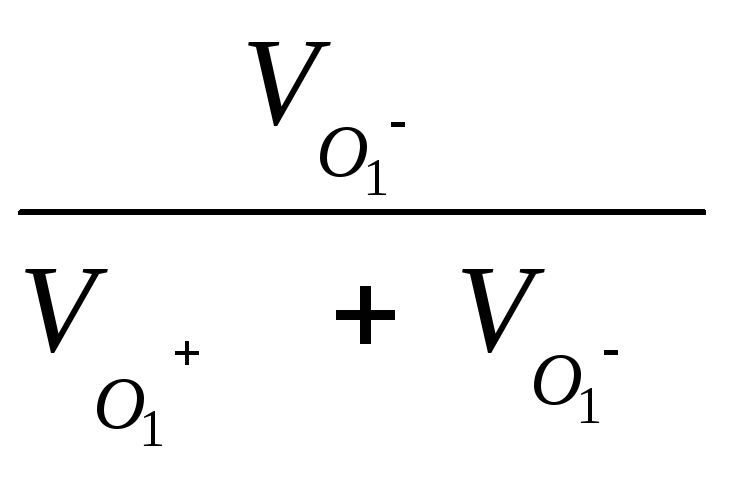 =
=![]() (2.17)
(2.17)
4.3 Электрохимические системы.
4.3.1. Химические и электрохимические реакции.
Чтобы установить круг тех явлений, которые изучает электрохимия, необходимо рассмотреть отличие химических процессов от электрохимических. Выявить почему энергетический эффект химического превращения в первом случае проявляется в форме теплоты, а во втором - в форме электрической энергии.
Рассмотрим, какое-либо химическое превращение, например
Zn + CuSO4 → Zn SO4 + Cu
Как любую окислительно-восстановительную реакцию ее можно рассматривать с точки зрения сопряженных процессов окисления и восстановления
Zn – 2ē → Zn2+
Cu2++ 2e → Cu
Если эта реакция протекает как химический процесс, то необходимым условием ее осуществления является столкновение участников друг с другом.
Только в момент столкновения, становится возможным переход электронов от одной частицы к дугой.
Следовательно, необходимость контакта реагирующих частиц. Является первой характерной особенностью химического процесса.
Совершится ли такой переход в действительности, зависит от энергии реагирующих частиц и ее соотношения с энергией активации; энергия активации является функцией природы химической реакции и для ионных она невелика.
Путь электрона при таком переходе очень мал, что является второй характерной особенностью химического процесса. И, наконец, столкновения между реагирующими частицами могут происходить в любых точках реакционного объема и при любых взаимных их положениях.
Х аотичность
столкновений между реагирующими
частицами, ненаправленность электронных
переходов является характерной
особенностью химического процесса.
аотичность
столкновений между реагирующими
частицами, ненаправленность электронных
переходов является характерной
особенностью химического процесса.
В результате этих особенностей энергетические эффекты химических процессов выражаются в форме теплоты, а полезная работа равна нулю.
Чтобы энергетические изменения, соответствующие химическому превращению, проявлялись в виде электрической энергии, т.е. чтобы осуществить электрохимический процесс, необходимого изменить условия его протекания.
Реакцию необходимо провести так, чтобы электронные переходы от одного участника реакции к другому совершались по достаточно длинному пути и в одном определенном направлении.
Таким образом, характерной особенностью электрохимических реакций является то, что их необходимо провести, не приводя в соприкосновение друг с другому частников реакции.
