
- •Глава 4 Основы электрохимии
- •4.1 Теория электролитов.
- •4.1.1.Электролиты и их свойства.
- •4.1.2 Основные положения теории Аррениуса.
- •4.1.3 Ионное равновесие в растворах электролитов
- •4.1.3 Недостатки классической теории электролитической диссоциации
- •4.1.4 Механизм образования растворов электролитов
- •4.1.5 Распределение ионов в растворах электролитов. Теория сильных электролитов.
- •4.2 Электропроводность растворов электролитов.
- •4.2.1.Основные понятия.
- •4.2.3 Числа переноса ионов
- •4.3 Электрохимические системы.
- •4.3.1. Химические и электрохимические реакции.
- •4.3.2 Электрохимические системы
- •4.3.3 Происхождение электрического тока в электрических системах. Закон Фарадея.
- •4.4 Электрохимический потенциал и равновесия на границах раздела фаз.
- •4.4.1 Электрохимический потенциал
- •4.4.2 Электрохимические равновесия на границах раздела фаз.
4.2 Электропроводность растворов электролитов.
4.2.1.Основные понятия.
Удельная электропроводность.
Прямым доказательством существования ионов в растворах электролитов является способность растворов проводить электрический ток. Эта способность обусловлена движением положительно заряженных ионов к отрицательным электродам и отрицательно заряженных ионов к положительным электродам. Количественной характеристикой способности растворов электролитов проводить электрический ток является электропроводность.
Электропроводность– это величина обратная сопротивлению;
L = 1/R (2.1)
В свою очередь сопротивление R зависит от длины проводника l, площади поперечного сечения δ и удельного сопротивления ρ.
R = ρ * l / δ (Ом) (2.2)
Подставив значение R в уравнение 2.1 получим
L = 1/ρ * δ / ℓ Ом-1= См (сименс)
L = æ L = æδ/ ℓ
Величина обратная удельному сопротивлению называется удельной электропроводностьюи обозначается буквой æ (каппа).
Удельная электропроводность раствора электролита, представляет собой электропроводность 1 м3раствора, помещенного между параллельными электродами площадью 1 м2и расстоянием между ними 1 м и измеряется в См * м-1.
Так как электричество переносится ионами различных знаков, движущимися в противоположных направлениях, то общее количества электричества, проходящее через раствор в 1 сек., т.е. сила тока I, складывается из количеств электричества переносимых соответственно катионами I+ и анионами I-:
I = I++ I- (2.3)
Если обозначить скорость движения катионов V+ (м/с), скорость движения анионов черезV- (м/с), эквивалентную концентрацию ионов Сi (экв./ м3), поперечное сечение цилиндрического сосуда через δ (м2), расстояние между электродами черезl(м) и разность потенциалов между электродами через Е (В), то количество катионов, проходящих через поперечное сечение электролита в 1 сек. будет равно:
n+ = V+ * δ * С+, т.е.
за это время в одну сторону через сечение пройдут все катионы, находящиеся в начальный момент на расстоянии не более чем V+ (м) от выбранного сечения, т.е. все катионы в объемеV+ * δ.
А так же каждый эквивалент ионов согласно закону Фарадея F = 96500 Кл. электричества, то сила тока:
I+= n+ * F =V+ * δ * С+ * F
Аналогично, для анионов
I- = V- * δ * С- * F
Общая сила тока составит:
I = I++ I- = (V++V-) * δ * Сi * F (2.4)
Скорость движения ионов V+иV-зависят от природы ионов, концентрации, температуры, напряженности поля.
Пусть все факторы, кроме напряженности поля, постоянны, скорость в этом случае пропорциональна только предложенной силе.
Напряженность электрического поля, это силовая характеристика электрического поля - разность потенциалов между двумя точками в вольтах деленная на расстояние между ними lв метрах (В/м)
В этом случае:
V+ =![]() (2.5)
(2.5)
V- =![]() (2.5)
(2.5)
Где,
![]() коэффициенты
пропорциональности соответствующие
скорости ионов при напряженности поля
в 1 В/м, называют абсолютными скоростями
движения ионов. И имеют размерность м/с
* м/В = м2/ В*с
коэффициенты
пропорциональности соответствующие
скорости ионов при напряженности поля
в 1 В/м, называют абсолютными скоростями
движения ионов. И имеют размерность м/с
* м/В = м2/ В*с
Подставив выражение (2.5) в уравнение (2.4) получим:
I =
 (2.6)
(2.6)
По закону Ома I =
![]() (2.7)
(2.7)
Приравняв правые части уравнения (2.6) и (2.7), получим:
 =
=![]() => æ = (
=> æ = (![]() )
*Сi* F
)
*Сi* F
Но Сi = СН* α * 1000 и в этом случае уравнение примет вид.
æ = (![]() )*
F * СН* α * 1000 (См * м-1) (2.8)
)*
F * СН* α * 1000 (См * м-1) (2.8)
Входящие в уравнение абсолютные скорости ионов зависят от концентрации ионов в растворе, что объясняется электростатическим взаимодействием между ними.
С уменьшением концентрации ионов, увеличивается расстояние между ними и уменьшается взаимодействие их зарядов, что приводит к увеличению абсолютных скоростей ионов.
При бесконечном разбавлении растворов абсолютные скорости достигают максимального значения.
Абсолютные скорости ионов при данной концентрации и при бесконечном разбавлении можно связать равенством.
![]() *
fλ
*
fλ
![]() *
fλ
*
fλ
Где fλ– коэффициент электропроводности
Он равен
fλ =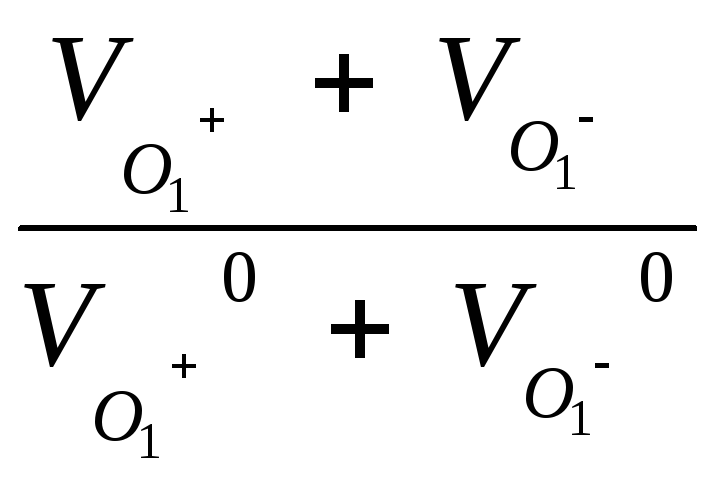
Вводя понятие коэффициента электропроводности fλполучим более общее уравнение
æ = 1000 * СН* α * fλ*(![]() )*
F (2.9)
)*
F (2.9)
Так как скорости движения ионов очень
малы, часто пользуются величинами в F
раз большими. Они называются подвижностями
ионов и обозначаются λ+ и λ- (лямда) и
имеют размерность (![]() )
)
λ+ =
![]() λ-
=
λ-
=![]() (2.10)
(2.10)
если рассматривать абсолютные скорости при бесконечном разбавлении, то можно говорить и о подвижностях ионов при бесконечном разбавлении
λ+0=![]() λ-0=
λ-0=![]() (2.11)
(2.11)
Пользуясь подвижностями уравнение (2.9)примет вид
æ = 1000 * СН* α * fλ* (λ+0+ λ-0) (2.12)
где α – степень диссоциации,
а fλ– коэффициент учитывающий изменение скорости ионов с концентрацией – характеризует межионной взаимодействие.
Для сильных электролитов α = 1, а для слабых электролитов fλ = 1.
Согласно полученного уравнения удельная электропроводность должна увеличиваться с увеличением концентрации.
Однако, если концентрация становится достаточно большей, то дальнейшее ее увеличение приводит к уменьшению α для слабых электролитов и fλдля сильных.
Влияние этих факторов может оказываться более сильным, чем увеличение общей концентрации, что вызовет падение æ от концентрации (с).
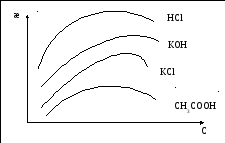
Рис. 4.1 Зависимость удельной электропроводности от концентрации
в водных растворах электролита.
Эквивалентная электропроводность.
Электропроводность раствора, содержащего 1 эквивалентную массу растворенного электролита, весь объем которого заключен между двумя параллельными электродами, отстающими друг от друга на расстоянии 1 м, называется эквивалентной электропроводностью и обозначается λv(лямбда). Между эквивалентной и удельной электропроводностями существует соотношение
λv= æ* V, ноV =![]() ,
тогда
,
тогда
λv=![]()
![]() (2.13)
(2.13)
Если величина æ подставить ее значение получим
λv= α * fλ* (λ++ λ-) (2.14)
Так как с увеличением разбавления α * fλ→ 1, то λv→ λ0, где
λv- эквивалентная электропроводность при данном разбавлении;
λ0- эквивалентная электропроводность при бесконечном разбавлении
λ0= (λ+0+ λ-0)
Эквивалентная электропроводность при бесконечном разбавлении равна сумме предельных подвижностей ионов – закон Кольрауша.
Из предыдущих уравнений следует:
fλ=![]() - для сильных электролитов (2.14)
- для сильных электролитов (2.14)
α =
![]() - для слабых электролитов (2.15)
- для слабых электролитов (2.15)
