
Metod_Inorganic_chem_1_pharm_M-1_copy
.pdf
3.Ступінчастий характер дисоціації кислот і основ.
4.Як класифікують електроліти за величиною ступеня дисоціації? Навести приклади.
5.Кількісні характеристики електролітичної дисоціації. Які чинники впливають на їх величину?
6.Що таке константа дисоціації слабких електролітів, константа дисоціації за першим ступенем, другим і т.д.? Яке існує співвідношення між ними?
7.Як формулюється закон Оствальда? Як його виразити математично?
8.Що таке активна концентрація йонів? Який її зв’язок із йонною силою розчину?
б) Алгоритми розв’ язування типових задач
Задача 1. Обчислити ступінь дисоціації і концентрацію іонів H+ у 0,3 М розчині мурашиної кислоти, якщо її константа дисоціації дорівнює
2,1×10–4 .
Алгоритм розв’язування Коротко записуємо умову задачі:
Дано: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
2,1×10−4 |
|
|
|
|
|
||||
|
|
2 |
|
|
|
K |
|
|
|
–2 |
|
|
|
|||||||
С = 0,3 моль/л |
|
1. |
К = a C; |
a = |
|
|
= |
|
|
|
|
= 2,64×10 |
|
= 2,64 % |
|
|||||
|
|
|
|
|
0,3 |
|
||||||||||||||
|
|
|
|
|
|
|||||||||||||||
м |
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= |
|
|
||
|
|
2. |
За формулами |
[H+] |
= |
aC або |
[H+] |
K ×C |
|
|||||||||||
α – ? |
||||||||||||||||||||
+ |
|
|
знаходимо [H+]: |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
[H ] – ? |
|
[H+] = 0,3×2,64×10–2 |
= 7,9×10–3 |
моль/л. |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
||||||||||||||
|
|
можна розрахувати за значенням К або α. |
||||||||||||||||||
3. Отже концентрацію йонів |
||||||||||||||||||||
Відповідь: α = 2,64 %, [H+] = 7,9×10–3 |
моль/л. |
|
|
|
|
|
|
|
|
|||||||||||
Задача 2. Вирахувати йонну силу та активність йонів у розчині, що містить
0,01 моль/л Ba(NO3)2 і 0,02 моль/л KCl.
Алгоритм розв’язування
1.Знаходимо концентрації йонів за формулою: C = αCn. Звідки: [Ba++] = 0,01моль/л, [NO3– ] = 0,02 моль/л, [K+] = [CI– ] = 0,02 моль/л
2.Записуємо формулу для обчислення йонної сили і підставляємо в неї значення:
I = 0,5(C Z 2 |
+ C Z 2 |
+ C Z 2) = |
|
1 1 |
2 2 |
|
n n |
05×(0,01×22 + 0,02×12 + 0,02×12 +0,02×12) = 0,05 |
|||
Користуючись таблицею (див. “ Збірник |
|
тестових завдань” ст. 289) |
|
знаходимо коефіцієнти активності (f) за величиною йонної сили (I) |
|||
fBa++ = 0,555, |
fK+ ,Cl− ,NO − = 0,85 |
||
|
|
3 |
|
Значення f можна також обчислити за формулою |
|||
|
|
|
|
lgf = –0,5 Z2 |
I . |
||
|
61 |
|
|
Активність йонів розраховують за формулою: a = fc; aBa++ = 0,555×10–3
моль/л; aK+ = aCl− = aNO3− = 0,85×0,02 = 1,7×10-2 моль/л.
в) Задачі для самостійного розв’язання
1. Обчислити активність йонів аргентуму в 0,05 М розчині AgNO3, що використовується як лікарський засіб.
Відповідь: 4,25.10–2 моль/л.
2.Обчислити a і [H+] в 0,1 М розчині гіпохлоритної кислоти. Кд= 5.10-8.
Відповідь: 7.10–4 ; 7.10–5 моль/л.
3.Ступінь дисоціації СН3СООН в 0,1 М розчині дорівнює 1,32×10–2 . Знайти константу дисоціації кислоти та значення рК.
Відповідь: 1,7×10–5 ; 4,75.
4.Кислотність шлункового соку зумовлена в основному наявністю HCI, концентрація якої становить приблизно 1 %. Розрахувати концентрацію
йонів [H+] (в ммоль/л).
Відповідь: 274 ммоль/л.
4. Матеріал для аудиторної роботи
4.1. Обладнання для проведення заняття
Штативи, пробірки та необхідні реактиви, бюретки, колбочки для титрування.
4.2. Інтегральні зв’язки
Матеріал даної теми необхідний в аналітичній та фармацевтичній хімії при вивченні якісних реакцій на окремі йони та встановлення тотожності лікарських засобів.
4.3. Зміст і методика проведення заняття
а) Виклад основних теоретичних положень:
-електролітична дисоціація та її кількісні характеристики;
-аналіз формул для обчислення концентрації йонів та їх активностей;
-розгляд основних теорій кислот і основ;
б) Перелік практичних вмінь та навичок:
-вміти обчислювати концентрації йонів сильних та слабких електролітів;
-вміти обчислювати активності йонів сильних електролітів
4.4. Лабораторна робота. Умови утворення та розчинення осадів Однотипні та різнотипні конкуруючі рівноваги
4.4.1Залежність швидкості реакції від ступеня дисоціації кислоти.
Удві пробірки налити по 2 мл 2 н. розчинів сульфатної та ацетатної кислот і внести приблизно однакові кусочки цинку. Порівняти швидкості виділення водню. Дати пояснення та записати молекулярні та йонні рівняння
62
реакцій.
4.4.2 Вплив ступеня дисоціації кислоти на розчинення осаду.
До 2–3 мл розчину хлориду кальцію додати 2–3 краплі розчину оксалату амонію. Одержаний осад оксалату кальцію розділити на дві пробірки. В одну з пробірок прилити 1–2 мл 2 н. розчину хлоридної кислоти, а в другу – стільки ж розчину оцтової кислоти. Дати пояснення, чому осад розчиняється в соляній кислоті і не розчиняється в оцтовій кислоті. Записати молекулярні та йонні рівняння реакцій.
4.4.3Вплив ступеня дисоціації основи на напрямок реакції.
Удві пробірки налити по 2 мл розчину хлориду кальцію. В першу пробірку додати 1 мл 2 М розчину гідроксиду натрію, а в другу 2 М розчину гідроксиду амонію. Спостерігати та пояснити, як впливає сила основи на перебіг хімічної реакції. Записати молекулярні та йонні рівняння реакцій.
4.4.4Реакції на сульфат-йон.
Утри пробірки налити по 1 мл розчинів сульфату натрію, сульфату мангану та сульфатної кислоти. В кожну пробірку долити однакові об’єми розчину хлориду барію. Спостерігати за утворенням білого кристалічного осаду сульфату барію. Записати молекулярні та йонні рівняння реакцій. Яким скороченим йонним рівнянням можна записати всі три реакції?
4.4.5Реакції на гідроксил-йон.
Удві пробірки налити по 1 мл розчинів гідроксиду натрію та гідроксиду амонію. В кожну пробірку долити однакові об’єми розчину хлориду феруму (ІІІ). Спостерігати за утворенням червоно-бурого осаду гідроксиду феруму (ІІІ). Записати молекулярні та йонні рівняння реакцій.
4.4.6Реакції на хлорид-йон.
Удві пробірки налити по 1 мл розчинів хлориду натрію та хлоридної кислоти. В кожну пробірку додати по 2–3 краплі розчину нітрату аргентуму. Спостерігати за утворенням білого сирнистого осаду хлориду аргентуму. Записати молекулярні та йонні рівняння реакцій. Яким скороченим йонним рівнянням можна записати обидві реакції?
5.Підведення підсумків та зарахування роботи.
Заняття № 13
Тема: Рівновага в розчинах малорозчинних електролітів
1. Актуальність теми
Оскільки гетерогенні рівноваги вносять значний вклад у загальний
63
гомеостаз організму, то важливим є вивчення гетерогенних процесів на межі поділу фаз – утворення і розчинення осадів, каменів у нирках та жовчному міхурі, мінеральної основи кісткової тканини.
2. Мета заняття
−вміти кількісно характеризувати рівновагові процеси в гетерогенних процесах;
−вміти проводити розрахунки розчинності важкорозчинних електролітів у воді, кислотах, розчинах комплексоутворювачів;
−- вміти прогнозувати утворення і розчинення осадів, тобто зміщення рівноваги в гетерогенних процесах.
3. Матеріали доаудиторної самостійної роботи
3.1. Засвоїти матеріал навчальної програми
Рівновага між розчином і осадом малорозчинних електролітів. Добуток розчинності (ДР). Умови утворення і розчинення осадів.
3.2. Блок інформації
Розчинність різних речовин в одному і тому ж розчиннику або однієї речовини в різних розчинниках може коливатися у дуже широких межах. Кількісно розчинність визначають вмістом речовини (концентрацією) у насиченому розчині, тобто такому, який характеризується динамічною рівновагою за умови сталої температури:
нерозчинена речовина (осад) ↔ речовина у розчині.
Всі солі, в тому числі і малорозчинні, відносяться до сильних електролітів. Через це при осадженні чи розчиненні малорозчинної солі у водному розчині в рівновазі з осадом знаходяться тільки йони солі. Рівняння динамічної рівноваги має вигляд
AB A+ + B − .
В стані рівноваги за умови сталої температури за одиницю часу в розчин переходить така кількість сполуки, яка за цей же час з розчину випадає в осад. Ця динамічна гетерогенна рівновага описується добутком розчинності (ДР,Ks) - добутком рівноважних концентрацій іонів у насиченому розчині малорозчинного сильного електроліту.
Вираз добутку розчинності малорозчинної сполуки AmBn , що дисоціює за рівнянням
Am Bn Û mAn + + nBm − ,
матиме вигляд
ДР = [An+ ]m ×[Bm− ]n .
Умови виділення та розчинення осаду електроліту:
- якщо [An+ ]m × [B m− ]n > ДР , то розчин пересичений, осад випадає;
- якщо [An+ ]m ×[Bm− ]n = ДР , то розчин насичений, система знаходиться у
64

стані рівноваги;
- якщо [An+ ]m ×[Bm− ]n < ДР , то розчин ненасичений, осад розчиняється.
Важливою характеристикою малорозчинних сполук є їх розчинність в різних розчинниках.
Для бінарної малорозчинної сполуки AB розчинність розраховується за рівнянням:
SAB = 
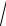 ДРAB
ДРAB
для малорозчинних сполук типу Am Bn
SA B |
|
= m+ n |
ДРAm Bn |
. |
|
|
|||
m |
n |
|
mm × nn |
|
3.3. Література до теми
1.Левітін Є.Я., Бризицька А.М., Клюєва Р.Г. Загальна та неорганічна хімія. – Вінниця: Нова книга, 2003. – 464 с.
2.Практикум з загальної та неорганічної хімії / Є.Я.Левітін, Р.Г.Клюєва, А.М.Бризицька та ін. – Харків: Основа, 1998. – 119 с.
3.Загальна та неорганічна хімія: У 2-х ч./О.М.Степаненко, Л.Г.Рейтер,
В.М.Ледовских, С.В.Іванов. – К.: Пед. Преса, 2002.– Ч. І.– 520 с.;– Ч.ІІ.–
4.Романова Н.В. Загальна та неорганічна хімія. – Київ-Ірпінь, 1998. – Розділ
6.6, розділ 9.1.2.
5.Глінка Н.Л. Загальна хімія. – Л.,1985. – С.215-222.
6.Мороз А.С., Ковальова А.Г. Фізична та колоїдна хімія. – Львів: Світ, 1994.
– С.48-55.
7.Жаровський Ф.Г., Пилипенко А.Г., П’ятницький І.В. – К.: Вища школа, 1969. – С.49-64.
3.4. Матеріали для самоконтролю
а) Дати письмові відповіді на контрольні запитання
1.Яка величина використовується для характеристики важкорозчинних електролітів?
2.При якому співвідношенні ДР і ЙД буде утворюватись осад?
3.Яка з речовин краще розчинна у воді: AgCl (ДР = 1,8×10–10 ) чи Ag2CrO4 (ДР = 4×10–12 )? Свої висновки підтвердіть відповідними розрахунками.
4.Що означає поняття «дробне осадження»?
б) Алгоритми розв’ язування типових задач
Задача 1. Обчислити розчинність аргентум хлориду та концентрації йонів
аргентуму в г/л в насиченому розчині цієї солі, якщо ДРAgCl = 1,56×10–
10.
Коротко записуємо умову.
65
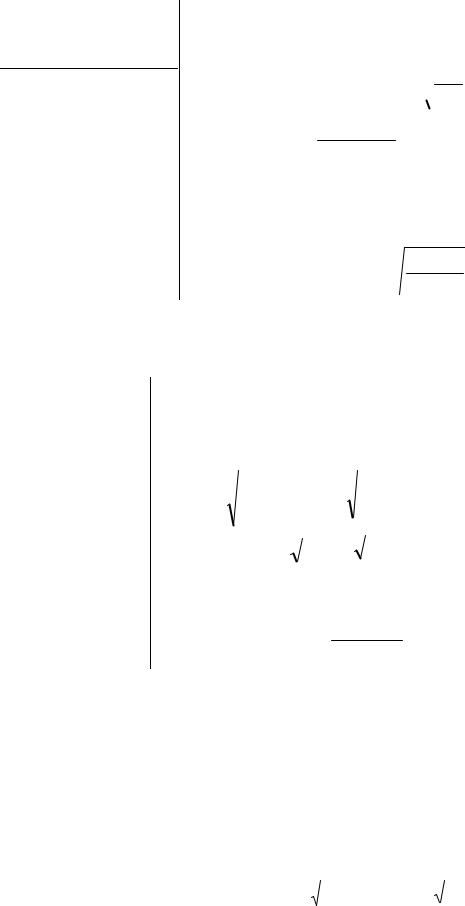
Дано:
ДРAgCl = 1,56×10–10
Визначити:
SAgCl – ?
[Ag+] – ?
Використовують формулу, яку виводять з
ДР = [Ag+]×[Cl– ];
[AgCl] = [Ag+] = [Cl– ] = x моль/л.
Таким чином, ДР = x2, x = 
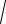 ДP . Підставивши значення в формулу маємо:
ДP . Підставивши значення в формулу маємо:
x = [Ag+] = 
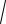 156, ×10−10 = 1,25×10–5 моль/л або 1,25×10–5 ×A(Ag+) =1,25×10–5 ×108 = 1,35×10–3 г/л.
156, ×10−10 = 1,25×10–5 моль/л або 1,25×10–5 ×A(Ag+) =1,25×10–5 ×108 = 1,35×10–3 г/л.
Розчинність солей з багатовалентними йонами типу АnBm визначають за формулою:
S = n+m ДP 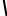 nn × mm
nn × mm
Задача 2. Вичислити розчинність CuS в 0,1 М розчині HCl та порівняти її з розчинністю у воді
Коротко записуємо умову
Дано: |
1. Напишемо йонне рівняння розчинення сульфіду |
|||||||||||||
ДРCuS = 3×10–38 |
купруму в кислоті: |
|
|
|
|
|
|
|||||||
KH S = K1 × K2 = |
|
|
CuS + 2H+ = Cu2+ + H2S. |
|||||||||||
2 |
2. З рівняння видно, що S = [Cu2+]; |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10–7 ×10–15 =10–22 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S( у HCl) = |
[H + ]2 × ДР |
= |
|
0,12 × 3 ×10−38 |
|
= 1,7×10–9 моль/л; |
||||||||
|
|
|||||||||||||
|
|
|
|
10−22 |
||||||||||
|
|
|
||||||||||||
Визначити |
|
|
KH2S |
|
|
|||||||||
SCuS –? |
|
|
|
|
|
=1,7×10–19 моль/л. |
||||||||
S(у Н2O) = |
|
|
|
= |
|
3 ×10−38 |
||||||||
ДР |
||||||||||||||
SCuS в HCl – ? |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.Розчинність CuS за наявності кислоти збільшується в 1010 разів:
1,7 ×10−9 =
1010
1,7 ×10−19
Задача 3. Вирахувати розчинність хлориду аргентуму в 1 М розчині гідроксиду амонію, порівняти з його розчинністю у воді.
Коротко записуємо умову задачі
|
Дано: |
|
1. Написати рівняння реакції хлориду аргентуму в |
|||||||||||
K |
н[Ag(NH ) |
+ = 7 ×10−8 |
|
аміаку: |
|
|
|
|
|
|
|
|
||
|
] |
|
AgCl + 2NH3 « [Ag(NH3)2]Cl « [Ag(NH3)2]+ + Cl– |
|||||||||||
|
3 |
2 |
|
|
||||||||||
ДРAgCl = 1,56×10–10 |
|
|||||||||||||
|
|
|
|
|
Кн. = |
|
ДРAgCl |
= |
1,56 ×10−10 |
=2,2×10–3 ; |
||||
|
|
|
|
|
|
Kн. Ag[(NH3)2] + |
|
7 ×10−8 |
|
= |
||||
|
|
|
|
|
||||||||||
SAgCl – ? |
|
|
|
SAgCl(I) = |
|
Kpівн. ×[NH3 ]2 |
= |
2,2 ×10−3 ×12 |
||||||
SAgCl у Н2О - ? |
|
|
|
|
= 4,69×10–2 моль/л. |
|||||||||
|
|
|
|
|
2. Розчинність AgCl у воді: |
|
|
|||||||
|
|
|
|
|
|
|
66 |
|
|
|
|
|
|
|
SAgCl у NH4ОH - ? |
SAgCl (ІІ) = |
|
= |
|
= 1,25×10–5 моль/л. |
|
1,56 ×10−10 |
||||
ДР |
3. Співвідношення розчинностей:
4,69 ×10−2 = 3,75×102 = 375 разів. 1,25×10−5
Відповідь: розчинність AgCl в 1 М розчині NH4OH зростає у 375 разів.
в) Задачі для самостійного розв’язання
1.Чи випаде осад сульфату кальцію при змішуванні 100 мл розчину, що містить 0,005 М хлориду кальцію, і 200 мл розчину, що містить 0,002 М
Na2SO4, ДР = 6,1×10–5 .
Відповідь: не випаде.
2.Розрахувати розчинність йодиду аргентуму в 1 М розчині гідроксиду амонію (ДРAgI = 1,7×10–16 , K[Ag(NH3 )2 ]+ = 7×10–8 ).
3.Обчислити розчинність оксалату кальцію в 0,1 н розчині соляної кислоти,
що містить 0,1 моль-екв/л HCl (ДР CaC 2 O 4 = 4×10–9 ; К H 2 C 2 O 4 = К1×К2 = 4×10–6 ).
Відповідь: 3,2×10–3 моль/л.
4.Розрахувати концентрацію йонів Цинку в 0,1 М розчині солі
[Zn(NH3)4]SO4, якщо константа нестійкості комплексного йона дорівнює 3,5×10–10 . Чи випаде в осад ZnS, якщо до розчину даної солі додати 0,01 М сульфіду натрію.
Відповідь: 2,65×10–5 моль/л; випаде.
4. Матеріал для аудиторної роботи
4.1. Обладнання для проведення заняття
Штативи, пробірки та необхідні реактиви, бюретки, колбочки для титрування.
4.2. Інтегральні зв’язки
Матеріал даної теми необхідний в аналітичній та фармацевтичній хімії при вивченні якісних реакцій на окремі йони та встановлення тотожності лікарських засобів.
4.3. Зміст і методика проведення заняття
а) Виклад основних теоретичних положень:
-суть поняття «добуток розчинності» та його використання для характеристики розчинності важкорозчинних солей;
-конкуруючі рівноважні процеси: осадження - розчинення, вплив однойменних йонів, утворення слабких електролітів, комплексних сполук;
-умови утворення та розчинення осадів;
-конкуруючі рівноваги в біологічних системах.
67
б) Перелік практичних вмінь та навичок:
−вміти прогнозувати утворення і розчинення осадів;
−вміти проводити розрахунки розчинності важкорозчинних електролітів;
−вміти проводити реакції з одержанням осадів, які використовують для відкриття окремих йонів.
4.4. Інструкції до виконання лабораторної роботи
4.4.1. Реакції з утворенням осаду
В одну пробірку налийте 3-4 см3 розчину купрум(ІІ) сульфату, у другу – стільки ж розчину кальцій хлориду, у третю – алюміній сульфату. В першу пробірку додати розчину натрій гідроксиду, у другу – натрій ортофосфату, а у третю – барій нітрату. Відмітити колір осадів та скласти рівняння реакцій.
4.2.2. Умова утворення осаду
У дві пробірки (з бюретки) налити по 2 мл розчину солі Кальцію з концентрацією 0,01 моль/л. В одну із пробірок додати 2 мл оксалату натрію, в другу – 2 мл сульфату натрію. Концентрація розчинів дорівнює 0,01 моль/л.
Відмітити й пояснити зміни, що відбуваються у пробірках, і заповнити таблицю.
|
Концентрація, моль/л |
|
|
|
|
||
до змішування |
після змішування |
ЙД |
ДР |
Спостереження |
|||
Катіон |
|
Аніон |
Катіон |
Аніон |
|
|
|
|
|
|
|
|
|
|
|
Са2+ |
|
С2O42– |
|
|
|
2,3×10–9 |
|
Са2+ |
|
SO42– |
|
|
|
2,5×10–5 |
|
4.2.3. Умови розчинення осадів в результаті хімічної взаємодії:
1)у дві пробірки внести по 3 краплі розчину аргентум нітрату. В одну додати 3 краплі розчину натрій карбонату, у другу – такий же об’єм натрій хлориду; до обох осадів додати по 4–5 крапель нітратної кислоти. Який із осадів розчинився і чому?
2)в одну пробірку внести 2 краплі розчину ферум(ІІ) сульфату, у другу – 2 краплі купрум(ІІ) сульфату. В кожну із них додати по 2 краплі розчину амоній сульфіду, а до осадів – по 5–7 крапель 2 н. розчину хлоридної кислоти. Який із сульфідів розчиниться і чому?
3)до 4–5 крапель розчину солі Меркуру(ІІ) додати краплями розчин калій йодиду до утворення осаду, відмітити колір і додати надлишок розчину калій йодиду. Що відбувається? Написати рівняння реакцій.
4.4.3 Вивчення впливу однойменного йона на розчинність малорозчинного електроліту
Внести в пробірку 3-4 краплі розчину нітрату плюмбуму, додати по краплях розчин хлориду натрію до утворення осаду. До вмісту пробірки прилити 1-2 мл дистильованої води до розчинення осаду, після чого додати
68
декілька крапель концентрованого розчину хлориду натрію. Відмітити зміни, що відбуваються в пробірці.
4.4.4 Зміщення гетерогенної рівноваги у напрямку утворення менш розчинної сполуки
В пробірку налити 2 мл розчину хлориду стронцію з концентрацією 0,5 моль/л і 2 мл насиченого розчину сульфату кальцію. Вміст пробірки нагріти до кипіння, потім охолодити. Описати зміни, що спостерігались. Заповнити таблицю.
|
Електроліт |
ДР |
Після змішування |
ЙД |
Спостереження |
|
|
C (SO42– ) |
C (Sr2+) |
||||
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
2,5×10–5 |
|
|
|
|
|
|
3,2×10–6 |
|
|
|
|
5.Підведення підсумків та зарахування роботи. |
||||||
Заняття № 14
Тема: Теорії кислот і основ. Дисоціація води. рН
1. Актуальність теми
Кислотно-основна рівновага – це важливий рівноважний процес, який часто зустрічаються у біології та медицині і значною мірою зумовлюють властивості розчинів. Підтримання кислотно-основної рівноваги в тканинах живих організмів і біологічних рідинах здійснюється багатьма фізіологічними механізмами, порушення яких веде до важких патологічних процесів. Кількісні характеристики К, рК, рН використовують для оцінювання якості розчинів лікарських препаратів та діагностики деяких захворювань, порівнюючи ці величини в нормі і патології.
2.Мета заняття
-знати значення рН для різних біологічних рідин людського організму в нормі і патології;
-вміти експериментально визначати величини рН;
-вміти розв’язувати ситуаційні задачі.
3.Матеріали доаудиторної самостійної роботи
3.1. Опрацювати матеріал навчальної програми
Теорії кислот і основ (Арреніуса, Брендстеда-Лоурі, Льюїса). Амфотерні електроліти (амфоліти). Кількісні характеристики сили кислот та основ.
69

Дисоціація води. Йонний добуток води. Характеристика кислотності середовища. Водневий та гідроксильний показники (рН та рОН) розчинів слабких та сильних кислот і основ.
3.1. Блок інформації
Згідно теорії електролітичної дисоціації Арреніуса кислотами називаються речовини, які дисоціюють з утворенням йонів Гідрогену за рівнянням:
HАn H+ + An–
Наприклад, процес дисоціації нітратної кислоти можна записати рівнянням:
HNO3 H+ + NO3–
Багатоосновні кислоти дисоціюють ступінчасто, тобто з поступовим відщепленням йонів Гідрогену:
H2SO4 H+ + HSO4– ;
HSO4– H+ + SO42– .
Основами називають речовини, які в процесі дисоціації утворюють гідроксид-іони ОН– :
KtOH Kt+ + OH–
Наприклад, рівняння дисоціації калій гідроксиду має такий вигляд: КОН К+ + ОН–
Багатокислотні основи дисоціюють ступінчасто: Са(ОН)2 Са(ОН)+ + ОН–
Са(ОН)+ Са2+ + ОН– Згідно протолітичної теорії кислот та основ Бренстеда-Лоурі кислотою
називають сполуку, яка віддає протони, тобто є донором протонів:
HАn H+ + An– , наприклад
HCN H+ + CN–
кислота протон основа
C6Н5ОН Н+ + C6Н5О–
кислота протон основа
Основою називають сполуку, яка приєднує протони, тобто є акцептором протонів:
В + Н+ = НВ+
Наприклад, карбонат-іон, згідно з протонною теорією, є основою, оскільки у водному розчині легко відбувається реакція
СО32– + Н+ НСО32–
основа протон кислота
CN– + H+ HCN
основа протон кислота
Згідно протолітичної теорії продуктами кислотно-основної взаємодії є не
70
