
Metod_Inorganic_chem_1_pharm_M-1_copy
.pdf
1.Записуємо математичні вирази рівняння швидкості – початкової v0 і кінцевої (після збільшення тиску) – v1:
v0 = k [NO]2 [O2]
v1 = k (5[NO])2×5[O2] = 53k [NO]2 [O2]
2. Поділимо друге рівняння на перше, і після скорочення одержимо: v1/v0 = 53 = 125.
Отже, швидкість зросте у 125 разів. Відповідь: швидкість зросте у 125 разів.
Задача 2. Чому дорівнює температурний коефіцієнт швидкості реакції, якщо при підвищенні температури на 60 0С швидкість реакції зросла у
1500 разів?
Дано:
Dt = 60 0C
vt  vt0 = 1500
vt0 = 1500
g – ?
1. Використовуємо рівняння Вант-Гоффа (7) і, розділивши його ліву і праву частину на v0, одержуємо:
t vt = γ 10 .
v0
Знаходимо g: 1500 = g60/10 = g6.
Прологарифмуємо одержаний вираз: |
|
lg1500 = 6 lgg, |
звідки: |
lgg = 3,176 = 0,529, 6
g = ant lg0,529 = 3,4.
Відповідь: g = 3,4.
Задача 3. Вирахувати значення енергії активації реакції, швидкість якої за температури 100 0С у 10 разів більша, ніж за 80 0С.
Дано: |
|
|
1. Енергію |
активації |
|
реакції |
визначимо |
за |
||||||||||
k2/k1 = 10 |
|
|
рівнянням |
Арреніуса, |
яке після |
інтегрування |
у |
|||||||||||
T1 =373 K |
|
|
межах від Т1 до Т2 записуємо так: |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
k |
|
|
2,303R |
|
|
|
||||
Еа – ? |
|
|
|
|
Ea = lg |
|
|
2 |
|
|
|
|
або |
|
||||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
k1 |
1 T1 -1 T2 |
|
|
|
||||||
|
|
|
|
|
|
|
Ea = |
2,303RT2T1 |
lg |
k2 |
|
|
||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
T2 − T1 |
k1 |
|
|||||
Підставимо значення: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Ea = |
2,303 ×8,31× 373× 353 |
lg10 = |
2,303×8,31× 373 × 353 |
=125,8 кДж/моль |
||||||||||||||
|
|
|||||||||||||||||
|
|
373 − 353 |
|
|
|
|
|
|
20 |
|
|
|
|
|
|
|||
Відповідь: Еа = 125,8 кДж/моль.
51
в) Задачі для самостійного розв’язання
1.За певної температури впродовж 10 год розклалось 30 % речовини АВ. Вважаючи, що реакція описується рівнянням константи швидкості першого порядку, обчисліть, за який час розкладеться 99% цієї речовини.
Відповідь: 6,66 год.
2.Яка маса радіонукліду 201Bi залишиться через 10 год від його початкової маси рівної 0,2 г, якщо період його напіврозпаду становить 2 години?
Відповідь: 6,2 мг
3.У скільки разів необхідно збільшити концентрацію реагуючих речовин в системі:
2Al + 3Cl2 = 2AlCl3, щоб швидкість реакції збільшилась у 74 рази? Відповідь: [Cl2] збільшити у 4,2 рази, [Al] – не впливає.
4.Обчислити енергію активації реакції, якщо константи швидкості цієї реакції за температур 273 і 280 К відповідно дорівнюють 4,04×10–5 і
7,72×10–5 с–1 .
Відповідь: Ea = 58,8 кДж/моль.
4.Матеріал для аудиторної роботи Зміст і методика проведення заняття
4.1.Перелік практичних завдань, які виконуються на практикумі.
4.1.1.Розглянути найважливіші питання теми:
-закон дії мас, поняття про константу швидкості реакції;
-порядок і молекулярність реакцій;
-вплив різних чинників на швидкість реакцій;
-енергія активації реакції;
-сучасні теорії гомогенного і гетерогенного каталізу;
-складні реакції і їх класифікація;
-ферменти, механізм їх дії.
4.2. Виконання лабораторної роботи
Вивчення впливу концентрації реагуючих речовин на швидкість хімічної реакції і визначення констант швидкості реакції.
Інструкції до виконання лабораторної роботи.
4.2.1. Залежність швидкості реакції від концентрації реагуючих речовин.
Досліджується швидкість реакції утворення сірки (помутніння розчину) за реакцією:
Na2S2O3 + H2SO4 = Na2SO4 + H2S2O3;
H2S2O3 = H2O + SO2 + S¯
Хід роботи. У 10 пронумерованих пробірок налити розчини – 1 М Na2S2O3, 1 M H2SO4 та води в об’ємах, наведених у таблиці 1:
52
Таблиця 1
Реактиви |
|
|
|
|
№ пробірки |
|
|
|
|
||
|
1 |
2 |
3 |
4 |
5 |
6 |
|
7 |
8 |
9 |
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Na2S2O3 |
1 |
|
2 |
|
3 |
|
|
4 |
|
5 |
|
H2O |
4 |
5 |
3 |
5 |
2 |
5 |
|
1 |
5 |
0 |
5 |
H2SO4 |
|
|
|
|
|
|
|||||
С (Na2S2O3), |
0,1 |
|
0,2 |
|
0,3 |
|
|
0,4 |
|
0,5 |
|
моль/л |
|
|
|
|
|
|
|
|
|
|
|
Час помутніння |
|
|
|
|
|
|
|
|
|
|
|
τ, с |
|
|
|
|
|
|
|
|
|
|
|
Умовна |
|
|
|
|
|
|
|
|
|
|
|
швидкість |
|
|
|
|
|
|
|
|
|
|
|
v = 1/τ |
|
|
|
|
|
|
|
|
|
|
|
Зливають попарно розчини з двох пробірок (1 та 2; 3 та 4 і т.д.), відзначають в секундах час утворення сірки. За формулою v = 1/τ обчислюють умовну швидкість реакції. Будують графік залежності швидкості реакції від концентрації і роблять висновок про вплив концентрації на швидкість реакції.
4.2.2. Визначення константи швидкості реакції гідролізу сахарози
Досліджується каталітична псевдомономолекулярна реакція
+
С12H22O11 + H2O ¾¾H ® C6H12O6 + C6H12O6,
глюкоза фруктоза
у якій беруть участь оптично-активні речовини, тобто ті, що повертають площину поляризації світла на певний кут: сахароза (a = +66,550), глюкоза (a = +52,550), фруктоза (a = –91,9 0). Сумарний кут обертання площини поляризації у процесі реакції зменшується і під кінець реакції стає від’ємним.
Хід роботи. Приготувати 30 г приблизно 10 % розчину сахарози, профільтрувати його і заповнити ним поляриметричну трубку. Виміряти кут обертання, після чого перелити цей розчин у мірний циліндр і долити такий самий об’єм 2 М розчину хлоридної кислоти, як каталізатора. Момент вливання кислоти відзначити секундоміром і записати цей час як початок реакції. Заповнити цим розчином поляриметричну трубку і виміряти кут обертання через 5, 10, 20, 35 та 60 хв від початку реакції. Результати вимірів записати в таблицю 2.
|
|
|
|
Таблиця 2 |
|
|
|
|
|
|
|
№ |
Час |
Час від |
Кут обертання, |
Константа |
|
астрономічний |
початку |
градуси |
швидкості |
|
|
п/п |
|
||||
(за годинником) |
реакції, τ, хв. |
|
реакції, k |
|
|
|
|
53 |
|
|
|

Щоб прискорити реакцію гідролізу і довести її до кінця, залишок реакційної суміші в колбі нагрівають на водяному нагрівнику впродовж 30 хв. за температури 60-70 0С. Після охолодження розчину вимірюють його кут обертання (α∞).
Обчислити константу швидкості реакції для кожного проміжку часу за формулою:
k= 2,303 lg α0 − α∞ ,
τατ − α0
де: α0 – кут обертання площини поляризації на початку реакції (кут обертання розчину сахарози без кислоти розділити на 2, оскільки розчин розводили кислотою у два рази);
ατ – кут обертання за даний час τ від початку реакції; α∞ – кут обертання після закінчення реакції.
Вирахувати середнє значення константи швидкості реакції і зробити висновок, від яких чинників залежить константа швидкості.
5. Підведення підсумків і зарахування теми.
Заняття № 11
Тема: Хімічна рівновага
1. Актуальність теми
Рівноважні процеси мають велике значення в хімії, біології і медицині, тому що багато хімічних реакцій є оборотними і відбуваються в бік досягнення певної рівноваги. До них належать процеси розчинення і кристалізації, дисоціації і молеризації, асиміляції та десиміляції, а також гідролітичне розщеплення жирів і білків в тканинах живого організму. Підтримання кислотно-основної та електролітної рівноваги в біологічних рідинах і тканинах здійснюється багатьма фізіологічними механізмами, порушення яких веде до патологічних змін.
Біологічні процеси, що відбуваються в тканинах живих організмів, поєднують між собою різні конкуруючі взаємодії, а саме: гетерогенну і протолітичні рівновагу, гетерогенну рівновагу і комплексоутворення, окисновідновні процеси та гідролітичний розклад тощо.
Вивчення даної теми дозволить провізору аналізувати послідовність перебігу конкуруючих процесів в організмі, зрозуміти причини порушення обміну речовин, що можуть відбуватися в живих системах.
2. Мета заняття
− знати теоретичні основи рівноважних процесів;
54
−знати їх кількісні характеристики та зв’язок між ними;
−вміти прогнозувати напрямок зміщення рівноваги;
−вміти проводити розрахунки констант і концентрацій та вирішувати ситуаційні задачі з даної теми;
3. Матеріали доаудиторної самостійної роботи
3.1. Засвоїти матеріал навчальної програми
Оборотні і необоротні хімічні реакції та стан хімічної рівноваги. Кількісна характеристика стану хімічної рівноваги.
Константа хімічної рівноваги та її зв’язок зі стандартною зміною енергії Гіббса. Принцип Ле Шательє-Брауна.
3.2. Література до теми
1.Левітін Є.Я., Бризицька А.М., Клюєва Р.Г. Загальна та неорганічна хімія. – Вінниця: Нова книга, 2003. – 464 с.
2.Практикум з загальної та неорганічної хімії / Є.Я.Левітін, Р.Г.Клюєва, А.М.Бризицька та ін. – Харків: Основа, 1998. – 119 с.
3.Загальна та неорганічна хімія: У 2-х ч./О.М.Степаненко, Л.Г.Рейтер,
В.М.Ледовских, С.В.Іванов. – К.: Пед. Преса, 2002.– Ч. І.– 520 с.;– Ч.ІІ.–
4.Романова Н.В. Загальна та неорганічна хімія. – Київ-Ірпінь, 1998. – Розділ
6.6, розділ 9.1.2.
5.Глінка Н.Л. Загальна хімія. – Л.,1985. – С.215-222.
6.Мороз А.С., Ковальова А.Г. Фізична та колоїдна хімія. – Львів: Світ, 1994.
– С.48-55.
7.Жаровський Ф.Г., Пилипенко А.Г., П’ятницький І.В. – К.: Вища школа, 1969. – С.49-64.
3.3. Матеріали для самоконтролю
а) Дати письмові відповіді на контрольні запитання
1. Навести вираз константи рівноваги для таких реакцій:
Fe2O3 + 3H2 2Fe + 3H2O (г) ; CaCO3 CaO + CO2
2.Фізичний зміст константи рівноваги. Чинники, що впливають на її величину, зв’язок з енергією Гіббса.
3. Як буде зміщуватися рівновага в системі: N2 + 3H2 2NH3; H = –92,4 кДж зі зміною температури, тиску, концентрацій N2 і Н2?
б) Алгоритми розв’ язування типових задач
Задача 1. Розрахувати рівноважні концентрації у системі
CO + H2O(г) CO2 + H2,
якщо вихідна суміш містила 2 моль СО, 3 моль H2O у розрахунку на 1 дм3 газової суміші. Константа хімічної рівноваги дорівнює 1.
Алгоритм розв’ язування
1.Для розв’язування задачі варто скористатися такою формою запису, позначивши через х – кількість молів речовини, що прореагували
55
Стан / концентрація |
СО |
Н2О |
СО2 |
Н2 |
Початкові концентрації (моль/дм3) |
2 |
3 |
– |
– |
Прореагувало (моль/дм3) |
х |
х |
– |
– |
Утворилися продукти реакції (моль/дм3) |
|
|
х |
х |
Рівноважна концентрація (моль/дм3) |
2– х |
3– х |
х |
х |
2.Записати константу рівноваги даної реакції і підставити знайдені значення концентрації речовин
K = |
[CO2 ] ×[H2 ] |
; 1 = |
x2 |
; х = 1,2 моль/дм3. |
[CO] ×[H2O] |
(2-x) × (3-x) |
|
||
Звідси, рівноважні концентрації речовин в моль/дм3 відповідно дорівнюють:
[CO] = 0,8; [H2O]= 1,8; [CO2] = 1,25; [Н2] = 1,2.
Задача 2. Розрахувати енергію Гіббса і визначити можливість перебігу реакції CO + Cl2 COCl2 при 700 К, якщо константа рівноваги реакції при цій температурі дорівнює 1,0685·10–4 . Парціальний тиск реагуючих речовин однаковий і дорівнює 101325 Па.
Алгоритм розв’ язування
1.Запишемо рівняння, що пов’язує зміну енергії Гіббса DG0 з константою рівноваги реакцій типу A + B C
|
|
DG0 = 2,3RT · lg |
PC |
– lg |
Kр. |
|
|
|
|
|
PA × PB |
|
|
||||
|
|
|
|
|
|
|
||
2. Підставимо числові значення у формулу |
|
|
|
|||||
DG |
0 |
= 2,3 · 8,314 · 700 · lg |
|
101325 |
– lg1,0685 · 10 |
–4 |
||
|
|
|
|
|
||||
|
|
101325 ×101325 |
|
|
||||
|
|
DG0 = –13,9 |
кДж. |
|
|
|||
Відповідь: DG0 = –13,9 кДж, реакція можлива, оскільки DG0 < O.
Задача 3. Вирахувати константу рівноваги процесу, який відбувається в тканинах живого організму: НАДН + Н+ НАД + Н2, де НАД+ і НАДН – окиснена і відновлена форми нікотинаміддинуклеотиду, якщо за стандартних умов зміна енергії Гіббса становить 18,2 кДж
|
Алгоритм розв’язування |
|
|
|
|
|
|
1. |
Записуємо математичне рівняння, яке пов’язує DG з Кр |
||||||
|
DG = – RT ln Kp |
або DG = –2,303 |
RT lg Kp |
||||
2. |
Знаходимо з цього рівняння lg Kp: |
|
|
|
|||
|
lg K = – |
DG |
= |
18,2 ×10 |
= |
–3,19; |
|
|
р |
2,3RT |
2,3 ×8,31 |
× 298 |
|
||
|
|
|
|
|
|||
3. |
Вираховуємо величину Кр: |
|
|
|
|
|
|
|
Kp = alg (–3,19) = alg 4,81 = 6,45 ×10–4 . |
||||||
|
|
|
|
56 |
|
|
|
Відповідь: Kp = 6,45×10–4 .
Задача 4. Вихідна концентрація хлору в системі Cl2 2Cl становить 0,04 моль/дм3. Обчислити константу рівноваги цього процесу, якщо 5
%молекулярного хлору розпалось на атоми.
1.Записуємо математичний вираз для розрахунку константи рівноваги Кр, даного процесу:
|
|
[Cl]2 |
Cl2 2Cl; |
Кр= |
p |
[Cl2 ]p |
2. |
Знаходимо концентрації в момент рівноваги (рівноважні концентрації). |
|||||
|
Якщо прореагувало |
5 |
% хлору, то це становить: 0,04·100/5=2×10–3 |
|||
|
моль/дм3, |
утворилось |
атомарного |
Хлору у 2 рази більше |
||
|
–3 |
-3 |
3 |
залишилось хлору 0,04 – 0,002 = 0,038 моль. |
||
|
2·2·10 =4·10 моль/дм , |
|||||
3. |
Обчисляємо Кр, підставивши значення у вираз константи рівноваги: |
|||||
|
|
|
|
Кр= |
(4 ×10−3 )2 |
= 4,2 ×10−4 |
|
|
|
|
|
||
|
|
|
|
0,038 |
|
|
Відповідь: Кр = 4,2× 10–4
в) Задачі для самостійного розв’язання
1.У стані рівноваги системи N2 + 3H2 2NH3 концентрації речовин дорівнють: [N2] = 3 моль/л; [H2] = 9 моль/л і [NH3] = 4 моль/л. Визначити константу рівноваги та вихідні концентрації водню і азоту.
Відповідь: К = 7,3.10-3; [H2] = 15 моль/л.
2. У гомогенній системі CO + Cl2 COCl2 рівноважні концентрації реагуючих речовин [CO] = 0,2 моль/дм3, [Cl2] = 0,3 моль/дм3, [COCl2] = 1,2 моль/дм3. Знайдіть константу рівноваги системи та початкові концентрації хлору та монооксиду вуглецю.
3.У гомогенній системі А + 2В С рівноважні концентрації [A] = 0,06 моль/дм3, [B]= 0,12 моль/дм3, [C] = 0,216 моль/дм3. Вирахувати константу рівноваги системи і початкові концентрації речовин А та В.
4.У гомогенній газовій системі A +B C + D рівновага встановилася при концентрації [B] = 0,05 моль/дм3 і [C] = 0,02 моль/дм3. Константа рівноваги системи дорівнює 0,04. Вирахувати початкові концентрації речовин А та В.
5.Визначіть температуру вище якої починається розклад Ca(OH)2 (впливом температури на ентальпію і ентропію знехтувати).
4. Матеріал для аудиторної роботи
4.1. Обладнання для проведення заняття
Штативи, пробірки та необхідні реактиви, бюретки, колбочки для титрування.
57
4.2. Інтегральні зв’язки
Матеріал даної теми необхідний в аналітичній та фармацевтичній хімії при вивченні якісних реакцій на окремі йони та встановлення тотожності лікарських засобів.
4.3. Зміст і методика проведення заняття
а) Виклад основних теоретичних положень:
−суть поняття «хімічна рівновага»;
−кількісна характеристика рівноваги, її фізичний зміст та зв’язок з енергією Гіббса (формулювання закону дії мас та аналіз рівняння ізотерми).
б) Перелік практичних вмінь та навичок:
− |
вміти складати вирази рівноваги для різних типів хімічних реакцій; |
− |
вміти обчислювати величину Кр за даними E та G. . |
4.4. Лабораторна робота.
4.4.1 Зміщення рівноваги у розчині амоніаку.
До розчину амоніаку додати 1–2 краплі фенолфталеїну. Забарвлений розчин розлити порівну в 4 пробірки. В першу додати трохи кристалічного амоній ацетату, в другу – розбавленого розчину HCl, третю нагріти до кипіння, а четверту залишити для порівняння. Спостерігати та пояснити, як впливає додавання CH3COONH4, HCl і нагрівання на зміщення рівноваги в системі амоніак– вода.
5.Підведення підсумків та зарахування роботи.
Заняття № 12
Тема: Теорія сильних і слабких електролітів
1. Актуальність теми
Рівноважні процеси в розчинах електролітів мають велике значення в хімії, біології і медицині. До них належать процеси розчинення і кристалізації, дисоціації і молеризації, асиміляції та десиміляції. Підтримання кислотно-основної та електролітної рівноваги в біологічних рідинах і тканинах здійснюється багатьма фізіологічними механізмами, порушення яких веде до патологічних змін.
2. Мета заняття
−знати теорію слабких і сильних електролітів;
−вміти розв’язувати ситуаційні задачі з даної теми.
58

3. Матеріали доаудиторної самостійної роботи
3.1. Засвоїти матеріал навчальної програми
Розвиток І.М. Каблуковим теорії електролітичної дисоціації С. Арреніуса. Поняття про сильні і слабкі електроліти. Теорія розчинів сильних електролітів. Йонна сила розчинів, коефіцієнт активності та активність йонів сильних електролітів в розчинах. Розчини слабких електролітів. Ступінь дисоціації. Залежність ступеня дисиціації від концентрації (закон розведення Оствальда). Застосування закону дії мас до дисоціації слабких електролітів. Константа дисоціації. Ступінчастий характер дисоціації.
3.2. Блок інформації
Деякі розчини, що називаються електролітами, взаємодіючи з полярними молекулами розчинника, розпадаються на протилежно заряджені частинки - йони і утворюють розчини, що проводять електричний струм. Розщеплення розчиненої речовини на йони під дією молекул розчинника називають електролітичною дисоціацією. За рахунок йон-дипольної взаємодії молекул розчинника з йонами електроліту утворюються сольватовані (гідратовані) йони.
Процес дисоціації є оборотним. Кількісною характеристикою повноти перебігу електролітичної дисоціації є ступінь дисоціації α - відношення числа молекул, що розпалися на йони ni до загального числа всіх молекул розчиненої речовини ∑ni
α= ni
∑ni
Залежно від ступеня дисоціації електроліти поділяють на сильні і слабкі. Сильні електроліти в розбавлених водних розчинах дисоціюють практично повністю, тобто необоротно. До них відносяться сильні кислоти, луги, а також усі розчинні солі. Слабкі електроліти в розчинах дисоціюють частково, тобто процес їх дисоціації є оборотним. Для слабких електролітів 0 < α << 1.
Важливою характеристикою процесу дисоціації слабких електролітів є константа дисоціації КД. Для бінарного електроліту процес дисоціації можна записати
КА К+ + А–
Тоді константа дисоціації цього електроліту матиме вигляд
К= [K + ]×[A− ].
Д[KA]
Константа дисоціації слабких електролітів пов’язана зі ступенем дисоціації законом розведення Оствальда
К Д = α 2 × CM ,
1 - α
де CM - молярна концентрація слабкого електроліту, моль/л.
59

Враховуючи, що для слабких електролітів ступінь дисоціації значно менша за одиницю (α << 1 ), закон розведення Оствальда має наступний вигляд
α = |
К Д . |
|
СМ |
|
|
Для характеристики розчинів сильних електролітів замість концентрації йонів використовують їх активність.
Активність йонів – це ефективна концентрація йонізованoї частини електроліту в розчині з урахуванням міжйонної взаємодії.
Зв’язок між активністю а і концентрацією С
а = fC,
де а – активність, f – коефіцієнт активності.
У розбавлених розчинах сильних електролітів логарифм коефіцієнта активності обернено пропорційний кореню квадратному з йонної сили
log f = A 
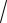 I
I
де А – стала величина, яка залежить від заряду йонів, температури та діелектричної проникності розчину.
Для бінарних електролітів за температури 298 К log f = – 0,5Z 2 
 I
I
3.3. Література до теми
1.Левітін Є.Я., Бризицька А.М., Клюєва Р.Г. Загальна та неорганічна хімія. – Вінниця: Нова книга, 2003. – 464 с.
2.Практикум з загальної та неорганічної хімії / Є.Я.Левітін, Р.Г.Клюєва, А.М.Бризицька та ін. – Харків: Основа, 1998. – 119 с.
3.Загальна та неорганічна хімія: У 2-х ч./О.М.Степаненко, Л.Г.Рейтер,
В.М.Ледовских, С.В.Іванов. – К.: Пед. Преса, 2002.– Ч. І.– 520 с.;– Ч.ІІ.–
4.Романова Н.В. Загальна та неорганічна хімія. – Київ-Ірпінь, 1998. – Розділ
6.6, розділ 9.1.2.
5.Глінка Н.Л. Загальна хімія. – Л.,1985. – С.215-222.
6.Мороз А.С., Ковальова А.Г. Фізична та колоїдна хімія. – Львів: Світ, 1994.
– С.48-55.
7.Жаровський Ф.Г., Пилипенко А.Г., П’ятницький І.В. – К.: Вища школа, 1969. – С.49-64.
3.4. Матеріали для самоконтролю
а) Дати письмові відповіді на контрольні запитання
1.У чому полягає суть і недостатність теорії електролітичної дисоціації Ареніуса?
2.Механізм електролітичної дисоціації молекул з йонним та ковалентним зв’язками.
60
