
- •Загальна характеристика елементів VI а групи
- •Оксиген
- •Ступені окиснення оксигену
- •Кисень можна добути:
- •Хімічні властивості молекулярного кисню:
- •Деякі схеми реакцій в які вступає кисень та його сполуки
- •Елементи підгрупи сульфуру
- •Деякі властивості елементів підгрупи сульфуру
- •Сірка в природі
- •Ступені окиснення елементів підгрупи сульфуру
- •Гідриди елементів підгрупи сульфуру
- •Хімічні властивості h2s і h2Se
- •Сполуки сульфуру, селену і телуру з оксигеном
- •Хімічні властивості оксидів сульфуру
- •Добування сульфатної кислоти
- •Деякі схеми реакцій в які вступають елементи підгрупи сульфуру та їх сполуки
- •1.Загальна характеристика елементів VI а групи.
- •2. Оксиген, його модифікації: способи добування, властивості.
- •3. Сульфур та його аналоги: властивості елементів та їх сполук.
Деякі властивості елементів підгрупи сульфуру
|
Елемент, атомний номер |
Будова зовнішньої оболонки |
Радіус, нм |
Поширеність | ||||
|
|
|
ізольованих атомів Е0 |
Іонів Е2– |
іонів Е6+ |
Кларк (мас.,%) |
Порядковий номер | |
|
16S |
3s23p43d0 |
0.09 |
0.174 |
0.03 |
0.1 |
14 | |
|
34 Se |
3d10 4s24p44d0 |
0.12 |
0.191 |
0.035 |
8×10–5 |
62 | |
|
52 Te |
4d10 5s25p45d0 |
0.133 |
0.211 |
0.056 |
1×10–6 |
79 | |
|
84Po |
4f14 5d10 6s26p46d0 |
0.164 |
– |
0.089 |
– |
– | |
|
Елемент, атомний номер |
Кількість стабільних ізотопів |
Характерні ступені окиснення |
Найважливіші мінерали |
|
16S |
32S –95% 33S 34S 36S |
+6; +4; 0; –2 |
S8– самородна сірка; FeS2, PbS,ZnS та інші сульфіди; MgSO4, CaSO4 у морській воді |
|
34 Se |
74Se, 76Se, 77Se 78Se, 80Se, 82Se |
+6; +4; 0; –2 |
селеніди МSe (що супроводжують сульфіди) |
|
52 Te |
124Te,125Te,126Te 128Te, 130Te та ін. |
+6; +4; 0; –2 |
телуриди МTe (що супроводжують сульфіди) |
|
84Po |
всі ізотопи радіоактивні, найстійкіший 21084Ро |
+4; 0; +2 |
в продуктах розпаду урану |
Сірка в природі
|
Біологічна роль |
Поширеність |
Геологічні відомості |
|
Важлива для всіх живих організмів. Вміст в людському організмі: м’язи – 5 - 1.1%; кістки – 0.05 - 0.24% кров – 1800 мг/л. Щоденна доза прийому – 850-930 мг. Токсична доза: мінімальна. Вміст в організмі середньої людини (маса тіла 70 кг): 140 г. |
Сонце (відносно Н = 1×1012): 1.6×107. Земна кора: 2.6×10–2%. Морська вода: 8.7×102–,%. Час перебування: 8×106 років. |
Основні джерела: самородна сірка, сульфідні руди металів. Світове виробництво:54×106 т/рік |
Ступені окиснення елементів підгрупи сульфуру
|
|
Елемент і ст. ок. |
Сполуки |
Елемент і ст. ок. |
Сполуки | ||||
|---|---|---|---|---|---|---|---|---|
|
S–2 |
H2S, S2–, Sn2– |
Se–2 |
H2Se |
| ||||
|
S–1 |
H2S2 |
Se0-1 |
Кластерні катіони, наприклад Se42+ |
| ||||
|
S0 |
S6, S8 |
Se+1 |
Se2Cl2 |
| ||||
|
S+1 |
S2O, S2F2,, S2Cl2 |
Se+2 |
? |
| ||||
|
S+2 |
SF2, SCl2 |
Se+4 |
SeO2, H2SeO3, SeO32–, SeOF2, |
| ||||
|
S+3 |
Na2S2O4 |
|
SeOBr2, SeCl4, |
| ||||
|
S+4 |
SO2, SO32–, SF4, SOCl2 |
|
SeBr4, SeBr62–, SeOCl2 |
| ||||
|
S+5 |
Na2S2O6 |
Se+6 |
SeO3, H2SeO4, SeO42–, SeO2F2, |
| ||||
|
S +6 |
SO3, H2SO4, HSO3F |
|
SeF6 |
| ||||
Властивості сполук елементів підгрупи сульфуру складу Н2Е змінюються в групі монотонно, а властивості сполук з оксигеном, навпаки, проявляють вторинну періодичність.
Звичайна
модифікація твердої сірки у вузлах
кристалічної структури містить молекули
S8,
будова яких нагадує правильну геометричну
фігуру
 .
Вона утворює дві кристалічні модифікації,
які існують при кімнатній температурі.
Це ромбічна і моноклінна сірка. Інакше
їх називаютьa-
і b-формою
відповідно. Точка переходу ромбічної
сірки в моноклінічну лежить при 950С.
Хоч a-
і b-форми
мають однаковий молекулярний склад S8,
вони в процесі кристалізації утворюють
дещо відмінні кристалічні структури.
Це яскравий приклад поліморфізму.
.
Вона утворює дві кристалічні модифікації,
які існують при кімнатній температурі.
Це ромбічна і моноклінна сірка. Інакше
їх називаютьa-
і b-формою
відповідно. Точка переходу ромбічної
сірки в моноклінічну лежить при 950С.
Хоч a-
і b-форми
мають однаковий молекулярний склад S8,
вони в процесі кристалізації утворюють
дещо відмінні кристалічні структури.
Це яскравий приклад поліморфізму.
Температура плавлення призматичної сірки рівна 119.30С. Якщо повільно нагрівати сірку, то вона з ромбічної переходить в призматичну і повільно плавиться при температурі 119.30С. При швидкому нагріванні сірки спостерігається процес розплавлення ромбічної сірки.
Зміни, що проходять при нагріванні сірки
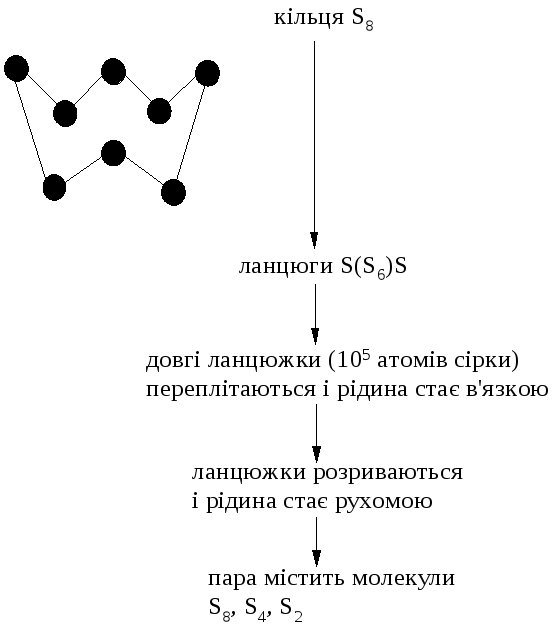
Молекули S8 при звичайних умовах мають кільцеву структуру. Всередині молекули S8 атоми сірки зв’язані один з одним зигзагоподібними розміщеними ковалентними одинарними зв’язками. Кільцеві молекули S8 при підвищеній температурі розриваються перетворюючись в ланцюжки S8. Атоми сусідніх ланцюгоподібних молекул S8 взаємодіють один з одним значно сильніше, ніж атоми сусідніх кільцеподібних молекул S8.
Якщо в пароподібній сірці при температурі її кипіння (444.60С) переважають лінійні молекули S8 (крім того присутні молекули S6, S4 і дуже мало S2), то при 6000С переважає форма S6, а при 9000С – S2. Газоподібна сірка при 20000С складається виключно із атомів.
При повільному охолодженні сірки протікають всі ті перетворення (в зворотному порядку), які спостерігалися при її нагріванні.
Крім двох вищезгаданих модифікацій сірки відома аморфна сірка, що виділяється, як правило, з розчинів, в яких протікають хімічні перетворення сульфурвмісних сполук. Наприклад, аморфна сірка утворюється при дії на розчин натрій тіосульфату сульфатної кислоти:
Na2S2O3 + 2H2SO4 ® [H2S2O3] + 2NaHSO4
[H2S2O3] ® S + SO2 + H2O
S2O32– + 6H+ + 4e ® 2S + 3H2O
S2O32– + H2O – 4e ® 2SO2 + 2H+
2 S2O32– + 4H+ ® 2S + 2SO2 + 2H2O
Встановлено, що аморфна сірка складається з молекул S6 і S8.
Хімічні властивості сульфуру, селену і телуру
Елементи підгрупи сульфуру, взаємодіють із різними металами:
Cu + S ® CuS + Q
S + Fe ® FeS
Елементи групи активно взаємодіють з неметалами. Внаслідок пропускання парів сірки над вуглецем утворюється сірковуглець:
S + C ® CS2
S + 6F ® SF6
Реакція сірки з фтором проходить бурхливо з утворенням SF6, який використовується як газоподібний діелектрик і джерело атомарного фтору.
Сірка хімічно активніша, ніж селен.
S + O2 ® SO2 + Q
Se + O2 ® SeO2 + Q
