
- •Загальна характеристика елементів VI а групи
- •Оксиген
- •Ступені окиснення оксигену
- •Кисень можна добути:
- •Хімічні властивості молекулярного кисню:
- •Деякі схеми реакцій в які вступає кисень та його сполуки
- •Елементи підгрупи сульфуру
- •Деякі властивості елементів підгрупи сульфуру
- •Сірка в природі
- •Ступені окиснення елементів підгрупи сульфуру
- •Гідриди елементів підгрупи сульфуру
- •Хімічні властивості h2s і h2Se
- •Сполуки сульфуру, селену і телуру з оксигеном
- •Хімічні властивості оксидів сульфуру
- •Добування сульфатної кислоти
- •Деякі схеми реакцій в які вступають елементи підгрупи сульфуру та їх сполуки
- •1.Загальна характеристика елементів VI а групи.
- •2. Оксиген, його модифікації: способи добування, властивості.
- •3. Сульфур та його аналоги: властивості елементів та їх сполук.
Деякі схеми реакцій в які вступає кисень та його сполуки
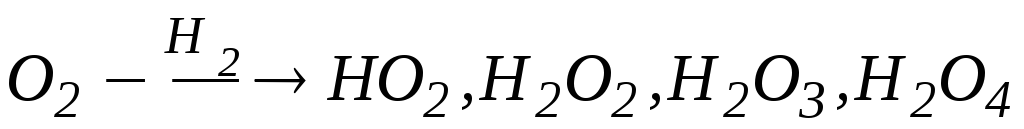 (t=–1940C,
електрич.
розряд)
(t=–1940C,
електрич.
розряд)O2 + 4Fe(OH)2(суспензія) 4FeO(OH) + 2H2O
O2 + 4Cr(OH)2 + 2H2O 4Cr(OH)3
O2 + H2SO4(розв) + Pb PbSO4 + H2O2
O2 + 4H2O + 2TiCl3 + 2HCl H2O2 + 2H2[TiCl4(OH)2]
O2 + HemFe [HemFe O=O] (Hem – гем-група гемоглобіну крові)
O3 O2 + [O] (УФ-промені)
O3 + H2O2 2O2 + H2O
2O3 + 2H0 2HO2 + O2 (–1960С, домішки)
O3 + 4NH3 + Li [Li(NH3)4]O3 (t=–400C)
O3 + H2O + 2KJ J2 + O2 + 2KOH
3O3 + KJ KJO3 + 3O2
O3 + H2S(g) SO2 + H2O
4O3 + 3PbS 3PbSO4
O3 + Mn(NO3)2 + H2O MnO2 + O2 + 2HNO3
H2O22H2O(т) H2O2 + 2H2O
H2O2 + NaOH NaOH2 + H2O
2H2O2(гарячий) + H2O + 2LiOH Li2O2H2O23H2O (в етанолі)
H2O2 + H2SO4 + 2KJ J2 + 2H2O + K2SO4
H2O2 + H2SO4 + 2FeSO4 Fe2(SO4)3 + 2H2O
4H2O2 + PbS PbSO4 + 4H2O
3H2O2 + 2Na3[Cr(OH)6] 2Na2CrO4 + 8H2O + 2NaOH
2H2O2 + N2H4 N2 + 4H2O
H2O2 + Ag2O 2Ag + O2 + H2O
H2O2 + 2Hg(NO3)2 O2 + Hg2(NO3)2 + 2HNO3
3OF2 + 4NH3 3H2O + 6HF + 2N2 (t=2000C)
2OF2 + F2 + N2H4 2NF3 + 2H2O (t=1500C)
OF2 + 2NaOH O2 + 2NaF + H2O
1. Відомо, що Н2О2 є кровозупинним засобом. Окрім того, його використовують для лікування відкритих ран. Він збагачує кров хворого киснем О2 безпосередньо біля пошкодженого місця тіла: 2Н2О2 ® 2Н2О + О2. Після хірургічної обробки рани пацієнту дають ін’єкції 0.01%-го розчину Н2О2, вводячи його в артерії, які постачають кров пошкодженим органам.
2.Відомо, що аквалангісти, виконуючи роботу на великих глибинах, дихають не стиснутим повітрям і не чистим киснем, а киснево-гелієвою сумішшю. Це пов’язано з тим, що на глибині 100м у суміші, що вдихається, допускається не більше 2-6% О2, а на глибині 200м – лише 1-3% О2 (при звичайному тиску вміст О2 не повинен бути меншим 16%, інакше наступає кисневе голодування). Залишковий об’єм займає газ-розбавлювач. В земній атмосфері це азот. Але на великих глибинах він викликає «азотний наркоз» (кесонну хворобу), який нагадує алкогольне сп’яніння. Тому беруть гелій – хімічно інертний газ, без кольору, запаху, смаку. Гелій не шкодить людині і на великих глибинах не викликає наркотичних явищ. Проте гелій робить людську мову нерозбірливою, схожою на крякання.
3. На живі організми токсичну дію викликає не молекулярний кисень О2, а його похідні: озон О3, збуджені молекули кисню О2*, радикал гідроксил ОН, О22–, О2–, так звані активні форми кисню, які утворюються в процесах обміну речовин і біологічного окиснення.
4. Вважають, що зелені рослини в результаті фотосинтезу виділяють майже шість тон кисню на кожну тону кисню, поглинуту ними при диханні. Причому, 80% кисню передають в атмосферу водорості морів і океанів, так званий фітопланктон, і лише 20% – наземні рослини. Тому океан часто називають легенями Землі. Кисень виділяється в процесі фотосинтезу, загальне рівняння якого:
6СО2 + 6Н2О С6Н12О6 + 6О2.
Елементи підгрупи сульфуру
В підгрупу сульфуру входить чотири елементи: сульфур (16 S), селен (34Se), телур (52Te), полоній (84Po). Полоній відкрило подружжя Кюрі майже одночасно з радієм при дослідженні уранових руд із родовища Яхимів. Довгий час полоній був відомий, як один з продуктів перетворення радію, і тому, отримували лише невеликі його кількості. Для полонію не знайдено стабільних ізотопів. Для найстійкішого ізотопу полонію 21084 Po період піврозпаду Т1/2=138 днів. Зараз полоній і його похідні отримують методами ядерної фізики в кілограмових кількостях (у формі різних сполук). Він використовується як джерело монохроматичного a-випромінювання.
