
- •1. Основные реакции обмена аминокислот:
- •1.1. Реакции на радикал:
- •Нарушение функции фенилаланин гидроксилазы – причина фенилкетонурии.
- •2. Реакции на карбоксильную группу:
- •3. Реакции на аминогруппу:
- •Непрямое дезаминирование - основной путь дезаминирования аминокислот.
- •Коферментные функции в трансаминазах выполняет активная форма витамина b6.
- •2. Аммиак, пути его образования и механизмы токсичности.
- •2.1.Пути детоксикации аммиака:
- •Синтез карбамоилфосфата – ключевая реакция синтеза мочевины
- •1.3 Врожденные дефекты ферментов цсм, основные клинические проявления.
2.1.Пути детоксикации аммиака:
а) восстановительное аминирование;
б) образование амидов (глн и асн);
в) аммониогенез;
г) биосинтез мочевины,
реакции, ферменты, локализация, биологическая роль цикла синтеза мочевины (ЦСМ). Энергетическая емкость ЦСМ. Связь ЦСМ с ЦТК и обменом аминокислот. Роль ЦСМ в регуляции КОС.
Пути обезвреживания аммиака:
1. Восстановительное аминирование.
+NH3; НАДФ.H2
альфа-КТК ------------------------------> глутамат
-HOH; -НАДФ+
ГДГ
2. Образование амидов дикарбоновых кислот:
NH3; АТФ
ГЛУ -------------------> ГЛН
Глутамин-
синтетаза
NH3; АТФ
АСП ------------------> АСН
Аспарагин-
синтетаза
Поскольку ГЛН и АСН выделяются с мочой в небольших количествах, то они являются транспортными формами аммиака.
3. Аммониогенез
Основная масса ГЛН (и АСН) захватывается почками, где под влиянием глутаминазы от него отщепляется аммиак. Потом аммиак реагирует с H+ и дает ион аммония NH4+, который экскретируется с мочой. При ацидозе экскреция NH4+ с мочой возрастает, т.к. ацидоз активирует глутаминазу и она активнее отщепляет аммиак от ГЛН, который в свою очередь активнее захватывает H+ и тем самым и тем самым ликвидирует ацидоз.
Кроме того при ацидозе происходит потеря Na+ и K+ с мочой. Это приводит к понижению осмотического давления и обезвоживанию ткани. Но этот процесс не развивается благодаря образованию NH4+, который обладает близкими физико-химическими свойствами к свойствам Na+ и K+ и тем самым как бы замещает их, предотвращая нарушение водно-электролитного баланса.
Аналогичный процесс может происходить при отщеплении NH3 от АСП под действием аспарагиназы.
Биосинтез мочевины.
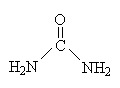 Биосинтез
мочевины - основной механизм обезвреживания
аммиака в организме. 90% азота из организма
выводится в виде мочевины, причем в
норме количество экскретируемой мочевины
зависит от количества потребленного
белка и обычно составляет 25-30 г в сутки.
Биосинтез
мочевины - основной механизм обезвреживания
аммиака в организме. 90% азота из организма
выводится в виде мочевины, причем в
норме количество экскретируемой мочевины
зависит от количества потребленного
белка и обычно составляет 25-30 г в сутки.
Печень - единственный орган, клетки которого содержат все ферменты синтеза мочевины и, следовательно, являются главным местом синтеза мочевины в организме. Ферменты, участвующие в ее синтезе расположены в митохондриях и цитозоле. Синтез мочевины – пример циклического метаболического пути. Расходуются в процессе мочевинообразования аспарагиновая кислота и ион аммония (источники аминогрупп молекулы мочевины), диоксид углерода (из бикарбоната) и АТФ. Синтез 1 моля мочевины требует 3 молей АТФ.
Синтез карбамоилфосфата – ключевая реакция синтеза мочевины
К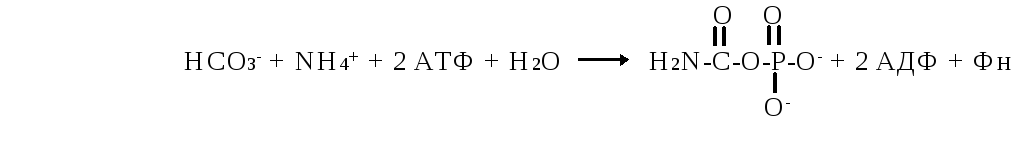 арбамоилфосфат
синтезируется в митохондриях в комплексной
реакции, которая катализируетсякарбамоилфосфат
синтетазой
I.
Этот аллостерический фермент активируется
N
–ацетилглутаминовой кислотой. Потребление
2 молекул АТФ делает синтез карбамоил-фосфата
необратимой реакцией.
арбамоилфосфат
синтезируется в митохондриях в комплексной
реакции, которая катализируетсякарбамоилфосфат
синтетазой
I.
Этот аллостерический фермент активируется
N
–ацетилглутаминовой кислотой. Потребление
2 молекул АТФ делает синтез карбамоил-фосфата
необратимой реакцией.
Карбамоилфосфат синтетаза I (КФС-1) катализирует образование карбомоилфосата в митохондриях. Из цитозоля выделена карбомоилфосфатсинтетаза-2 (КФС-2), которая катализирует образование карбомоилфосфата, используемого для синтезе пиримидиновых нуклеотидов.
Образование цитруллина происходит благодаря использованию высокоэнергетического фосфата карбамоилфосфата и катализируется орнитин-карбамоил трансферазой (ОКТ). Продукт реакции цитруллин транспортируется в цитозоль, где завершается образование мочевины.
Мочевина - природный антиоксидант (радиопротектор).
Энергетическая емкость ЦСМ.
Суммарная реакция синтеза мочевины:
А спарагиновая
кислота + NH3
+ CO2
+ 3АТФ + 2 H2O
спарагиновая
кислота + NH3
+ CO2
+ 3АТФ + 2 H2O
 мочевина +
фумарат + 2АДФ + АМФ + 2Фн + ФФн
мочевина +
фумарат + 2АДФ + АМФ + 2Фн + ФФн
На синтез одной молекулы мочевины расходуется 4 макроэргических связи 3-х молекул АТФ:
2 АТФ – на стадии синтеза корбомоилфосфата и одна АТФ – на стадии синтеза аргинино-сукцината (если учитывать, что в данной реакции образуется АМФ, то можно считать энергозатраты этой реакции равной 2 АТФ, т.е. энергетическая емкость ЦСМ равна 4 АТФ).
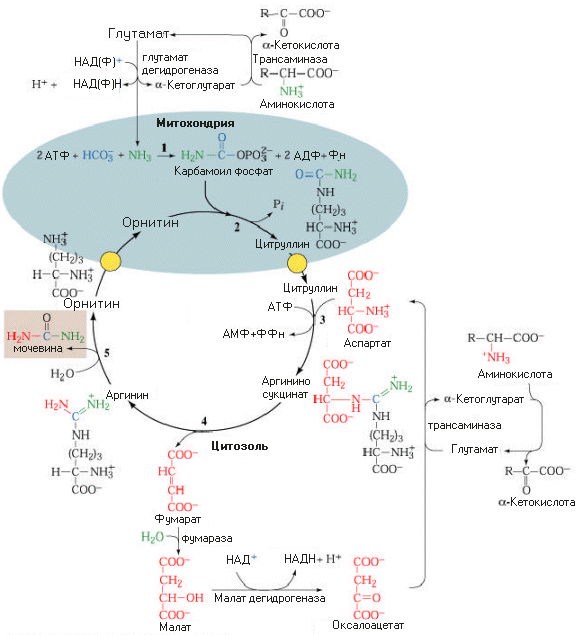
Биологическая роль ЦСМ.
Механизм детоксикации NH3.
Механизм регуляции КЩС
ЦСМ - поставщик орнитина.
Имея митохондриальную локализацию, регулирует потоки а/к по различным путям ---------> ГНГ, биосинтез белка, липогенез.
Между циклом мочевинообразования и циклом трикарбоновых кислот устанавливается тесная связь на уровне субстратов
Связь ЦСМ с ЦТК и обменом аминокислот (цикл Кребса-Гензелейта ("трехколесный велосипед").

Ферменты: 1 - карбамоилфосфатсинтетаза-1. │
2 - карбамоилфосфаттрансфераза. │ ферменты
3 - аргининосукцинатсинтетаза. │ ЦСМ
4 - аргининосукцинатлиаза. │
5 - аргиназа. │
6 - фумараза. │ ферменты
7 - малатдегидрогеназа │ ЦТК
8 - АсАТ│ ферменты
9 - ГДГ │ обмена а/к
Регуляция ЦСМ.
1. Краткосрочная: на уровне 1-го фермента, который вместе с 8-ым направляет азот ГЛУ (а значит и всех а/к) в карбамоилфосфат.
2. Долгосрочная: определяется уровнем липолиза, Ац-КоА. Ац-КоА при недостатке углеводов, является наиболее предпочтительным субстратом, чем липиды.
Косвенные доводы позволяют предположить, что углеводы и белки (а/к) способны полностью обеспечить энергетический потенциал клетки.
Врожденные дефекты ферментов ЦСМ, основные клинические проявления.
Дефицит ферментов орнитинового цикла встречается в популяции с частотой 1 случай на 25000 новорожденных и начинает проявляться в неонатальный период. К настоящему времени описаны врожденные дефекты каждого фермента, участвующего в синтезе мочевины. Все дефекты (за исключением дефицита аргиназы) сопровождаются тяжелой гипераммониемией. Высокий уровень аммиака оказывает токсическое действие на центральную нервную систему. Не поддающаяся лечению гипераммонийемия завершается тяжелым нарушениями психики.
Роль ЦСМ в регуляции КОС.
