
- •1. Основные реакции обмена аминокислот:
- •1.1. Реакции на радикал:
- •Нарушение функции фенилаланин гидроксилазы – причина фенилкетонурии.
- •2. Реакции на карбоксильную группу:
- •3. Реакции на аминогруппу:
- •Непрямое дезаминирование - основной путь дезаминирования аминокислот.
- •Коферментные функции в трансаминазах выполняет активная форма витамина b6.
- •2. Аммиак, пути его образования и механизмы токсичности.
- •2.1.Пути детоксикации аммиака:
- •Синтез карбамоилфосфата – ключевая реакция синтеза мочевины
- •1.3 Врожденные дефекты ферментов цсм, основные клинические проявления.
3. Реакции на аминогруппу:
а) виды дезаминирования (окислительное, восстановительное, гидролитическое, внутримолекулярное), их медико-биологическое значение;
б) прямое окислительное дезаминирование – механизм, ферменты, коферменты, биологическое значение;
в) реакции переаминирования – ферменты, коферменты, биологическое значение;
г) непрямое окислительное дезаминирование – механизм, ферменты, коферменты, биологическое значение.
Виды дезаминирования
Возможны четыре механизма прямого дезаминирования:

Окислительное дезаминирование (см. ниже)
Восстановительное дезаминирование характерно для микроорганизмов, гидролитическое – для аспарагина и глутамина (в результате образуются аспартат и глутамат), внутримолекулярное – для гистидина (с образованием урокаиновой кислоты). Прямое окислительное дезаминирование характерно для глутаминовой кислоты:
Прямое окислительное дезаминирование
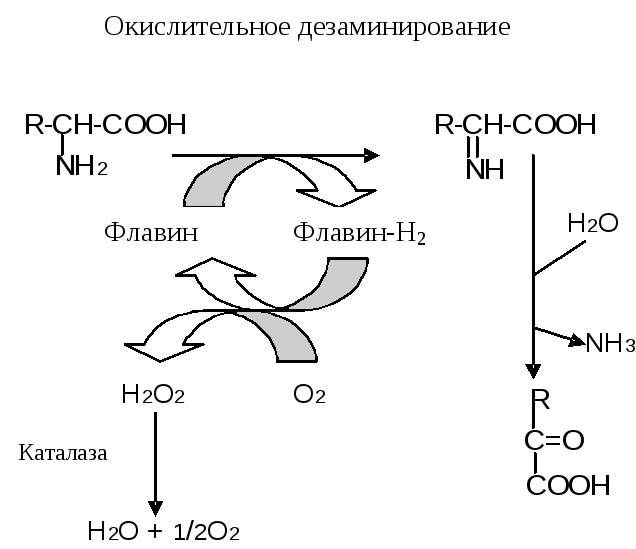
Окислительное дезаминирование некоторых аминокислот катализируется флавин-зависимыми дегидрогеназами. Они названы оксидазами аминокислот из-за их способности использовать в качестве конечного акцептора водородов молекулярный кислород с образованием при этом пероксида водорода.
В окислительном дезаминировании первая стадия является ферментативной с образованием промежуточного продукта - иминокислоты, которая спонтанно, без участия фермента, распадается на аммиак и альфа-кетокислоту.
Этот тип реакций наиболее распространен в тканях.
Прямое окислительное дезаминирование характерно для глутаминовой кислоты:

Первая стадия катализируется ферментом глутаматдегидрогеназой (анаэробный фермент). Вторая стадия протекает спонтанно. Реакция обратима: ----> окислительное дезаминирование, <---- восстановительное аминирование.
ГДГ - регуляторный, аллостерический фермент с молекулярной массой 312 кД, состоящий из 6 субъединиц, аллостерическими ингибиторами фермента являются АТФ, ГТФ и НАДН+Н+, а активатором является АДФ. ГДГ, обладает высокой активностью. ГДГ локализована в митохондриях и может использовать в качестве кофермента НАД или НАДФ. Работой этого фермента завершается непрямое дезаминирование многих аминокислот и аммиак, высвобождаемый в этой реакции, протекающей в печени, используется для синтеза мочевины.
![]()
Этот фермент катализирует и обратную реакцию, обеспечивая аминирование альфа-кетоглутаровой кислоты свободным аммиаком, что важно в механизмах обезвреживания аммиака и позволяет использовать азот аммиака для синтеза аминокислот.
Т. о. ГДГ выполняет следующие функции:
Осуществляет связь а/к обмена с ЦТК через альфа-КТК.
Обеспечивает связывание аммиака.
Обеспечивает синтез всех заменимых а/к.
Обеспечивает перекачку протонов с НАДН на НАДФН
Все остальные а/к могут окисляться и дезаминироваться только непрямым путем (т. е. через дополнительную стадию трансаминирования)
Механизм трансаминирования:
Непрямое дезаминирование - основной путь дезаминирования аминокислот.

Большинство аминокислот теряют свою аминогруппу не путем описанного выше прямого дезаминирования, а передают аминогруппу на кетокислотный акцептор. Эти реакции катализируются группой ферментов, получивших название трансаминаз. Коферментом их является пиридоксальфосфат. Это главный путь удаления азота у аминокислот. Выделены трансаминазы, катализирующие переаминирование большинства аминокислот. После поступления пищевых аминокислот из воротной вены, например, значительная часть их в печени подвергается переаминированию. Исключением являются аминокислоты с разветвленным углеводородным радикалом, для которых в печени нет соответствующих трансаминаз, о чем говорит более высокая концентрация таких аминокислот в крови, оттекающей от печени по сравнению с концентрацией в крови воротной вены.

Стратегия реакции переаминирования в клетке - аминогруппы разных донорных аминокислот переносятся на ограниченное число альфа- кетокислотных акцепторов, что позволяет выделить центральный путь метаболизма аминокислот. Большинство трансаминаз использует альфа-кетоглутаровую кислоту как основной акцептор аминогруппы. Трансаминазы же обычно называют по аминокислотам, которые служат донором аминогруппы (как правило альфа-кетоглутаровой кислоты, хотя оксалоацетат и ПВК также можно рассматривать в качестве важных акцепторов аминогрупп). Наиболее изученными трансаминазами являются:
a. аланиновая трансаминаза (АЛТ), известна также как глутамат:пируват трансаминаза. Следует заметить, что реакции переаминирования обратимы. В скелетной мышце пируват - главный акцептор для аминогрупп от глутаминовой кислоты, что приводит к образованию больших количеств аланина (последний транспортируется к печени). В печени аланин отдает аминогруппу альфа-кетоглутаровой кислоте, что вновь ведет к образованию ГЛУ.
б. аспарагиновая трансаминаза (АСТ), известна как глутамат:оксалоацетат трансфераза. Эта реакция важна для печени, где оксалоацетат действует как акцептор аминогрупп, получаемых от ГЛУ. Продукт реакции аспартат является субстратом для синтеза мочевины. Эта реакция, но протекающая в обратном направлении, важна для сердечной мышцы.
Р оль
трансаминаз в перносе аминного азота
на мочевину показана на
оль
трансаминаз в перносе аминного азота
на мочевину показана на
следующем рисунке .
