
- •Непрямое дезаминирование - основной путь дезаминирования аминокислот
- •Коферментные функции в трансаминазах выполняет активная форма витамина b6.
- •Глутаматдегидрогеназа занимает центральное место в обмене азота в клетке.
- •Аммиак –токсическое для организма соединение.
- •Особенности морфологического строения печени позволяют ей эффективно удалять и фиксировать ионы аммония.
- •Орнитиновый цикл мочевинообразования - главный механизм обезвреживания аммиака.
- •Синтез карбамоилфосфата – ключевая реакция синтеза мочевины
- •Образование цитруллина – первая реакция орнитинового цикла.
- •Для синтеза аргининосукцината необходима атф
- •Гипераммонийемия – следствие нарушения функции ферментов орнитинового цикла.
- •Безазотистый остаток аминокислот может превращаться в углеводы или липиды
- •Семейство пировиноградной кислоты включает Ала, Сер, Гли, Цис и Тре
- •Самое маленькое семейство у оксалоацетата
- •Основной член семейства -кетоглутаровой кислоты – глутаминовая кислота
- •Реакции декарбоксилирования аминокислот лежат в основе образования биогенных аминов.
- •Катехоламины – производные тирозина.
- •Триптофан предшественник синтеза серотонина и мелатонина.
- • Аминомасляная кислота медиатор тормозных нейронов
- •Гистамин образуется путем декарбоксилирования гистидина.
Безазотистый остаток аминокислот может превращаться в углеводы или липиды
Стратегия катаболизма аминокислот направлена на превращение аминокислот в основные промежуточные продукты, которые могут быть использованы для синтеза глюкозы или кетоновых тел. Углеродные скелеты 20 аминокислот превращаются в семь метаболитов. (см рис 8-17). Некоторые аминокислоты (лей, три, иле) могут превращаться не в одно, а в несколько из этих семи соединений.
Гликогенными аминокислотами стали называть аминокислоты, углеродные скелеты которых превращаются в пируват или в промежуточные продукты цикла Кребса (оксалоацетат, кетоглутаровую кислоту, сукцинил- КоА или фумаровую кислоту) с последующим использованием в реакциях глюконеогенеза..

Схема основных направлений катаболизма аминокислот.
Кетогенными аминокислотами являются аминокислоты углеродные скелеты которых превращаются в ацетил-КоА или в ацетоацетил-КоА из которых возможно образование кетоновых тел.
|
Гликогенные |
Кетогенные |
Глико и кетогенные |
|
Ала, Арг, Асп, Асн Цис, Глу, Глн, Гли, Гис, Мет, Про, Сер, Тре, Вал |
Лей, Лиз |
Иле, Фен, Тир, Три |
Семейство пировиноградной кислоты включает Ала, Сер, Гли, Цис и Тре

П ути,
по которым происходит превращение этих
аминокислот в ПВК разные. Самый прямой
и короткий путь проходит аланин, который
превращается в пируват при участии АЛТ.
Пировиноградная кислота–исходный
субстрат глюконеогенеза, поэтому
активность АЛТ в клетках печени высокая.
ути,
по которым происходит превращение этих
аминокислот в ПВК разные. Самый прямой
и короткий путь проходит аланин, который
превращается в пируват при участии АЛТ.
Пировиноградная кислота–исходный
субстрат глюконеогенеза, поэтому
активность АЛТ в клетках печени высокая.
О
 бмен
серина происходит несколькими путями.
Возможно прямое превращение в ПВК при
участии дегидратазы серина–пиридоксальфосфат
зависимого фермента, который катализирует
реакцию дезаминирования серина или
превращение серина в глицин при участии
гидроксиметил трансферазы серина. В
этой реакции образуется такжеN5,
N10
метилен тетрагидрофолат. Реакция,
катализируемая гидроксиметил трансферазой
обратима, что позволяет и углероды
молекулы глицина через серин перевести
в молекулу ПВК. Однако более значимый
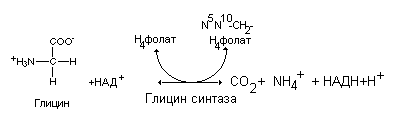
распад глицина происходит при участии
митохондриального ферментного комплекса
синтазы глицина, который катализирует
глубокий распад глицина до аммиака и
диоксида углерода.
бмен
серина происходит несколькими путями.
Возможно прямое превращение в ПВК при
участии дегидратазы серина–пиридоксальфосфат
зависимого фермента, который катализирует
реакцию дезаминирования серина или
превращение серина в глицин при участии
гидроксиметил трансферазы серина. В
этой реакции образуется такжеN5,
N10
метилен тетрагидрофолат. Реакция,
катализируемая гидроксиметил трансферазой
обратима, что позволяет и углероды
молекулы глицина через серин перевести
в молекулу ПВК. Однако более значимый
распад глицина происходит при участии
митохондриального ферментного комплекса
синтазы глицина, который катализирует
глубокий распад глицина до аммиака и
диоксида углерода.
С катаболизмом глицина тесно связан и обмен треонина. Альдолаза треонина –инициатор катаболизма этой аминокислоты. Под ее влиянием треонин распадается на молекулу глицина и уксусного альдегида. Уксусный альдегид восстанавливается при участии альдегиддегидрогеназы в уксусную кислоту, которую можно при помощи ацетаттиокиназы превратить в ацетилКоА. Второй путь катаболизма треонина включает специфическое дезаминирование этой аминокислоты при помощи серин-треонин дезаминазы, Образующийся при этом оксобутират может быть использован в синтезе аминокислот с разветвленным углеводородным радикалом.

Глицинурия – состояние характеризующееся большими потерями глицина почками при нормальном уровне глицина в крови. Это состояние связывают с нарушением реабсорбции глицина почками.
Самое маленькое семейство у оксалоацетата
В оксалоацетат
превращаются 2 аминокислоты аспарагин
и аспарагиновая кислота. Два фермента
катализируют это превращение. Аспарагиназа
катализирует гидролитическое
дезаминирование амидной группы аспарагина
и образование аспарагиновой кислоты,
а последняя под влиянием
аспартатаминотрансферазы (АСТ) теряет
аминогруппу и становится оксалоацетатом.
Эта реакция обеспечивает цикл трикарбоновых
кислот оксалоацет атом
(анаплеротическая реакция). АСТ активна
в сердечной мышце, что послужило
основанием для применения препаратов,
содержащих аспарагиновую кислоту в
кардиологической клинике. Аспарагиназа
используется при лечении некоторых
форм лейкозов для разрушения аспарагина,
который является незаменимой аминокислотой
для отдельных форм предшественников
лейкоцитов.
атом
(анаплеротическая реакция). АСТ активна
в сердечной мышце, что послужило
основанием для применения препаратов,
содержащих аспарагиновую кислоту в
кардиологической клинике. Аспарагиназа
используется при лечении некоторых
форм лейкозов для разрушения аспарагина,
который является незаменимой аминокислотой
для отдельных форм предшественников
лейкоцитов.
