- •Непрямое дезаминирование - основной путь дезаминирования аминокислот
- •Коферментные функции в трансаминазах выполняет активная форма витамина b6.
- •Глутаматдегидрогеназа занимает центральное место в обмене азота в клетке.
- •Аммиак –токсическое для организма соединение.
- •Особенности морфологического строения печени позволяют ей эффективно удалять и фиксировать ионы аммония.
- •Орнитиновый цикл мочевинообразования - главный механизм обезвреживания аммиака.
- •Синтез карбамоилфосфата – ключевая реакция синтеза мочевины
- •Образование цитруллина – первая реакция орнитинового цикла.
- •Для синтеза аргининосукцината необходима атф
- •Гипераммонийемия – следствие нарушения функции ферментов орнитинового цикла.
- •Безазотистый остаток аминокислот может превращаться в углеводы или липиды
- •Семейство пировиноградной кислоты включает Ала, Сер, Гли, Цис и Тре
- •Самое маленькое семейство у оксалоацетата
- •Основной член семейства -кетоглутаровой кислоты – глутаминовая кислота
- •Реакции декарбоксилирования аминокислот лежат в основе образования биогенных аминов.
- •Катехоламины – производные тирозина.
- •Триптофан предшественник синтеза серотонина и мелатонина.
- • Аминомасляная кислота медиатор тормозных нейронов
- •Гистамин образуется путем декарбоксилирования гистидина.
Глутаматдегидрогеназа занимает центральное место в обмене азота в клетке.
Большинство трансаминаз используют в качестве акцептора аминогруппы кетоглутарат и образуют глутаминовую кислоту. Окислительное дезаминирование этой кислоты с образованием кетоглутарата и аммиака катализируется широко распространенной в тканях глутаматдегидрогеназой. Она представляет олигомерный фермент с молекулярной массой 312 кД, состоящий из 6 субъединиц, которые при определенных условиях (под влиянием НАД+ илиГТФ) способны к диссоциации с потерей глутамат дегидрогеназной активности, обладает высокой активностью, локализована в митохондриях и может использовать в качестве кофермента НАД или НАДФ. Работой этого фермента завершается непрямое качестве кофермента НАД или НАДФ. Работой этого фермента завершается непрямое дезаминирование многих аминокислот и аммиак, высвобождаемый в этой реакции, протекающей в печени, используется для синтеза мочевины.
![]()
Глутаматдегидрогеназа –аллостерический фермент и ее активность тщательно регулируется. Аллостерическими ингибиторами фермента являются АТФ, ГТФ и НАДН+Н+, а активатором является АДФ. Этот фермент катализирует и обратную реакцию, обеспечивая аминирование -кетоглутаровой кислоты свободным аммиаком, что важно в механизмах обезвреживания аммиака и позволяет использовать азот аммиака для синтеза аминокислот.
Аммиак –токсическое для организма соединение.
К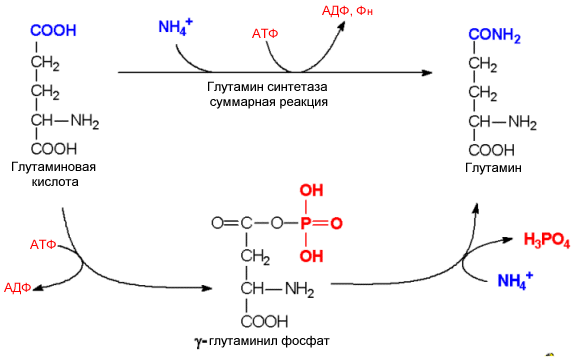 линические
наблюдения показывают, что у больных
с нарушением функций печени и/или
развившимся коллатеральным кровообращением
в области печени (портакавальные
анастомозы) после приема богатой белками
продуктов и повышения поступления
аммиака из кишечника начинают проявляться
симптомы аммиачной интоксикации. Это
выражается в форме специфического
дрожания (тремора), нечленораздельной
речи, ухудшения зрения, а в
линические
наблюдения показывают, что у больных
с нарушением функций печени и/или
развившимся коллатеральным кровообращением
в области печени (портакавальные
анастомозы) после приема богатой белками
продуктов и повышения поступления
аммиака из кишечника начинают проявляться
симптомы аммиачной интоксикации. Это
выражается в форме специфического
дрожания (тремора), нечленораздельной
речи, ухудшения зрения, а в
. Механизм глутаминсинтетазной реакции
тяжелых случаях к развитию коматозного состояния. Лечебные мероприятия при этом направлены на уменьшение уровня аммиака в крови. В нормальных условиях уровень аммиака в крови не превышает 200мкг/л, хотя процессы дезаминирования протекают во всех тканях. Такой низкий уровень поддерживается благодаря локальному связыванию аммиака в каждой клетке. Этому служат две реакции. Одна из них – восстановительное аминирование -кетоглутарата представляет реакцию обратную уже упомянутой выше реакции, катализируемой глутаматдегидрогеназой. . Роль донора водородов в этой реакции выполняет НАДФН. (Глутаматдегидрогеназа не обладает выраженной специфичностью к коферменту, что характерно для других никотинамидзависимых дегидрогеназ). Вторая реакция – образование глутамина, катализируется глутаминсинтетазой.
Реакция протекает в цитозоле клеток всех тканей, но особенно высокой активностью характеризуется ткань мозга, где эта реакция является основной при связывании аммиака и поэтому в случае повышения уровня аммиака в циркулирующей крови, когда возможности глутаминсинтетазы мозга исчерпываются, для обезвреживания привлекается глутаматдегирогеназная реакция. Это сопряжено с «утечкой» -кетоглутарата из цикла трикарбоновых кислот и ослаблением активности последнего, что приводит с ухудшению энергоснабжения нервных клеток и рассматривается как одна из причин аммонийной интоксикации.
Высокой глутаминсинтетазной активностью отличаются и мышцы. Глутаминсинтетаза характеризуется низкими значениями Км для аммиака, что позволяет ей активно выполнять свою функцию при низких концентрациях аммиака. У глутамина много функций:
Во всех тканях глутамин является донором азота для синтеза важных молекул, в частности, для пуринового и пиримидинового синтеза.
Является нетоксичной формой транспорта аммиака из разных тканей к клеткам печени, где он превращается в мочевину.
В кишечнике служит источником энергии для энтероцитов .
В почках участвует в поддержании кислотно-щелочного равновесия. Гидролиз амидной группы в боковой цепи глутамина глутаминазой позволяет связывать протоны. Это особенно важно в условиях метаболического ацидоза.
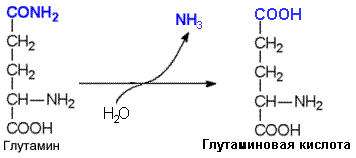
Глутамин может стать источником свободного аммиака благодаря глутаминазе – ферменту, который катализирует гидролиз амидной связи глутамина.