
- •Предисловие
- •Введение в биохимию
- •Теоретическая часть
- •Практическая часть
- •Энзимология и биологическое окисление
- •Теоретическая часть
- •Практическая часть
- •Теоретическая часть
- •Практическая часть
- •Теоретическая часть
- •Практическая часть
- •Теоретическая часть
- •Практическая часть
- •Теоретическая часть
- •Практическая часть
- •Биохимия углеводов
- •Теоретическая часть
- •Практическая часть
- •Теоретическая часть
- •Практическая часть
- •Теоретическая часть
- •Практическая часть
- •Теоретическая часть
- •Практическая часть
- •Биохимия липидов
- •Теоретическая часть
- •Практическая часть
- •Теоретическая часть
- •Практическая часть
- •Теоретическая часть
- •Практическая часть
- •Биохимия белков и нуклеиновых кислот
- •Теоретическая часть
- •Практическая часть
- •Теоретическая часть
- •Практическая часть
- •Теоретическая часть
- •Практическая часть
- •Теоретическая часть
- •Практическая часть
- •Теоретическая часть
- •Практическая часть
- •Содержание
- •1 Введение в биохимию 4
- •1 Введение в биохимию 2
-
Энзимология и биологическое окисление
Занятие 2
Строение и функции белков. Строение и свойства ферментов
Цель занятия: закрепить знания по структуре белков, сформировать представления о строении и свойствах ферментов. Научиться выполнять качественные реакции на активность некоторых гидролитических ферментов.
Исходный уровень знаний и навыков
Студент должен знать:
-
Характеристику уровней структурной организации белковой молекулы (первичная, вторичная, третичная, четвертичная структуры).
-
Жизненно незаменимые микроэлементы.
-
Витамины B1, B2, B3, B6, PP.
-
Строение коферментов NAD+, NADP+.
-
Понятия: коагуляция, порог коагуляции, коллоидная защита.
Студент должен уметь:
-
Проводить качественные реакции на белки и пептиды.
Структура занятия
-
Теоретическая часть
-
Понятие о ферментах. История энзимологии. Особенности ферментативного катализа. Строение ферментов. Доказательства белковой природы ферментов.
-
Характеристика уровней структурной организации белковой молекулы (первичная, вторичная, третичная, четвертичная структуры) и связей, удерживающих ее. Высаливание, денатурация, причины, механизм и признаки.
-
Кофакторы ферментов: ионы металлов и коферменты. Участие витаминов в построении коферментов.
-
Структурно-функциональная организация ферментов: активный (субстратный) центр, каталитический, аллостерический участки.
-
-
Практическая часть
-
Решение задач.
-
Лабораторные работы.
-
Проведение контроля конечного уровня знаний.
-
Задачи
-
Напишите формулу пептида Глу-Тир-Про-Гис-Сер. Какие из перечисленных цветных реакций будут положительными с данным пептидом: а) биуретовая, б) Фоля, в) ксантопротеиновая, г) Милона?
-
О чем свидетельствуют цветные реакции на белки:
а) о наличии белка в биологической жидкости;
б) о первичной структуре белка;
в) о конформации белка;
г) о наличии некоторых аминокислот в структуре белка;
д) о функции белка;
е) о наличии числа уровней структурной организации?
-
Причиной различий в кривых насыщения кислородом между Hb и миоглобином является:
а) количество кислорода, переносимое этими гемопротеидами;
б) заметные различия структур;
в) конформационные переходы субъединиц;
г) различиями pH окружающей среды;
д) различное значение pCO2 крови и ткани?
-
Зимогены превращаются в ферменты путем реакций: а) аденилирования; б) фосфорилирования; в) метилирования; г) ограниченного протеолиза?
-
Примером ковалентных сшивок белков рубцовой ткани являются: а) десмозин; б) лизил-альдольная связь; в) солевые мостики; г) водородные связи; д) дисульфидные связи?
-
Активный центр фермента:
а) содержит каталитические и вспомогательные аминокислоты;
б) создает благоприятное окружение для взаимодействия фермента и субстрата;
в) является основным в формировании свойств третичной структуры фермента;
г) может содержать дополнительные сайты небелкового строения, необходимые для каталитического действия;
д) обязательно содержит SH-группы?
Лабораторные работы
Лабораторная работа № 1. Цветные реакции на белки и аминокислоты
Биуретовая реакция.
Принцип метода. В щелочной среде пептидные связи белка образуют с ионами двухвалентной меди комплекс фиолетового цвета (см. уравнение).

ВНИМАНИЕ! Соблюдать меры безопасности при работе с гидроксидом натрия.
Ход работы. В три пробирки наливают по 5 капель растворов: в 1-ю – яичного белка, во 2-ю – желатина, в 3-ю – миозина. В каждую пробирку добавляют по 5 капель 10 %-го раствора гидроксида натрия и по 1 капле 1 %-го раствора медного купороса. Во всех пробирках наблюдают устойчивое сине-фиолетовое окрашивание.
Выводы по результатам работы.
Нингидриновая реакция.
Принцип метода. Основан на образовании димера нингидрина и азота аминогруппы сине-фиолетового цвета (комплекс Руэмана ‑ см. уравнение).
Ход работы. К 5 каплям раствора белка прибавить 5 капель раствора нингидрина и прокипятить 1–2 мин. Появляется сине-фиолетовое окрашивание.
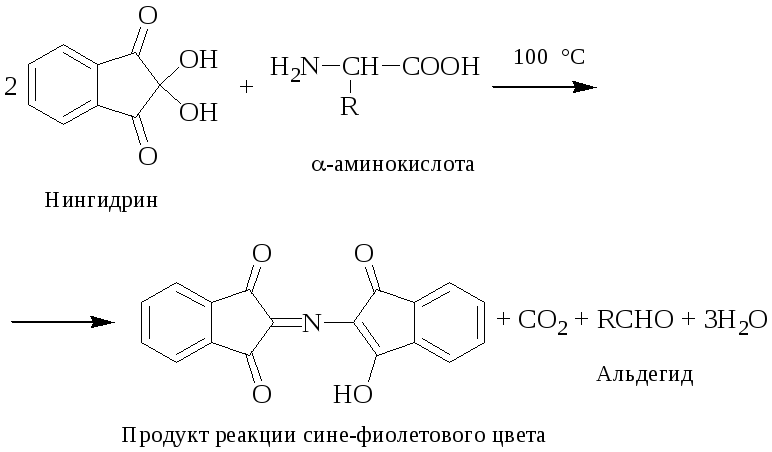
Выводы по результатам работы.
Ксантопротеиновая реакция (Мульдера).
Принцип метода. Основан на образовании нитросоединений ароматических и гетероциклических аминокислот, окрашенных в ярко-желтый цвет (см. уравнение).
ВНИМАНИЕ! Соблюдать меры безопасности при работе с концентрированной азотной кислотой.
Ход работы. В три пробирки наливают по 5 капель растворов: в 1-ю – яичного белка, во 2-ю – желатина, в 3-ю – миозина. В каждую пробирку добавляют по 3 капли концентрированной азотной кислоты и осторожно кипятят. В первой пробирке образуется осадок желтого цвета, а во второй – слабое окрашивание, т. к. желатин не содержит циклических аминокислот. В 3‑й пробирке образуется осадок белого цвета, переходящий в желтый цвет. Пробирки охлаждают и добавляют в каждую по 10–15 капель 20 %-го едкого натра до изменения окраски растворов вследствие образования натриевой соли динитротирозина.
Выводы по результатам работы.
Реакция на тирозин (Миллона).
П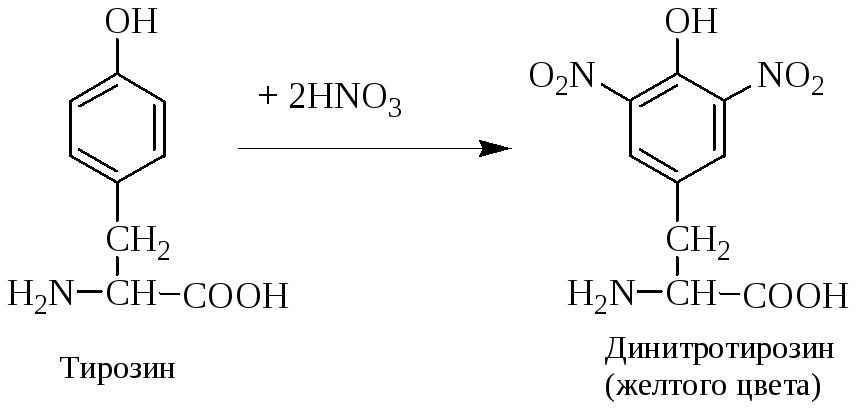
 ринцип
метода. Основан на образовании осадка
ртутной соли динитротирозина
кроваво-красного цвета (см. уравнение).
ринцип
метода. Основан на образовании осадка
ртутной соли динитротирозина
кроваво-красного цвета (см. уравнение).
ВНИМАНИЕ! Соблюдать меры безопасности при работе с реактивом Миллона (содержит Hg и HNO3).
Ход работы. В три пробирки наливают по 5 капель растворов: в 1-ю – яичного белка, во 2-ю – желатина, в 3-ю – миозина. В каждую пробирку добавляют по 3 капли реактива Миллона (раствор ртути в азотной кислоте) и осторожно нагревают. Отмечают изменение цвета в пробирках, характеризующее наличие в указанных белках тирозина.
Выводы по результатам работы.
Реакция Фоля (на аминокислоты, содержащие слабосвязанную серу).
Принцип метода. Основан на щелочном гидролизе сульфгидрильных групп SH белка с последующим отщеплении серы в виде сульфида свинца (PbS) черно-бурого цвета (см. уравнение).
ВНИМАНИЕ! Соблюдать меры безопасности при работе с реактивом Фоля (содержит NaOH и Na2PbO2).

Ход работы. В три пробирки наливают по 5 капель растворов: в 1-ю – яичного белка, во 2-ю – желатина, в 3-ю – миозина. В каждую пробирку добавляют по 5 капель реактива Фоля. Затем интенсивно кипятят и дают постоять 1–2 мин. При этом в 1-й и в 3-й пробирках образуется черный или бурый осадок сульфида свинца. Желатин осадка не образует, т. к. в нем нет серосодержащих аминокислот.
Выводы по результатам работы.
Лабораторная работа № 2. Реакции осаждения белков
Принцип метода. Основан на денатурации и осаждении белков различными факторами.
Осаждение белков при кипячении.
ВНИМАНИЕ! Соблюдать меры безопасности при работе с нагреванием пробирок.
Ход работы. В 5 пробирок наливают по 5 капель раствора белка. Первую пробирку нагреть до кипения. Жидкость мутнеет, т. к. разрушаются водные оболочки вокруг молекулы белка, и происходит укрупнение его частиц. Мицеллы белка несут заряд и удерживаются во взвешенном состоянии.
Во 2-й пробирке нагреть раствор до кипения и добавить 2 капли 1 %-го раствора уксусной кислоты до слабого подкисления. При отстаивании выпадает осадок белка. Частицы белка теряют заряд и приближаются к изоэлектрическому состоянию.
В 3-ю пробирку добавить 5 капель уксусной кислоты для сильнокислой реакции среды. При кипячении жидкости осадка не образуется, поскольку белковые мицеллы перезаряжаются и несут положительный заряд, что повышает их устойчивость.
В 4-ю пробирку налить 5 капель раствора уксусной кислоты, 2 капли насыщенного раствора хлористого натрия и нагреть. Выпадает белый хлопьевидный осадок, т. е. частицы белка теряют заряд.
В 5-ю пробирку добавить 2 капли раствора гидроксида натрия. При кипячении осадок не образуется, т. к. в щелочной среде отрицательный заряд на частицах белка увеличивается.
Выводы по результатам работы.
Осаждение белков концентрированными минеральными кислотами.
ВНИМАНИЕ! Соблюдать меры безопасности при работе с концентрированными азотной и серной кислотами.
Ход работы. В 2 пробирки наливают по 10 капель концентрированных кислот: азотной и серной. Наклонив пробирки под углом 45 градусов, осторожно по стенке пробирки приливают равный объем раствора белка так, чтобы обе жидкости не смешивались. На границе двух жидкостей образуется осадок в виде небольшого белого кольца. При добавлении избытка азотной кислоты осадок не исчезает, а при добавлении серной кислоты осадок растворяется.
Выводы по результатам работы.
Осаждение белков органическими растворителями.
Ход работы. В 2 пробирки вносят по 5 капель раствора белка и прибавляют по 15–20 капель этилового спирта и ацетона.
Выводы по результатам работы.
Осаждение белков органическими кислотами.
ВНИМАНИЕ! Соблюдать меры безопасности при работе с трихлоруксусной кислотой.
Ход работы. В две пробирки наливают по 5 капель раствора белка и добавляют по 2 капли раствора ТХУ (трихлоруксусной кислоты) в одну и 2 капли сульфосалициловой – в другую. Следят за изменением растворов.
Выводы по результатам работы.
Лабораторная работа № 3. Разделение альбуминов и глобулинов методом высаливания (УИРС)
Принцип метода. Основан на обратимой реакции осаждения белков из растворов с помощью высоких концентраций нейтральных солей (NaCl, NH4Cl, MgSO4 и др.).
Ход работы. К 1 мл неразведенного яичного белка добавляют 1 мл насыщенного раствора сульфата аммония и перемешивают. Получается полунасыщенный раствор сульфата аммония, в котором выпадает осадок яичного глобулина. Через 5 мин осадок отфильтровывают, в фильтрате остается яичный альбумин. Для высаливания альбуминов к фильтрату добавляют порошок сульфата аммония до полного насыщения, т. е. пока новая порция порошка остается нерастворенной. Выпавший осадок альбумина отфильтровывают. С фильтратом проделывают биуретовую реакцию. Отрицательная реакция указывает на отсутствие белка.
Выводы по результатам работы.
Рекомендуемая литература
Основная
-
Материал лекций.
-
Березов Т. Т., Коровкин Б. Ф. Биологическая химия. М.: Медицина, 1990. С. 92–102; 1998. С. 114–143.
-
Николаев А. Я. Биологическая химия. М.: Высшая школа, 1989. С. 5–92.
Дополнительная
-
Марри Р. и др. Биохимия человека. М.: Мир, 1993. Т. 1. С. 63–75.
-
Филиппович Ю. Б. Основы биохимии. М.: Высшая школа, 1993. С. 93–99.
-
Ленинджер А. Л. Основы биохимии. М.: Мир, 1985. Т. 1. С. 226–302.
-
Тюкавкина Н. А., Бауков Ю. И. Биоорганическая химия, М.: Медицина, 1991. С. 313–376.
-
Албертс Б. и др. Молекулярная биология клетки. М.: Мир, 1994. Т. 1. С. 113–171.
Занятие 3
Механизм действия ферментов
Цель занятия: закрепить знания по структуре ферментов, сформировать представления о механизме действия ферментов.
Исходный уровень знаний и навыков
Студент должен знать:
-
Теоретические основы химической кинетики.
-
Строение моносахаридов. Качественные реакции на альдегидные и спиртовые группы.
-
Строение полисахаридов. Свойство и качественные реакции.
-
Механизм образования шиффовых оснований.
-
Строение и механизм катализа коферментами NAD+ и NADP+.
Студент должен уметь:
-
Проводить качественные реакции на продукты ферментативного гидролиза.
Структура занятия
