
1_-_enzimologia_i_BO / 01-08-ФиБО-2012 small
.pdf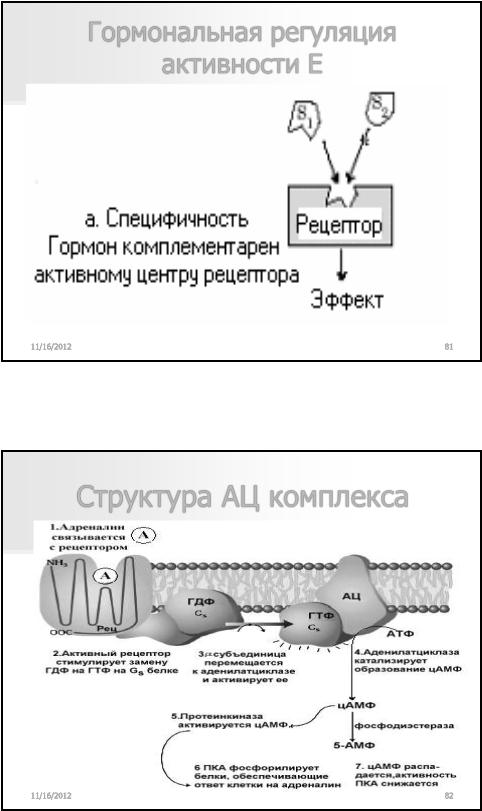
Кафедра биохимии ГомГМУ, 2012 |
16.11.2012 |
Гормональная регуляция активности Е
11/16/2012 |
81 |
Структура АЦ комплекса
11/16/2012 |
82 |
Введение в биохимию. Энзимология. |
|
Биоэнергетика |
41 |

Кафедра биохимии ГомГМУ, 2012 |
16.11.2012 |
Каскадный
принцип работы АЦ комплекса
83
Регуляция активности Е путем химической модификации
Ограниченный протеолиз
(Пепсиноген→пепсин)
Фосфорилирование
Метилирование
Ацетилирование
Аденилирование
и др.
11/16/2012 |
84 |
Введение в биохимию. Энзимология. |
|
Биоэнергетика |
42 |

Кафедра биохимии ГомГМУ, 2012 |
16.11.2012 |
Виды ингибирования
Обратимое – обратимые изменения активности фермента путем ковалентной модификации
1.конкурентное (структурное сходство I с S) IE
-связывание с активным каталитическим центром
Принципы конкурентного торможения находят применение в медицине в химиотерапии и при лечении отравлений
2.неконкурентное – структурного сходства I с S нет, IE.
-связывание с иным участком E,
-путем изменения конформации фермента
3.бесконкурентное - бесконкурентные ингибиторы не могут связаться со свободным ферментом , а только с ES комплексом
(IES).
Необратимое – обычно необратимое повреждение Е
11/16/2012 |
85 |
Регуляция активности Е
Регуляция условиями среды t°, pH, ионной силы и др.
Изостерическая с помощью S или P
- субстратная активация и ингибирование
- ретроингибирование (ингибирование
продуктом)
Аллостерическая с помощью других веществ, не являющихся ни S или P данной реакции
11/16/2012 |
86 |
Введение в биохимию. Энзимология. |
|
Биоэнергетика |
43 |
Кафедра биохимии ГомГМУ, 2012 |
16.11.2012 |
Ретроингибирование
11/16/2012 |
87 |
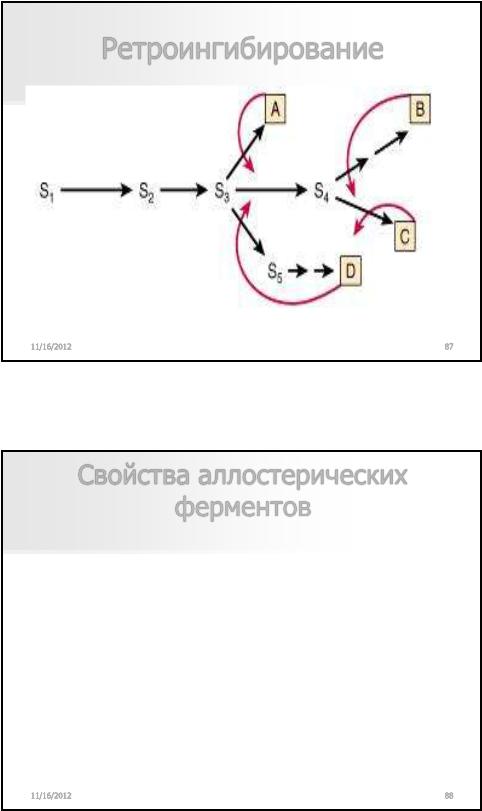
Свойства аллостерических ферментов
Расположены в узловых пунктах метаболизма
Субъединичная структура
Имеется ось симметрии
Изменения конформации в пределах R и T
Сигмоидная форма кривой зависимости скорости реакции от концентрация субстрата (в отличие от гиперболической для не аллостерических)
Наличие эффекторов + и –
Двухфазный ответ на конкурентные ингибиторы (увеличение акт при малых [I] и торможение при больших)
Потеря аллостерических свойств при денатурации
11/16/2012 |
88 |
Введение в биохимию. Энзимология. |
|
Биоэнергетика |
44 |
Кафедра биохимии ГомГМУ, 2012 |
16.11.2012 |
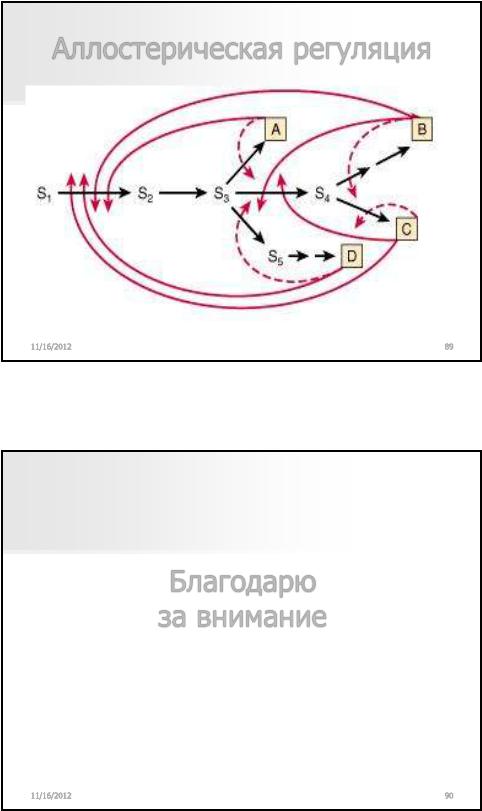
Аллостерическая регуляция
11/16/2012 |
89 |
Благодарю за внимание
11/16/2012 |
90 |
Введение в биохимию. Энзимология. |
|
Биоэнергетика |
45 |

Кафедра биохимии ГомГМУ, 2012 |
16.11.2012 |
Энзимология
Механизм действия. (ферменты - 2)
Лекция 3
д.м.н., проф. Грицук А. И.
11/16/2012 |
91 |
Ферменты-2
Содержание:
1.Механизм действия ферментов. Этапы ферментативного катализа.
2. Факторы, определяющие активность ферментов [E], [S], Km.
3. Влияние pH, [P], tº, ионной силы на активность ферментов.
4. Регуляция активности ферментов
Введение в биохимию. Энзимология. |
|
Биоэнергетика |
46 |
Кафедра биохимии ГомГМУ, 2012 |
16.11.2012 |
• Выдвинутая в 1913 году Л. Михаэлисом и
М. Ментен общая теория ферментативного катализа постулировала, что фермент Е сначала обратимо и относительно быстро связывается с со своим субстратом S в реакции:
•E + S = ES
•Образовавшийся при этом ферментсубстратный комплекс ES, не имеющий аналогий в органической химии и химическом катализе, затем распадается во второй, более медленной (лимитирующей) стадии реакции:
•ES = Е + Р
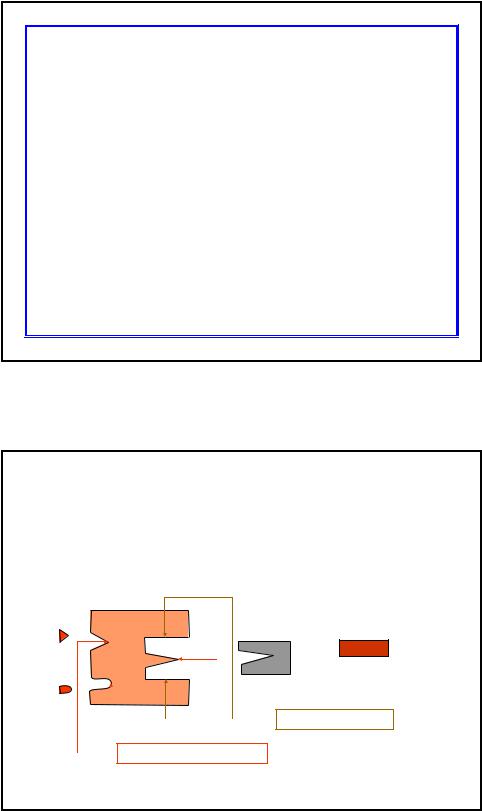
Структурно-функциональная организация ферментов. Схема
Активные центры |
Субстратный |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
продукт
субстрат Якорные площадки
Центры регуляции + и -
Введение в биохимию. Энзимология. |
|
Биоэнергетика |
47 |

Кафедра биохимии ГомГМУ, 2012 |
16.11.2012 |
Структурно-функциональная организация ферментов.
•Активный (субстратный) центр - это совокупность функциональных групп, расположенных в разных участках ПП цепи, но близко структурно и функционально ориентированных (в третичной структуре) и имеющих прямое отношение к катализу.
•Этот центр состоит из функциональных групп и радикалов: SH-(цистеина); -ОН(серина); COOH-(АСП); имидазольного кольца гистидина.
•Активный центр включает в себя:
1.Каталитический участок или центр,
непосредственно взаимодействующий с субстратом, осуществляющим катализ.
2.Контактная, или якорная площадка - она обеспечивает специфическое сродство фермента к субстрату и является местом фиксации субстрата на поверхности фермента.
3.Вспомогательные участки - карманы, щели и др.
Введение в биохимию. Энзимология. |
|
Биоэнергетика |
48 |

Кафедра биохимии ГомГМУ, 2012 |
16.11.2012 |
•1 этап: постепенное «причаливание» S к «якорной» площадке F.
•2 этап: напряжение и деформация: индуцированное соответствие - происходит присоединение субстрата, которое вызывает конформационные изменения в молекуле фермента приводящие к напряжению структуры активного центра и деформации связанного субстрата.
•3 этап: непосредственный катализ.
•Химические связи, действующие при этом:
•1. Силы Ван дер Ваальса
•2. Электростатическое взаимодействие
•3. Водородные связи
•4. Гидрофобные взаимодействия
Введение в биохимию. Энзимология. |
|
Биоэнергетика |
49 |
Кафедра биохимии ГомГМУ, 2012 |
16.11.2012 |
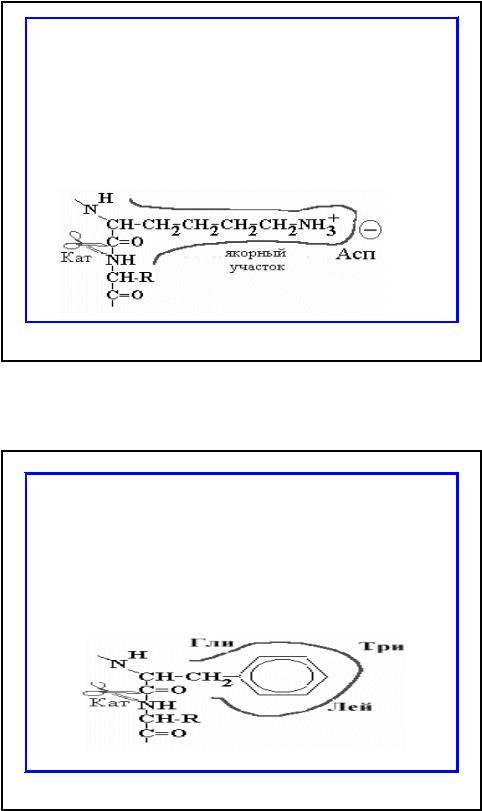
•Якорный участок трипсина представлен длинным узким карманом с отрицательно заряженный Асп в глубине кармана. В этот карман легко проникают аминокислоты, имеющие длинную боковую цепь с положительным зарядом на конце; такими аминокислотами являются Лиз или Ар, которые хорошо связываются и распознаются, а гидролиз происходит на соседней пептидной связи.
•В гидрофобном кармане, образованном радикалами Гли, Три и Лей, химотрипсина располагается боковая цепь с ароматическим кольцом (Фен, Тир или Три)..
Пептидная связь, образованная СООН группой ароматической аминокислоты, устанавливается рядом с каталитическим участком химотрипсина
Введение в биохимию. Энзимология. |
|
Биоэнергетика |
50 |
