
1_-_enzimologia_i_BO / 01-08-ФиБО-2012 small
.pdf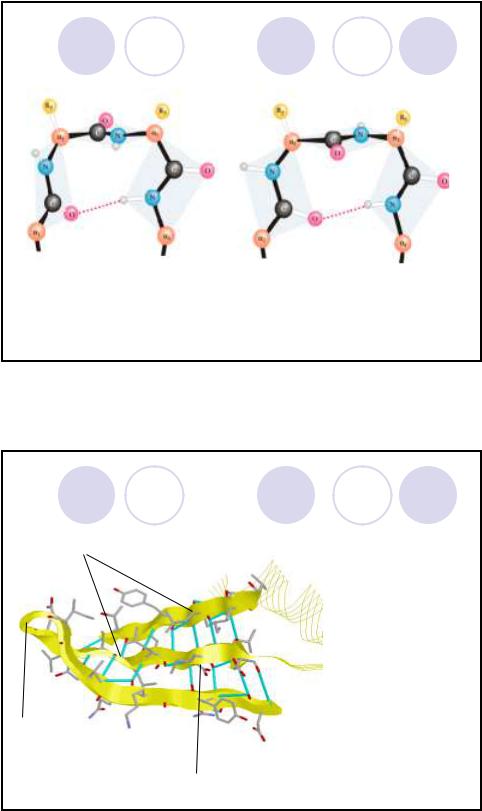
Кафедра биохимии ГомГМУ, 2012 |
16.11.2012 |
β-поворот пептидной цепи
Рис.1.26. Виды вторичной структуры белка. Схематическое изображение -поворота.
16.11.2012 |
41 |
Характеристика β-структуры
Параллельные цепи |
Вытянутые |
||
|
|
полипептидные цепи |
|
|
|
удерживаются между |
|
|
|
собой водородными |
|
|
|
связями пептидных |
|
|
|
групп. |
|
|
|
Водородные связи |
|
|
|
лежат в плоскости |
|
|
|
складок. |
|
|
|
Радикалы АК – выше и |
|
Петля |
|
ниже плоскости. |
|
|
|
||
|
|
Могут быть |
|
|
Антипараллельные цепи |
параллельными и |
|
16.11.2012 |
антипараллельными.42 |
||
|
|||
Введение в биохимию. Энзимология. |
|
Биоэнергетика |
21 |

Кафедра биохимии ГомГМУ, 2012 |
16.11.2012 |
АК состав белка определяет тип его вторичной структуры
Спиралеобразующие АК:
ала, лей, глу, глн, гис, лиз, мет
АК, образующие β-слои:
Вал, лей, тре, тир, фен
АК, образующие неупорядоченные слои:
гли, сер, асп, асн, про
16.11.2012 |
43 |
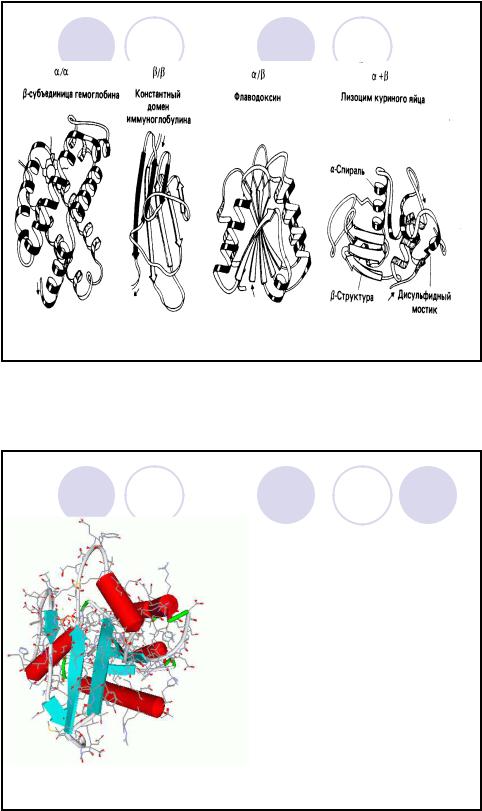
Надвторичная структура
α-белки:
миоглобин, гемоглобин, парамиозин, α-кератин.
β-белки:
конканаваллин A (растительные лектины), супероксиддисмутаза, фиброин шелка, паутины.
α+β-белки (одна часть пептидной цепи представлена α-спиралями, другая – β-структурами) – редкие:
термолизин (бакт.),
α/β-белки (α- и β- структуры чередуются) – наиболее часто:
фосфоглицераткиназа, флаводоксин.
без α,β (практически не имеют спиральных и складчатых структур):
ферредоксин (бакт.)
16.11.2012 |
44 |
Введение в биохимию. Энзимология. |
|
Биоэнергетика |
22 |
Кафедра биохимии ГомГМУ, 2012 |
16.11.2012 |
Надвторичная структура
16.11.2012 |
45 |
Третичная структура
ONCOGENE PROTEIN
16.11.2012
(C-H-RAS P21 PROTEIN)
Третичная структура – это общее расположение в пространстве частей полипептидной молекулы.
третичная структура удерживается за счет
сильных ковалентных связей (дисульфидные, псевдопептидные),
слабых нековалентных (электростатические, водородные связи, гидрофобные взаимодействия).
Процесс укладки белковой молекулы (фолдинг белка) контролируется специфическими белками – шаперонами и шаперонинами (белки теплового шока).
46
Введение в биохимию. Энзимология. |
|
Биоэнергетика |
23 |
Кафедра биохимии ГомГМУ, 2012 |
16.11.2012 |
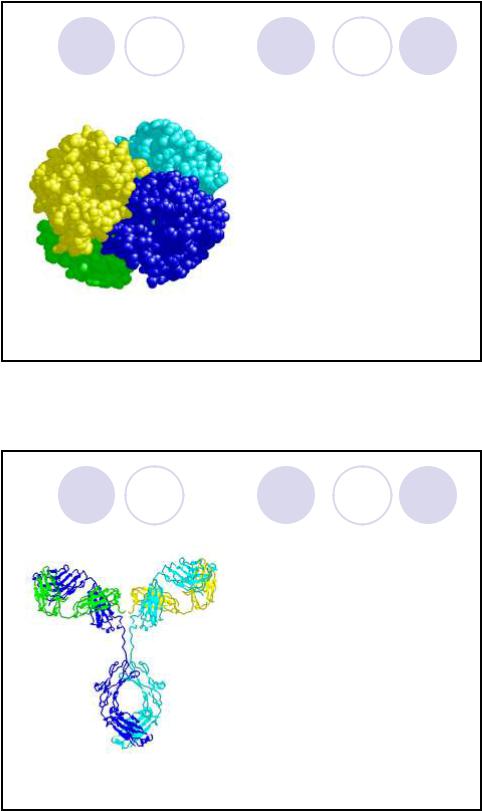
Четвертичная структура белка
|
Четвертичная |
|
структура – |
|
комплекс отдельных |
|
полипептидных |
|
цепей (субъединиц, |
|
или мономеров); |
|
Удерживается |
|
водородными |
|
связями и |
|
гидрофобными |
Гемоглобин A – тетрамерный белок |
взаимодействиями. |
|
|
16.11.2012 |
47 |
Доменная организация белка
Домен - обособленная область молекулы белка, обладающая структурной и функциональной автономией.
В иммуноглобулине G1 (IgG1), различают 12 доменов:
2 легкие цепи по 2 домена (VL, CL)
2 тяжелые цепи по 4
домена (VH, CH1, CH2, CH3).
HUMAN IGG1
16.11.2012 |
48 |
Введение в биохимию. Энзимология. |
|
Биоэнергетика |
24 |
Кафедра биохимии ГомГМУ, 2012 |
16.11.2012 |
Общий план строения глобулярной молекулы белка
(модель жировой капли)
В центре молекулы ориентированы гидрофобные радикалы АК
По периферии – гидрофильные
В результате поверхность белка заряжена и в водной среде на ней
образуется гидратная оболочка
16.11.2012 |
49 |
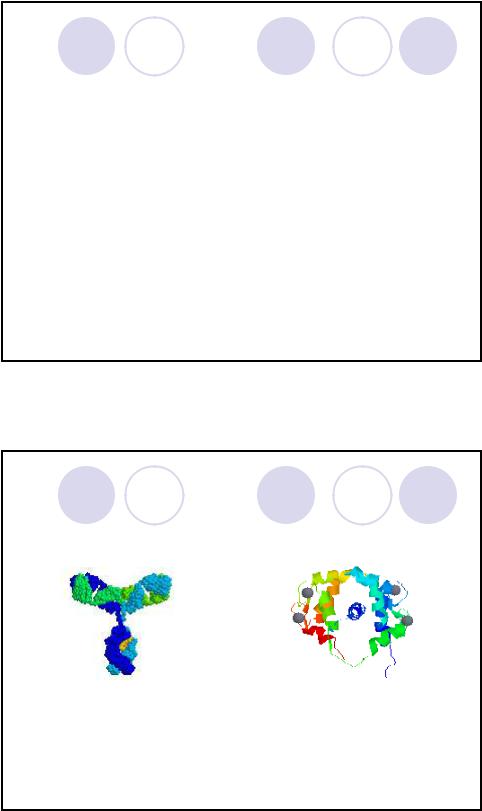
Примеры белковых молекул
|
Иммуноглобулин |
Кальцийсвязывающий белок |
|
|
|
16.11.2012 |
|
50 |
Введение в биохимию. Энзимология. |
|
Биоэнергетика |
25 |

Кафедра биохимии ГомГМУ, 2012 |
16.11.2012 |
Пятый уровень органицации белковой молекулы
Иногда выделяют и пятый уровень – метаболон, т. е. совокупность ферментов, катализирующих
определенный метаболический путь
(ферменты цикла Кребса).
16.11.2012 |
51 |
Форма, размеры и масса белковых молекул
По форме:
Глобулярные (альбумин, рибонуклеаза, миоглобин, гемоглобин).
шарообразные, эллипсоидные, вытянутые.
Фибриллярные (кератины, фиброин, коллаген, F-актин, тропомиозин).
нитевидные.
По размерам - от 2,5 до 300 нм.
По массе – от 13 до 500 kDa (килодальтон).
16.11.2012 |
52 |
Введение в биохимию. Энзимология. |
|
Биоэнергетика |
26 |

Кафедра биохимии ГомГМУ, 2012 |
16.11.2012 |
Благодарю за внимание
Следующая лекция «Ферменты»
Энзимология
Строение и свойства ферментов
(ферменты - 1)
Лекция 2
д.м.н., проф. Грицук А. И.
11/16/2012 |
54 |
Введение в биохимию. Энзимология. |
|
Биоэнергетика |
27 |

Кафедра биохимии ГомГМУ, 2012 |
16.11.2012 |
Ферменты – биологические катализаторы белковой природы
В природе существует 3 вида биологических катализаторов :
Ферменты (энзимы) – белковой природы
Рибозимы – РНК с каталитической активностью
Абзимы – антитела с каталитической активностью
11/16/2012 |
55 |
История энзимологии
В древности использовали ферментативные технологии (хлебопечение, виноделие, обработка шкур и др)
XVIII в Р.Реомюр, Л. Спалланцани описание пищеварения у птиц
1814 г. К.Кирхгоф показал каталитический хар-р гидролиза крахмала при прорастании зерна
Середина XIX в спор Ю. Либиха и Л. Пастера «организованные» и «неорганизованные» ферменты
1878 г. Ф. Кюне ввел термин «энзим»
11/16/2012 |
56 |
Введение в биохимию. Энзимология. |
|
Биоэнергетика |
28 |

Кафедра биохимии ГомГМУ, 2012 |
16.11.2012 |
История энзимологии (прод)
1871 г. М.М. Манассеина, а затем Э. Бюхнер показали, что экстракт клеток способен к катализу
1894 г. Э. Фишер создал модель «ключ-замок»
1913 г. Л. Михаэлис и М. Ментен создали теорию ферм катализа
1929 г. Дж Самнер доказал белковую природу ферментов
1963 г. изучена первичная структура РНК-азы
1968 г. М. Меррифилд синтез искусственной РНК-азы
11/16/2012 |
57 |
Простые и сложные ферменты
Простые ферменты состоят только из
молекулы белка (большинство ферментов ЖКТ)
Сложные ферменты – это простой фермент (апофермент) + небелкое соединение (кофермент, кофактор)
-коферменты алифатические (GSH)
-коферменты циклические (КоQ)
-коферментынуклеотиды (NAD, FAD, FMN)
-коферменты ионы Ме (K, Na, Ca, Mg, Mn, Fe …) ~ 25%
-коферменты-производные водорастворимых витаминов B1ТПФ, В6 –Фосфопиридоксаль и др)
11/16/2012 |
58 |
Введение в биохимию. Энзимология. |
|
Биоэнергетика |
29 |
Кафедра биохимии ГомГМУ, 2012 |
16.11.2012 |
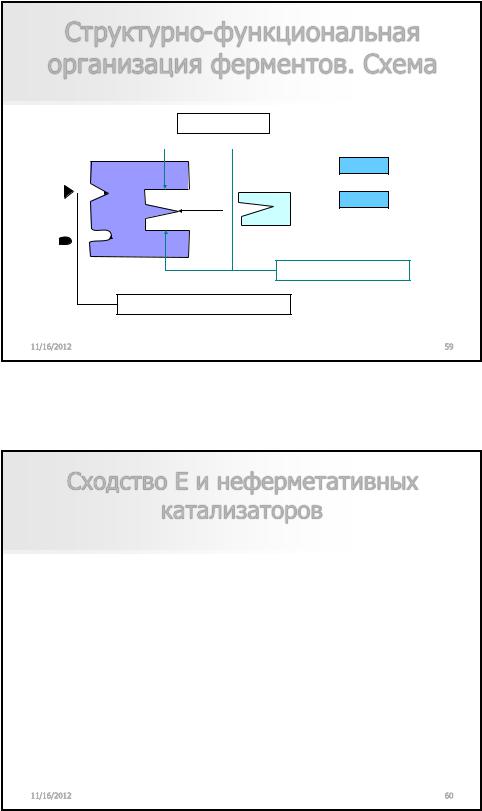
Структурно-функциональная организация ферментов. Схема
Активные центры |
Субстратный |
|
продукт
субстрат Якорные площадки
Центры регуляции + и -
11/16/2012 |
59 |
Сходство Е и неферметативных катализаторов
Катализируют энергетически возможные реакции
Энергия химической системы остается постоянной
В ходе катализа направление реакции не меняется
Не расходуются в процессе реакции
11/16/2012 |
60 |
Введение в биохимию. Энзимология. |
|
Биоэнергетика |
30 |
