
Характеристика частиц атома
|
Частица |
Заряд |
Масса | ||
|
Кл |
а.е.з. |
г |
а.е.м. | |
|
Протон, р |
|
+1 |
|
1,00782 |
|
Нейтрон, n |
0 |
0 |
|
1,00826 |
|
Электрон, е- |
|
-1 |
|
|
а.е.м. – атомная единица массы, равная 1/12массы атома изотопа углерода-12.
а.е.з. – атомная единица заряда.
Атомы химических элементов с одинаковым количеством протонов в ядре, но с разным количеством нейтронов и поэтому с разной массой, называются изотопами. Каждый элемент имеет изотопы.
Например: водород имеет три изотопа:
масса атома 11Н 1 2D 1 3T
порядковый номер элемента
водород дейтерий тритий
Задание 1.Сколько протонов, нейтронов и электронов в атоме изотопа кислорода-18?
Модель ответа:Изотоп кислорода-18 имеет атомную массу А=18 а.е.м. Порядковый номер кислорода в таблице Менделеева 8, значит, количество протоновZ (p)равно 8, число электронов Z(e)в атоме тоже 8. Количество нейтронов равноN = A – Z(р)
N = 18 – 8 = 10.
Задание 2.Сколько протонов, нейтронов и электронов в атоме а)изотопа кальция-41? б) изотопа хрома-52?
Прочитайте текст и выполните задания 3 и 4:
В таблице Менделеева указаны атомные массы с учетом всех изотопов данного элемента, поэтому значения их не целые, а дробные. Порядковый номер элемента дает информацию об атоме:
1) количество протонов;
2) положительный заряд ядра;
3) количество электронов в атоме.
Электроныс большой скоростью вращаются вокруг ядра. Так как все электроны имеют одинаковый заряд, то они отталкиваются друг от друга. Поэтому электроны вращаются на разных расстояниях от ядра, образуяэлектронные слои. Кроме того, электроны совершают сложные движения, чтобы не столкнуться друг с другом, образуя разные формыэлектронного облакав пространстве: форму шара s-электроны; форму гантели (объемной восьмерки) – p-электроны; форму цветка – d-электроны. Первый электронный слой содержит только два s-электрона; второй слой может содержать максимум восемь электронов: два s-электрона и шесть р-электронов; третий слой содержит максимум 18 электронов: два s-электрона, шесть р-электронов и 10 d-электронов. В четвертом слое может быть максимально 32 электрона.
· ) ) ) )
ядро 1s2 2s22p6 3s23p63d10 4s24p64d104f14
max 2e- 8e- 18e- 32e-
Электронные и электронно-графические формулы атомов
элементов.
Распределение электронов в атоме начинается с заполнения первого электронного слоя. Распределение электронов записывается в виде электронной формулы: сначала записывается химический символ элемента, в левом нижнем углу записывается его порядковый номер, справа от символа цифрой указывается номер электронного слоя, буквой - форма электронного облака и верхним индексом – количество электронов данной формы электронного облака.
Например:
![]() ,3Li
1s22s1
,
,3Li
1s22s1
, ![]() - электронные формулы.
- электронные формулы.
Количество электронных слоевв атоме соответствуетномерупериода, в котором находится элемент.
Электронно-графическиеформулы показывают распределение электронов по атомным орбиталям.Атомная орбиталь – это пространство, которое занимает электронное облако. Атомную орбиталь условно обозначаем | | , а электроны | | .s-орбиталь одна,max. количествоs-электронов – 2; р-орбиталей три,max.количество p-электронов 6;d-орбиталей пять,max. количествоd-электронов 10;f-орбиталей семь;max. количествоf-электронов 14. Электроны занимают орбитали сначала по одному, а потом второй электрон.Одну орбиталь могут заниматьmax. два электрона.
|
Например: 7N |
|
|
|
|
|
|
|
1s 2s 2p
Задание 3. Напишите электронную и электронно-графическую формулу атома элемента серы.
Модель ответа:Сера стоит в 3 периоде, вVI-а группе, ее порядковый номер 16. Следовательно, в атоме серы 16 электронов образуют 3 электронных слоя. Электронную формулу запишем так:
16 S 1s2 2s2 2p6 3s2 3p4
На последнем третьем слое в атоме серы 6электронов, что совпадает с номером группы, в которой стоит этот элемент.
Электронно-графическая формула:
|
16S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1s 2s 2p 3s 3p
Задание 4. Напишите электронные и электронно-графические формулы атомов элементов № 8, № 12, № 15.
Домашнее задание:
Напишите электронные и электронно-графические
![]() формулы
атомов элементов № 5, 10,
11, 14, 17 и укажите, сколько протонов,
нейтронов и электронов в атомах этих
элементов.
формулы
атомов элементов № 5, 10,
11, 14, 17 и укажите, сколько протонов,
нейтронов и электронов в атомах этих
элементов.
Седьмое занятие
Тема: Электронный тип элементов.
Ключевые слова и словосочетания:
Электронная формула атома элемента; электронная формула в общем виде; электронный тип элемента.
Прочитайте текст и выполните задания 1 и 2:
Текст:
Все химические элементы делят на четыре электронных типа:
s – элементы;
p – элементы;
d – элементы;
f – элементы.
Элементы, у которых на последнем электронном слое появляются s–электроны, называются s–элементами.
В таблице Менделеева они занимают I-а и II-а группы. У элементовI-а группы на последнем электронном слое один s–электрон, а у элементовII-а группы на последнем слое два s – электрона.
-
I-а группа(
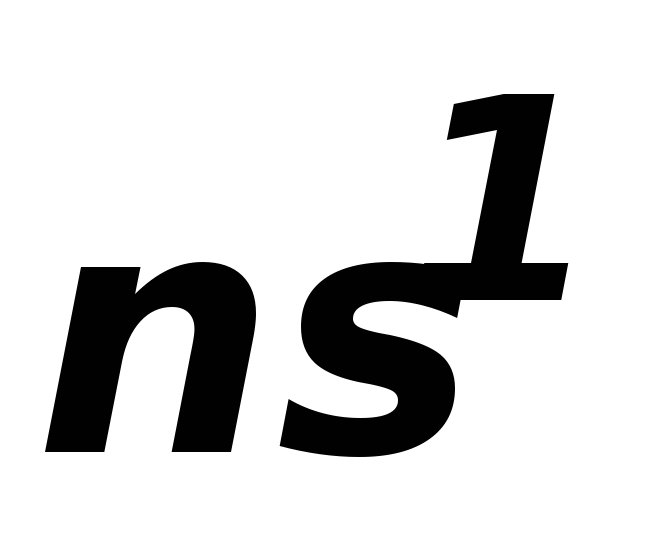 )
)II-а группа(
 )
)





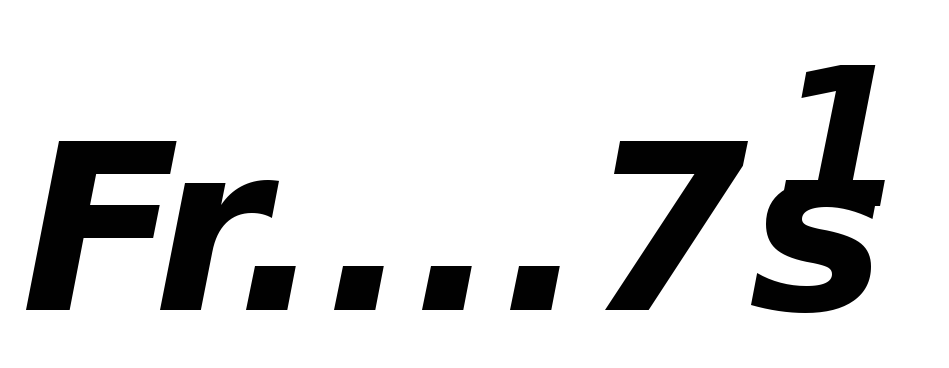






Номер последнего слоя (n) соответствует номеру периода, в котором стоит элемент.
Элементы, у которых на последнем электронном слое появляются p–электроны, называются p–элементами.В таблице Менделеева они занимаютIII-а,IV-а,V-а, VI-а,VII-а иVIII-а группы.
В общем виде последний уровень атомов элементов имеет вид:
IIIa IVa Va VIa VIIa VIIIa
ns2np1 ns2np2 ns2np3 ns2np4 ns2np5 ns2np6
Все «в» подгруппы занимают d–элементы. Это элементы, у которых на предпоследнем(n–1)электронном слое появляются d–электроны.
Электронная формула этих элементов в общем виде записывается :
IIIв IVв Vв VIв VIIв
(n-1)d1ns2 (n-1)d2ns2 (n-1)d3ns2 (n-1)d4ns2 (n-1)d5ns2
VIIIв Iв IIв
(n-1)d6ns2 (n-1)d7ns2 (n-1)d8ns2 (n-1)d9ns2 (n-1)d10ns2
Например, элемент марганец стоит в VII-в группе четвертого периода. Его электронная формула будет:
![]()
Элемент рений в той же группе, но в шестом периоде, его формула:
![]()
Задание 1.Напишите электронные формулы атомов элементов №7, №14, №22 и укажите электронный тип каждого элемента.
Модель ответа:Порядковый номер элемента указывает, сколько электронов в атоме. №7 – это азот, стоит вV-а группе, 2 периоде, значит его семь электронов образуют два электронных слоя и на втором слое пять электронов:
![]() - это р-элемент.
- это р-элемент.
№14 – это кремний, стоит в IV-а группе третьего периода:
![]() - это также р-элемент.
- это также р-элемент.
№22 – это титан, стоит в IV-в группе четвертого периода, значит его 22 электрона образуют 4 электронных слоя:
![]() - это d–элемент.
- это d–элемент.
Задание 2. Напишите электронные формулы атомов элементов №11, №27, №30 и №35. Укажите электронный тип каждого элемента.
Домашнее задание:
Напишите электронные формулы атомов элементов № 12, 13, 20, 21, 26, 34, 35,37,38.
Укажите валентные электроны и электронный тип этих элементов.
Восьмое занятие
Тема: Химическая связь.
Ключевые слова и словосочетания:
Химическая связь; образовать химическую связь; полярная связь; неполярная связь; смещение электронов; валентные электроны, катион; анион.
Прочитайте текст и ответьте на вопросы:
Текст:
Атом гелия и атомы p-элементовVIII-а группы на последнем электронном уровне содержатмаксимальновозможное количество электронов: атом гелия два электрона (1s2), а р-элементыVIII-a группы восемь электроновns2 np6. Электронные уровни этих элементов называютсязавершенными.Это самое устойчивое состояние атома. Поэтому атомы гелия и атомыp-элементовVIII-а группы не взаимодействуют с другими атомами. Эти элементы называются «благородными газами». Атомы других элементов, чтобы завершить электронный слой, или отдают свои электроны (если их мало на последнем слое), или забирают электроны у других атомов (если не хватает немного до завершения уровня), или образуютобщие электронные пары. При этом атомы образуют друг с другомхимическую связьв молекулах. Электроны, образующие химическую связь, называютвалентные электроны..
Различают 4 типа химической связи:
Ковалентная связь– атомы образуют общие электронные пары ;
Ионная связь– один атом отдал свои валентные электроны и сталкатионом, а другой атом принял эти электроны и сталанионом;
Металлическая связь– связь между атомами в металлах;
Водородная связь– связь между атомом водорода одной молекулы и атомом другого элемента другой молекулы.
В молекулах простых веществ между атомами ковалентная неполярная связь. Если в молекуле атомы разных элементов, то между ними ковалентная полярная связь.
Например, молекула водорода состоит из двух атомов водорода, между атомами ковалентная неполярнаясвязь:Н∙ + ∙ Н = Н : Н = Н – Н = Н2
Молекула хлоридной кислоты состоит из атома водорода и атома хлора. Между ними - ковалентная полярнаясвязь:H :Cl, т.е. электронная пара связи смещена к хлору и поэтому у хлора появляется отрицательный заряд, а у водорода – положительный.
В солях между катионом и кислотным остатком - ионная связь.
Например:
![]() хлорид натрия состоит из катиона
хлорид натрия состоит из катиона![]() и хлорид-иона
и хлорид-иона![]() .
.
У атома натрия на последнем электронном
слое один
![]() -электрон
-электрон![]() ,
который он отдает хлору и становится
катионом. Атом хлора принимает один
электрон и становится анионом. Катион
и анион притягиваются друг к другу,
такая связь называетсяионной.
,
который он отдает хлору и становится
катионом. Атом хлора принимает один
электрон и становится анионом. Катион
и анион притягиваются друг к другу,
такая связь называетсяионной.
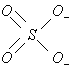
Соль
![]() состоит из катиона
состоит из катиона![]() и аниона
и аниона![]() - между ними ионная связь. В ионе
- между ними ионная связь. В ионе![]() между атомом серы и атомом кислорода –
ковалентная полярная связь:
между атомом серы и атомом кислорода –
ковалентная полярная связь:
Металлическая связь– в металлах.
Водородная связь– между молекулами веществ, которые состоят из атомов водорода и кислорода или фтора. Например, водаН2Ои фтороводородНF:

Ответьте на вопросы:
1. Какая связь называется ковалентной полярной?
2. Какая связь называется ковалентной неполярной?
3. Какие связи между атомами в солях? Разберите на примере соли
Al2 (SO4)3.
Девятое занятие
Тема: Типы химических реакций.
Ключевые слова и словосочетания:
Реакция; химическая реакция; процесс; образование связи; разрыв связи; степень окисления элемента; заряд иона; осадок; твердое вещество; газ; электронейтральный.
Прочитайте текст и выполните задания 1 и 2:
Текст:
Химические реакции– это процесс разрыва связей между атомами в исходных веществах и образование новых связей между атомами в продуктах реакции.
Различают такие типы химических реакций:
Реакции обмена– это реакции, которые идут без изменения степени окисления (заряда атома) элементов;
Окислительно-восстановительные реакции– это реакции, в результате которых степень окисления элементов меняется.
Реакции обменасопровождаются образованием нового, более прочного соединения. Это осадок, газ или вода.
Например:а)
![]() ;
;
б)
![]() ;
;
газ
в)![]()
осадок
В этих реакциях степень окисления (заряд) элементов не меняется.
Степень окисления– это условный заряд атома элемента в молекуле. Условно считаем, что связь между атомамиионная.
Для определения степени окисления элемента в химическом соединении необходимо знать, что:
степень окисления водорода почти всегда +1. Степень окисления водорода может быть -1, если водород связан с металлами. Например,
 ;
; и др.;
и др.;степень окисления атома кислорода почти всегда -2. Исключение – пероксиды типа
 ,
,
 ,
, .Здесь степень окисления кислорода -1;
.Здесь степень окисления кислорода -1;атомы
 -элементов
I группы в соединениях всегда имеют
степень окисления +1, а
-элементов
I группы в соединениях всегда имеют
степень окисления +1, а -элементы
II группы – всегда +2;
-элементы
II группы – всегда +2;алюминий во всех соединениях имеет степень окисления +3;
фтор всегда имеет степень окисления -1; 0 0
в простых веществах степень окисления элементов равна0.(F2, Fe)
Остальные элементы могут иметь разные степени окисления и их надо уметь рассчитывать, помня правило:
- в молекуле сумма положительных зарядов должна быть равна сумме отрицательных зарядов, т.к. молекула электронейтральна.
- в ионе сумма положительных и отрицательных зарядов равна заряду иона.
Пример 1. Рассчитаем степень
окисления атома азота в молекуле![]() .
Для этого поставим известные степени
окисления (ставят над символом химического
элемента):
.
Для этого поставим известные степени
окисления (ставят над символом химического
элемента):
![]() ,
так как в молекуле три атома кислорода,
то сумма отрицательных зарядов равна
,
так как в молекуле три атома кислорода,
то сумма отрицательных зарядов равна![]() .Значит,
положительных зарядов тоже должно быть
6. Один «+» у атома водорода, значит, у
азота должен быть заряд +5. Проверка:
.Значит,
положительных зарядов тоже должно быть
6. Один «+» у атома водорода, значит, у
азота должен быть заряд +5. Проверка:
![]()
Пример 2: Рассчитаем степень
окисления хрома и серы в соединении![]() .
Это соль, которая состоит из катионов
хрома и кислотного остатка серной
кислоты
.
Это соль, которая состоит из катионов
хрома и кислотного остатка серной
кислоты
![]() .
.
В кислотном остатке сумма всех степеней окисления элементов равна заряду иона 2- .
![]()
![]()
![]() ,
т.е. степень окисления серы равна +6.
,
т.е. степень окисления серы равна +6.
Так как кислотных остатков три, то их
общий заряд равен
![]() ,
следовательно, и положительных зарядов
в молекуле соли тоже должно быть +6, т.к.
атомов хрома два, то +6/2 = +3, т.е. степень
окисления хрома равна +3.
,
следовательно, и положительных зарядов
в молекуле соли тоже должно быть +6, т.к.
атомов хрома два, то +6/2 = +3, т.е. степень
окисления хрома равна +3.
Задание 1. Рассчитайте степени окисления элементов в соединениях:
а)
![]() ;
б)
;
б)![]() ;
в)
;
в)![]() ;
г)
;
г)![]() .
.
Задание 2. Допишите уравнения реакции обмена:
а)
![]()
б)
![]()
в)
![]()
Домашнее задание:
1) Рассчитайте степени окисления элементов в соединениях:
а)
![]() б)
б)![]()
в)
![]() г)
г)![]()
д)
![]() е)
е)![]()
2) Допишите уравнения реакций обмена:
a)1KOH + 1H3PO4 б) FeCl3 + NH3·H2O
в) CuSO4 + NaOH г) Cd(NO3)2 + K2S
д) Ni(OH)2 + HCl е) Na2CO3 + HCl
