
- •Міністерство освіти і науки україни
- •Номенклатура комплексних сполук.
- •Природа координаційного зв’язку
- •Класифікація комплексних сполук.
- •Дисоціація комплексних сполук у розчинах. Стійкість комплексних іонів.
- •Ізомерія комплексних сполук.
- •Властивості комплексних сполук.
- •Основні способи одержання комплексних сполук.
- •Значення та застосування комплексних сполук.
- •Практична частина.
- •Лабораторна робота “Комплексні сполуки”.
- •Запитання для самоконтролю
- •Задачі для самоконтролю
- •Література
Класифікація комплексних сполук.
Існує багато класифікацій комплексних сполук, але ні одна з них не є задовільною в усіх відношеннях. Були запропоновані різні класифікації: за ступенем окислення центрального атома, за характером комплексного іона, за координаційним числом, за природою атома-донора.
Розглянемо деякі з них:
І. За характером електричного заряду комплексного іона розрізняють катіонні, аніонні та нейтральні комплекси. Заряд комплексного іона дорівнює алгебраїчній сумі зарядів простих іонів, з яких він складається. Наприклад: Ag++2CN– = [Ag(CN)2]–, тому що +1+(–2) = –1.
Електронейтральні молекули, які входять до складу комплексу (наприклад: NH3, H2O, C6H6) не впливають на величину його заряду.
Наприклад: Zn2+ + 4NH30 = [Zn(NH3)4]2+
Приклади різних комплексів:
[Cu(NH3)4]SO4 – с катіонним комплексом
K2[Be F4] – с аніонним комплексом
[Cr(C6H6)]0 – нейтральний комплекс
ІІ. За характером лігандів розрізняють такі комплексні сполуки:
а )аміакати – комплекси, у яких лігандами є полярні молекули аміаку NH3: [Cu(NH3)]Cl2, [Pt(NH3)6]Cl3 і таке інше.
Відомі також комплекси, де лігандами є похідні аміаку - аміни: [Cu(H2N(CH2)2NH2)]Cl2, [Pt(C5H5N)4]Br2.
б )ацидокомплекси – сполуки, лігандами в яких є кислотні залишки: K2[HgJ4], K4[Fe(CN)6], (NH4)2[Co(SCN)4] і таке інше.
в )аквакомплекси – у якості лігандів тут виступають полярні молекули води: [Al(H2О)6]Cl3, [Co(H2O)6]SO4.
г) гідроксокомплекси – лігандами є гідроксид-іони ОН–. Наприклад: Na3[Cr(OH)6], K3[Al(OH)6] і так далі.
д) між цими основними типами комплексних сполук існують перехідні ряди, котрі включають комплекси з різнорідними лігандами. Такі комплекси звуться різнолігандними. Наприклад: Na[Al(OH)4(H2O)2], [Pt(NH3)4Cl2]Cl2.
є) окрім комплексних сполук з монодентатними лігандами існують комплекси з бі- та полідентатними лігандами, які звуться циклічними, або ж хелатами.
Н априклад:
априклад:
Окрім перерахованих типів комплексних сполук зустрічаються також поліядерні сполуки (з декількома комплексоутворювачами). Сюди можна також віднести комлекси кластерного типу, ізополікислоти, гетерополікислоти і таке інше.
Дисоціація комплексних сполук у розчинах. Стійкість комплексних іонів.
Внутрішня та зовнішня сфери комплексної сполуки сильно відрізняються за стійкістю. Частки, які знаходяться у зовнішній сфері, зв’язані з комплексним іоном переважно електростатичними силами і легко відщеплюються у розчині. Електролітична дисоціація комплексних сполук на внутрішню та зовнішню сферу під дією полярних молекул розчинника відбувається за типом сильних електролітів:
K3[Fe(CN)6] 3K+ + [Fe(CN)6]3–
[Ni(NH3)6](OH)2 2OH– + [Ni(NH3)6]2+
[Pt(NH3)2Cl2]0
–
зовнішня сфера відсутня, сполука
відноситься до комплексних неелектролітів,
точніше – до слабких електролітів.
Оборотний розпад внутрішньої сфери
комплексних сполук називається вторинною
дисоціацією, при якій відбувається
ступеневе відщеплення молекул або іонів
лігандів від комплексоутворювача. Мірою
стійкості комплексної сполуки є константа
нестійкості (КНЕСТ)
або константа стійкості (КСТ).
![]() .
Чим менша КНЕСТ,
тим стійкіша внутрішня сфера.
.
Чим менша КНЕСТ,
тим стійкіша внутрішня сфера.
Константою нестійкості комплексної сполуки називається константа рівноваги процесу дисоціації комплексних йонів.
Для йона [Zn(NH3)4]2+ константа нестійкості відповідає рівноважному процесу:
[Zn(NH3)4]2+ ↔ Zn2+ + 4NH30
 (1)
(1)
Дисоціація комплексних йонів відбувається ступінчато:
[Zn(NH3)4]2+ ↔ [Zn(NH3)3]2+ + NH30 (2)
[Zn(NH3)3]2+ ↔ [Zn(NH3)2]2+ + NH30 (3)
[Zn(NH3)2]2+ ↔ [Zn(NH3)]2+ + NH30 (4)
[Zn(NH3)]2+ ↔ Zn2+ + NH30 (5)
Кожному з рівнянь (2) – (5) відповідає ступінчаста константа нестійкості:
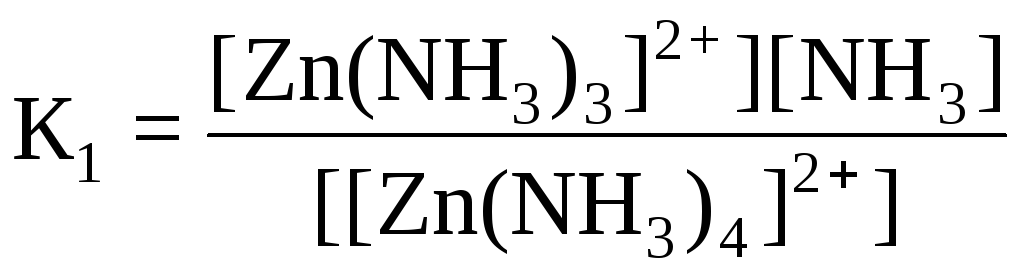 ;
;

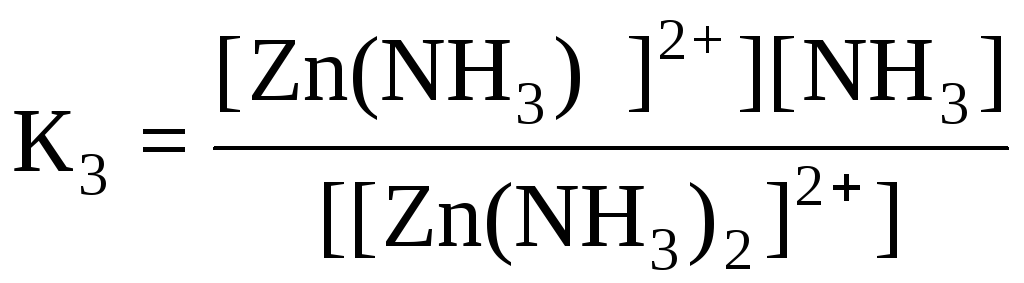 ;
;
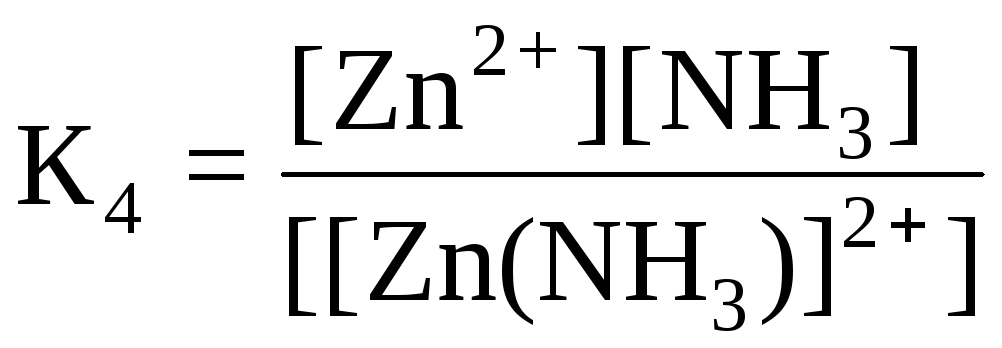 .
.
Константа нестійкості, виражена рівнянням (1), є константою дисоціації комплексної сполуки і дорівнює добутку всіх ступінчатих констант:
![]()
Значення констант нестійкості наводяться в довідниках з хімії.
