
- •Міністерство освіти і науки україни
- •Номенклатура комплексних сполук.
- •Природа координаційного зв’язку
- •Класифікація комплексних сполук.
- •Дисоціація комплексних сполук у розчинах. Стійкість комплексних іонів.
- •Ізомерія комплексних сполук.
- •Властивості комплексних сполук.
- •Основні способи одержання комплексних сполук.
- •Значення та застосування комплексних сполук.
- •Практична частина.
- •Лабораторна робота “Комплексні сполуки”.
- •Запитання для самоконтролю
- •Задачі для самоконтролю
- •Література
Номенклатура комплексних сполук.
Номенклатура комплексних сполук ґрунтується на рекомендаціях Міжнародної спілки чистої та прикладної хімії (IUPAC). Спершу називають комплексний (або простий) катіон у називному відмінку, потім – простий (або комплексний) аніон.
У формулі комплексного іону, як правило, на першому місці записують символ центрального атома або йона-комплексоутворювача, потім - нейтральні ліганди, потім - аніонні ліганди. Наприклад: [Co(NH3)4Cl2]+.
Назва комплексного іона утворюється із назви лігандів з зазначенням їх числа та назви центрального йона-комплексоутворювача з зазначенням його ступеня окислення.
Наприклад: гексаамінкобальт (ІІІ)-іон [Co(NH3)6]3+
Для зазначення кількості лігандів використовують префікси: ді-, три-, тетра-, пента-, гекса-. Якщо присутні декілька різних лігандів, то вони перераховуються в алфавітному порядку, і префікси не змінюють цей порядок. Назви аніонних лігандів утворюють додаванням до назв аніонів закінчення –о.
Наприклад: [Cr(H2O)4Cl2]+– тетрааквадіхлорохром(ІІІ)-іон.
Якщо комплекс є аніон, то до назви комплексоутворювача приєднується суфікс - ат.
Наприклад: цинкат, хромат, купрат, аргентат, платинат и т.і.
K3[Fe(CN)6] – калій гексаціаноферат(III);
K2[PtCl6] – калій гексахлороплатинат(IV).
Формули та назви сполук, що містять комплексний катіон, наведено нижче:
[Co(NH3)4Сl2]Cl –тетраміндихлорокобальт(III) хлорид;
[Ag(NH3)2]Cl –діамінаргентум (I) хлорид.
Комплексні сполуки без зовнішньої сфери:
[Cr(H2O)3F3] – триакватрифторохром(III);
[Pt(NH3)2Cl2] – діаміндихлороплатина(II).
НОМЕНКЛАТУРНІ НАЗВИ НАЙБІЛЬШ ПОШИРЕНИХ КОМПЛЕКСНИХ ІОНІВ
|
ЛІГАНД |
ТИП КОМП-ЛЕКСУ |
ПРИКЛАД |
НАЗВА КОМПЛЕКСУ |
|
Аміак |
Амін |
[Ag(NH3)2]+ |
Діамінарген-тум-йон |
|
Вода |
Аква |
[Cr(H2O)6]3+ |
Гексааква-хром(ІІІ)-йон |
|
Гідроксид-йон |
Гідроксо |
[Zn(OH)4]2– |
Тетрагідро- ксоцинкат-йон |
|
Гідроксид-йон, вода |
Змішаний |
[Fe(ОH)2(H2О)4]+ |
Тетрааквадігі- дроксоферрум (ІІI)-йон |
|
Нітрит-йон |
Нітро |
[Co(NO2)6]3– |
Гексанітро-кобальтат(ІІІ)-йон |
Природа координаційного зв’язку
Між йонами внутрішньої і зовнішньої сфер існує йонний зв’язок. Утворення комплексних йонів пояснюють, виходячи з методу валентних зв’язків (МВЗ), теорії кристалічного поля (ТКП) або теорії молекулярних орбіталей (ТМО).
В основу метода валентних зв’язків покладено припущення, що при комплексоутворенні утворюються ковалентні зв’язки за донорно-акцепторним механізмом за рахунок вільної пари електронів, яка до утворення зв’язку належала тільки одному з атомів – донору, та вільної валентної орбіталі другого атома – акцептора.
У якості приклада розглянемо утворення аміачних комплексів срібла:
Ag+ + 2NH3 [Ag(NH3)2]+
Іон срібла має вільні валентні орбіталі S та р-підрівнів, а у молекулі аміаку азот має вільну пару електронів:
A g+...
+ 2 : NH3
[NH3-Ag-NH3]+
g+...
+ 2 : NH3
[NH3-Ag-NH3]+
Тут роль донора (постачальника електронної пари) виконує ліганд :NH3, а акцептором, який приймає електрони, є йон-комлексоутворювач срібла.
Комплексоутворювачем може бути йон, атом, інколи молекула або група атомів, які мають декілька вільних орбіталей, доступних за умов комлексоутворення для електронів лігандів. Найбільш типовими комлексоутворювачами є іони і атоми d-елементів.
Наприклад: H2[Pt Cl4] – комплексоутворювач Pt2+
[Cu(NH3)4]SO4 – комлексоутворювач Cu2+
[Fe(CO)5] – комлексоутворювач Fe0
Хорошими комплексоутворювачами є f-елементи, рідше комлексоутворювачами бувають р-елементи, а комплексоутворююча здатність у S-елементів найнижча.
Обов’язковою складовою частиною комплексної сполуки є ліганди. Ліганди – це аніони кислот, або молекули, що мають неподілені пари електронів, за рахунок яких утворюються донорно-акцепторні (координаційні) зв’язки з центральним атомом.
Наприклад:
1)аніони кислот F–, CN–, S2O32–, SO42–, SCN–, NO2– і т.д.
2) молекули NH3, H2O, CO, які мають вільні (неподілені) пари електронів.
3) молекули складних органічних речовин, до складу яких входять атоми азоту, кисню, сірки, фосфору та інші, які мають неподілені пари електронів (наприклад, CH3CH2OH, (CH2)2-N2(CH2COOH)4).
Ліганди, які займають одне координаційне місце (утворюють один зв’язок з комплексоутворювачем) називаються одномісними або ж монодентатними.
Наприклад: F–, Cl–, CN–, SCN–, NH3, H2O, OH–, CO і таке інше.
Відомі двомісні (дводентатні) та багатомістні (полідентатні) ліганди: C2O42– (оксалат-іон), H2N-CH2-CH2-NH2 (етилендіамін) і таке інше.
Важливою характеристикою комплексного йона і комплексоутворювача є координаційне число. Координаційні числа частіше всього бувають: 2, 4, 6, 8, 10, 12. Рідше зустрічаються непарні: 1, 3, 5, 7, 9.
Величина координаційного числа залежить:
Від кількості вільних орбіталей в атомі (атомах) комплексоутворювача. Причому, ці орбіталі повинні бути доступні для електронів лігандів.
Від об’ємів (розмірів) комплексоутворювачів та лігандів. Наприклад: K[BF4], K3[Al F6], Na[Al Br4].
Від умов утворення комплексної сполуки.
Інколи на величину координаційного числа впливають іони зовнішньої сфери.
В деяких випадках величина координаційного числа залежить від природи ліганду.
Ступінь окислення центрального атома-комплексоутворювача є основним фактором, який впливає на координаційне число, і, як наслідок, на просторову будову комплексної сполуки.
|
Заряд іона |
Коорди- наційне число (КЧ) |
Геометрична конфігурація комплексів |
|
+1 |
2 |
|
|
+2 |
4, (6) |
тетраедр або
п
|
|
+3 |
6, (4) |
|
|
+4 |
8 |
додекаедр, квадратна антипризма
|
Важливим висновком координаційної теорії А.Вернера є положення про просторовий характер координації лігандів центральним атомом.
В залежності від природи орбіталей, їх напрямленності та типу гібридизації утворюються комплексні іони та молекули різної геометричної форми. Іони з КЧ=2 мають SP-гібридизацію та лінійну структуру.
Наприклад: [Ag(CN)2]– має будову [NC-Ag–CN]–
При КЧ=4 комплекси, в залежності від типу гібридизації, мають тетраедричну форму (sp3-гібридизація), або форму плоского квадрата (sp2d-гібридизація).
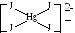
Наприклад: [Hg J4]2– має будову
При КЧ=6 (sp3d2-гібридизація) ліганди розташовуються на вершинах октаедра.

Наприклад: [Fe(CN)6]3– має будову
Октаедричне розташування лігандів обумовлює геометричну (цис- та транс-ізомерію) та оптичну ізомерію при різних та бідентатних лігандах.

 лінійна
лінійна
 лоский
квадрат
лоский
квадрат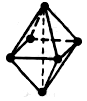 октаедр
октаедр