
- •Класифікація
- •Класифікація, переваги та недоліки
- •Конструкція
- •Переваги та недоліки
- •Класифікація
- •Кольорові сплави і метали, їх використовування в народному госпо- дарстві. Спла́ви мі́ді
- •Види сплавів міді
- •Сплави на основі алюмінію
- •Властивості металів і сплавів
- •Антикорозійний захист металів і сплавів
- •Будова металів.
- •Вмісту вуглецю
- •Гвинтові механізми. Черв'ячна (шнекова) передача — зубчаста передача, що призначена для передавання обертового руху між валами, осі яких мимобіжні в просторі і утворюють прямий кут. Переваги
- •Застосування
- •Класифікація
- •К.К.Д. Передачі
- •Розбірні з'єднання
- •Муфти, їх призначення і класифікація
- •Технологія конструкційних матеріалів
- •1.2.1. Лиття в піщано-глиняні форми
- •1.3. Лиття в багаторазові ливарні форми
- •1.3.1. Лиття в кокіль «металеві форми»
- •1.3.2. Лиття під тиском та інші способи лиття
- •Обробляння металів і сплавів тиском
- •2.5. Кування
- •2.6. Штампування
- •2.7. Волочіння
- •Мал. 150. Класифікаціяспособівзварювання
Будова металів.
Дослідження свідчать, що атоми (іони) в металах просторово розташовуються в суворому порядку, утворюючи кристалічну решітку. Форма і тип кристалічної решітки визначаються характером взаємного розташування атомів у кристалі. Кожний тип кристалічної решітки може бути охарактеризований елементарною коміркою, під якою розуміють мінімальне угруповання атомів, яке відображає повну симетрію кристалу, і переміщуючи яку паралельно саму собі в просторі, можна побудувати весь кристал. Кристалічні решітки, в яких частинки розташовані тільки у вершинах елементарної комірки, називаються простими (наприклад, куб). У складних кристалічних решітках з щільною упаковкою атомів частинки знаходяться не тільки у вершинах, але і в середині комірок чи на їх гранях. Розміри елементарної комірки характеризують періодом, під яким розуміють відстань між паралельними атомними площинами, утворюючими елементарну комірку. Іншими важливими характеристиками кристалічної решітки елементарної комірки є: координаційне число К, коефіцієнт компактності h і базис Б. Під координаційним числом розуміють число атомів, мінімально рівновіддалених від даного атома. Коефіцієнт компактності решітки визначається як відношення об’єму, зайнятого атомами в решітці, до усього об’єму решітки. Величини К і h характеризують щільність упаковки атомів у решітці. (Чим більша К і h, тим більша щільність решітки). Під базисом решітки розуміють число атомів, яке припадає на одну елементарну комірку. Базис характеризує складність решітки. Метали можуть мати різні типии кристалічних структур (решітка), але частіше інших зустрічаються слідуючи: об’ємноцентрована кубічна, гранецентрована кубічна і гексагональна щільно упакована. Об’ємноцентрована кубічна (ОЦК) решітка має в елементарній комірці вісім іонів, розташованих у вершинах куба і один іон в його центрі. Характеризується ця решітка одним періодом – відстанню між центрами іонів, розташованих по одному ребру (період а ). Величина а для кожного металу має своє власне значення. У гранецентрованій кубічній (ГЦК) решітці іони розташовані у вершинах куба і в центрі кожної грані. Центр куба залишається вільним. Кубічна гранецентрована решітка також характеризується одним періодом – довжиною ребра куба а. Цей тип решітки мають такі метали як мідь, нікель, алюміній, свинець, срібло, залізо при Т від 911оC до 1392оC та ін. У ГЦК кристалів К=12, h=0,74 і Б=4. Період решітки металів, які кристалізуються у кубічній сингонії, знаходиться у межах (2,85 – 6,06)*10-10м. Елементарна комірка гексагональної щільно упакованої (ГЩУ) решітки являє собою шестигранну призму. Іони розташовані у вершинах шестикутників і в їх ценрах. У середині призми утворено правильний трикутник з іонами в вершинах. Гексагональна щільно упакована решітка характеризується двома періодами решітки: стороною шестикутника а і довжиною ребра с. Найбільша щільність упаковки досягається при співвідношенні параметрів с/а=1,633 (наприклад, титан, кобальт, цинк та інші метали). У гексагональній системі а≈(2,26 – 3,97)*10-10м і с≈(3,56 – 6,51)*10-10м, К=12, h=0,74 і Б=6. Поняття анізотропії. Полікристалічна будова металів У кристалі можна провести велику кількість площин, що проходять через атоми, які ідентично розташовані у вузлах кристалічної решітки. Для кожної групи кристалографічних площин міжплощинні відстані і щільність розташування атомів на них будуть різними і, таким чином, будуть різними і сили взаємодії між цими площинами. Тому фізичні та механічні властивості кристала залежать від напрямку, в якому їх визначають. Це явище називається анізотропією властивостей. Воно дуже виявляється в монокристалах (одно кристалічних тілах). Так, у чистому залізі модуль пружності, наприклад, в різних напрямках змінюється від 1,35*105 МПа до 2,9*105 МПа, тобто (більше ніж у два рази). Але, як відмічалось раніше, метали та сплави, які застосовують у техніці, не є монокристалами. Вони мають полікристалічну будову, тобто складаються з великого числа випадково орієнтованих одних відносно одного мікро кристалів (кристалітів). У різних кристалографічних площинах, проведених через центри атомів у кристалічних ґратках, число атомів і відстані між ними неоднакові. Наприклад, у площині, проведеній через основу г. щ.у. , розміщено сім, а в площині її грані — чотири атоми. У зв'язку з цим властивості монокристалів (одиничних кристалів у вигляді геометрично правильної фігури багатогранника) у різних напрямках неоднакові. Таке явище називають Анізотропією.
Зливки металу можна розрізнити три зони з різноманітною структурою (рис. 1). Кристалізація рідкого металу починається у поверхні більш холодної форми й відбувається в тонкому сильнопереохлажденном шарі, що прилягає до поверхні. У результаті великий швидкості охолодження станеться освіту лежить на поверхні зливка дуже вузької зони 1 порівняно дрібнихравноосних кристалів. Малюнок 1. Схема будівлі сталевого зливка За зоною 1 вглиб зливка розташована зона 2 видовженихдендритних кристалів (зонатранскристаллизации). Зростання цих кристаликів відбувається у напрямі протилежному відведення теплоти (тобто нормально до стінокизложници). Що стосується сильного перегріву металу, швидкого охолодження, високої температури лиття і спокійного заповнення форми зона видовженихдендритних кристалів може цілком заповнити обшир зливка (рис. 1) (>транскристаллизация). При низької температури лиття, дуже повільному охолодженні, наприклад, великих виливків створюються умови до виникнення зародків у неповній середній частини зливка. Це спричиняє освіті у внутрішній частини виливки структурної зони 3, що зравноосних різна орієнтованихдендритних кристалів (рис. 1), розміри яких залежать від ступеня перегріву рідкого металу, швидкості охолодження, наявності домішок та інших. Домішки, перебувають у рідкому металі, сприяють розвитку зони дрібнихравноосних кристалів. Зонастолбчатих кристалів має високої щільністю, оскільки він маємо замало газових міхурів і раковин. Однак у ділянках стикустолбчатих кристалів, зростаючих від різних поверхонь, метал має знижену міцність, і за наступної обробці тиском у тих ділянках виникатимуть тріщини. Кристалізація, яка веде до стику зонстолбчатих кристалів, називаєтьсятранскристаллизации. >Жидкий метал має більший питомий обсяг, ніж твердий; тому метал, залитий до форми скорочується обсягом при кристалізації, що зумовлює освіті порожнин, званихусадочними раковинами (зображені темним кольором на рис. 1). >Усадочние раковини може бути сконцентровано у одному місці ми, або розсіяні з усього обсягу зливка.Усадочная раковина зазвичай оточена найбільш забрудненій частиною металу, у якому після затвердіння утворюються мікро- імакропори, бульки. Найчастішеусадочная раковина концентрується у верхній частині зливка,затвердевающей останнє. Частина зливка зусадочной раковиною пухким металом відрізають. Злиток має неоднорідний в перетині склад. Наприклад, в стали по напрямі від поверхні до центра і знизу вгору збільшується концентрація вуглецю і шкідливих домішок – сірки і фосфору. Хімічна неоднорідність щодо окремих зонам зливка називається зональноїликвацией. Вона негативно впливає механічні властивості
Металевий сплав отримують сплавом двох або більш металів; сплавом переважно металів з неметалами; спіканням порошків декількох металів. Отримане з'єднання володіє вищими властивостями, ніж чисті метали. Елемент, що входить до складу сплаву, називається компонентом. Компонент, переважаючий в сплаві кількісно, називаєтьсяосновним. Компоненти, що вводяться в сплав для додання йому потрібних властивостей, називаються легуючими. Сукупність компонентів сплаву називається системою. Залежно від природи компонентів і від співвідношення їх масових кількостей сплави після твердіння можуть утворювати механічні суміші, тверді розчини і хімічні сполуки. Завжди виходять з випадку необмеженої розчинності металів в рідкому стані.
Види сплавів:
Більшість металів при їх сумісному стопленні змішуються один з одним і, кристалізуючись, утворюють стопи чи інтерметаліди. Всі стопи, як і метали, у твердому стані є кристалічними. Стопи поділяють на однорідні й неоднорідні. Більшість стопів належить до неоднорідних.
Однорідні стопи (сплави) утворюються в тих випадках, коли атоми одного металу можуть заміщатися атомами іншого металу у вузла кристалічних ґраток. За такого заміщення творяться кристали зі структурою, що схожа на структуру вихідних металів, проте з атомами різного ґатунку, чим і зумовлена однорідність стопу (сплаву). Такі стопи звуть твердими розчинами. Тверді розчини утворює Аурум з Арґентумом, Нікол з Купрумом, тощо.
Неоднорідні сплави є механічною сумішшю кристалітів металів. До того ж кожний з металів зберігає свою кристалічну ґратку. Наприклад, структура стопів Стануму зПлюмбумом, які використовують як м'які припої, складається з кристалітів чистого Стануму та кристалітів чистого Плюмбуму.
Інші стопи (сплави)
Стопи можуть творити не лише два, а й кілька металів. Стопи з трьох металів звуть потрійними, тощо. Крім того, до складу стопів можуть уходити й неметали —Карбон, Фосфор, Сульфур тощо.
Деякі метали, стоплюючись, творять хімічні сполуки. До того ж одні хімічні сполуки підлягають правилам звичайної валентності (н-д, Mn2Sn, Mg2Pb тощо), а деякі не підлягають (н-д, CuZn3, Cu3Sn, Fe3C тощо). Хімічні сполуки металів характеризуються власними кристалічними ґратками, відмінними від кристалічних ґраток металів, які входять до їхнього складу. За надлишку одного з металів хімічні сполуки можуть творити як тверді розчини, так і механічні суміші.
![]()
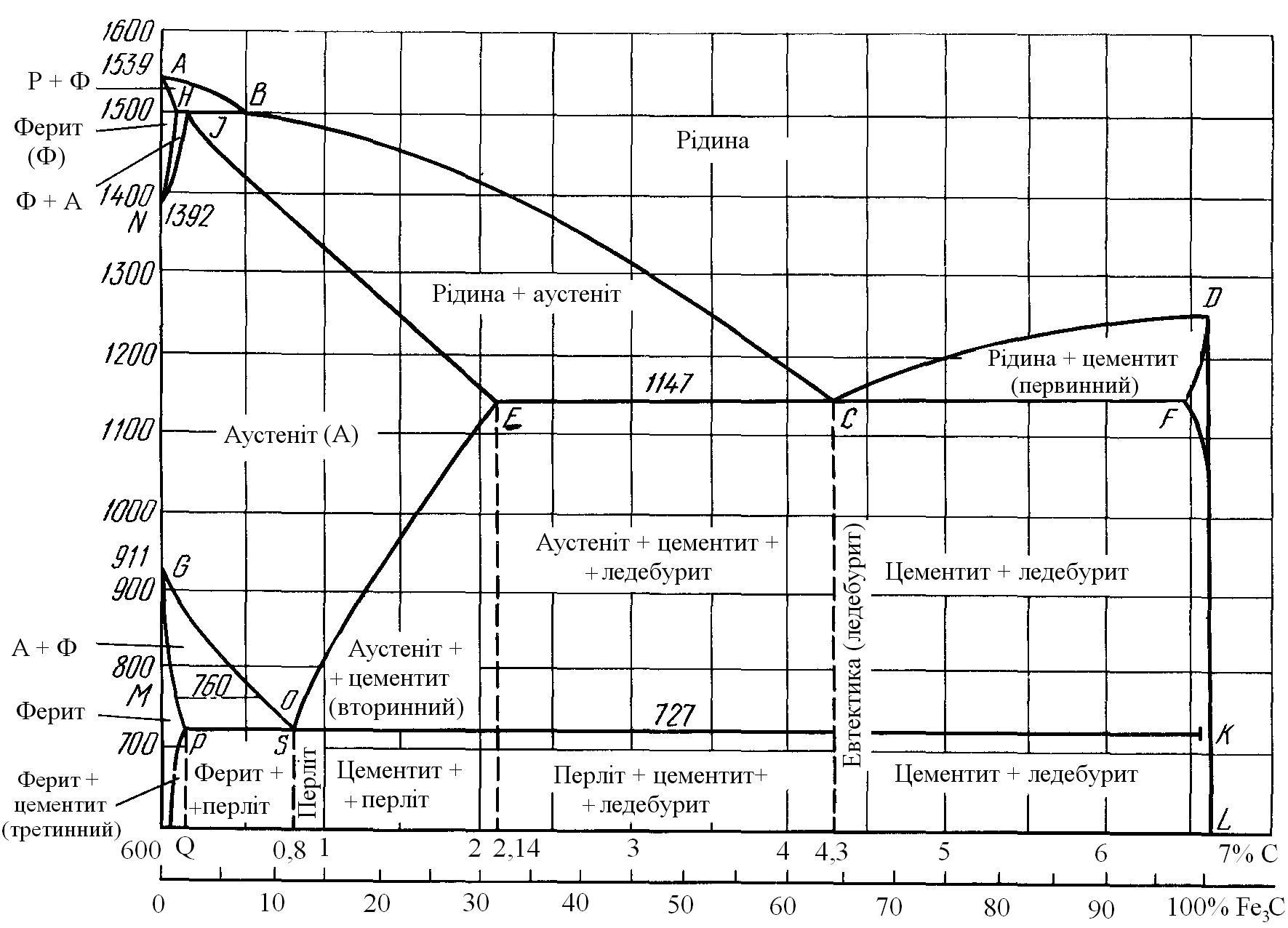
Головна частина діаграми стану сплавів «залізо-вуглець»
Діагра́ма ста́ну (діагра́ма фа́зової рівнова́ги) спла́вів «залі́зо-вугле́ць» — графічне відображення фазового стану сплавів заліза з вуглецем в залежності від їх хімічного складу і температури. Фазова діаграма стану «залізо-вуглець» є фундаментом науки просталь і чавун, як сплави заліза з вуглецем.
Вуглець із залізом утворює хімічну сполуку Fe3C (цементит) або може перебувати у сплаві у вільному стані у вигляді графіту. Відповідно є дві діаграми сплавів «залізо-вуглець»: цементитна і графітна. Оскільки на практиці застосовують сплави заліза із вмістом вуглецю до 6,67% (що відповідає вмісту вуглецю у цементиті), то зазвичай розглядається частина діаграми стану від чистого заліза до вмісту вуглецю 6,67%, що відповідає цементиту і вона носить назву «цементитна». Оскільки цементит фаза метастабільна, то і відповідна діаграма називається метастабільною (суцільні лінії на рисунку).
Для сірих чавунів і графітизованих сталей слід розглядати стабільну діаграму «залізо-графіт» (Fe-Гр) оскільки саме графіт є стабільною фазою. Цементит утворюється набагато швидше графіту і в багатьох сталях і білих чавунах може існувати досить довго. У сірих чавунах графіт існує обов'язково. На рисунку тонкими пунктирними лініями показані лінії стабільної рівноваги (тобто за участю графіту), там де вони відрізняються від ліній метастабільної рівноваги (за участю цементиту), а відповідні точки позначені штрихом.
Правило фаз - встановлює залежність між числом компонентів, числом змінних зовнішніх факторів рівноваги і числом фаз.
![]() ,
,
Правило відрізків
Для
визначення кількості складових
користуються «правилом відрізків». З
точки ^ Кпроводять
перпендикуляр, відповідний сплаву 80%Sb
і 20%Pb.
Потім при заданій температурі t через
точку d проводять
горизонтальну пряму до перетину з
лініями, що обмежують дану область
діаграм, отримуючи точки e і b.
Якщо позначити масу рідини буквою Ж,
а масу всього сплаву буквою В,
то можна записати:
![]()
Таким чином, «правило відрізків» дозволяє вирішити: 1) які існують фази двох- і багатофазних областей; 2) визначити хімічний склад або концентрацію фаз для певних температур; 3) встановити кількісне співвідношення між фазами.
Основні види діаграм стану
Для
характеристики змін структури сплавів
залежно від складу і температури будують
діаграми стану. Вони є графічним
зображенням рівноважного або нерівноважного
стану сплавів і будують їх в координатах
температура - стан.
Знання
діаграм стану дозволяє науково
обґрунтовано вибирати сплави із заданими
властивостями, режими литва, термічної
обробки і обробки тиском.
Діаграми
стану звичайно будують за допомогою
термічного методу аналізу. Суть цього
методу - визначення критичних
точок.
Будують
криві охолодження, які виражають графічну
залежність між зміною температури
металу (сплаву) при охолодженні й часом,
протягом якого ці зміни відбуваються.
Ці криві будують в координатах: ![]() -
вісь ординат,
-
вісь ординат, ![]() (час
охолодження) - вісь абсцис.
Фазові
перетворення в металах і сплавах
супроводжуються тепловими ефектами і
на кривих охолодження можна спостерігати
зупинки (площадки) або перегини. Поява
площадок говорить про те, що фазові
перетворення відбуваються при постійній
температурі. Перегини з'являються в
результаті зміни швидкості охолодження,
в цьому випадку фазові перетворення
протікають в інтервалі температур.
Деякі
критичні точки, будучи визначені при
нагріві й охолодженні, мають різну
температуру.
(час
охолодження) - вісь абсцис.
Фазові
перетворення в металах і сплавах
супроводжуються тепловими ефектами і
на кривих охолодження можна спостерігати
зупинки (площадки) або перегини. Поява
площадок говорить про те, що фазові
перетворення відбуваються при постійній
температурі. Перегини з'являються в
результаті зміни швидкості охолодження,
в цьому випадку фазові перетворення
протікають в інтервалі температур.
Деякі
критичні точки, будучи визначені при
нагріві й охолодженні, мають різну
температуру.
Початок і кінець фазових перетворень температури, визначувані по кривих охолодження, називаються критичними. Відповідні ним точки на кривих охолодження називаються критичними точками. На основі кривих охолодження будується діаграма стану сплавів. Діаграма стану подвійних сплавів першого типу, які створюють при твердінні механічну суміш, характеризує сплави, компоненти яких в рідкому стані необмежено розчинні один в одному, а в твердому стані не розчинні і не утворюють хімічної сполуки.
Діаграма стану подвійних сплавів другого типу - характеризує сплави, компоненти яких володіють повною взаємною розчинністю, як в рідкому, так і в твердому стані і не утворюють хімічних сполук.
Діаграма стану сплавів з обмеженою розчинністю у твердому стані третього типу характеризує сплави, в яких обидва компоненти необмежено розчинні в рідкому стані, обмежено - в твердому і утворюють при кристалізації евтектику.
Діаграма стану із стійкою хімічною сполукою четвертого типу - характеризує сплави, компоненти яких необмежено розчинні в рідкому стані, не розчинні в твердому і утворюють стійку хімічну сполуку.
Зв'язок діаграм стану сплавів з їхніми властивостями
Зв’язок
властивостей сплавів з типом діаграм
стану вперше показав Н.С. Курніков, далі
роботи в цьому напрямку проводив А.А,
Бочвар.
По
осях ординат на графіках відкладають
властивості сплавів (твердість, міцність,
електропровідність та ін.), а по осях
абсцис - зміст компонента F%.
I.
У разі утворення механічної суміші
властивості сплавів міняються за лінійним
законом.
II.
У разі утворення твердих розчинів
властивості змінюються за криволінійною
залежністю.
При невеликих добавках другого твердого
компонента електроопір стає вищим, ніж
властивості компонентів, електропровідність
і магнітна проникність знижуються.
Рис.11
- Зв'язок властивостей сплавів з типом
діаграм станів
I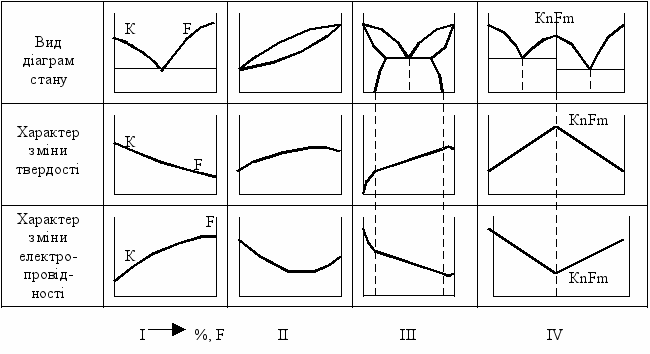 I.
Обмежені тверді розчини. Властивості
однофазних твердих розчинів змінюються
за криволінійною
залежністю,
а двофазних - за
прямолінійним законом.
IV.
Утворення хімічних сполук - властивості
змінюються стрибком. Хімічна сполука
відповідає max або minвластивостям
на прямій. Ця точка називається
«сингулярною
точкою».
Знаючи
діаграму стану, можна визначити і
технологічні властивості сплаву
(ливарний, обробка різанням та ін.).
Наприклад, тверді розчини мають низькі
ливарні характеристики, а двофазні,
особливо евтектичні, мають хороші
ливарні властивості. Краще деформуються
в холодному і гарячому стані однофазні
сплави. Двофазні сплави легко обробляти
різанням. У однофазних сплавів краща
координатна стійкість.
I.
Обмежені тверді розчини. Властивості
однофазних твердих розчинів змінюються
за криволінійною
залежністю,
а двофазних - за
прямолінійним законом.
IV.
Утворення хімічних сполук - властивості
змінюються стрибком. Хімічна сполука
відповідає max або minвластивостям
на прямій. Ця точка називається
«сингулярною
точкою».
Знаючи
діаграму стану, можна визначити і
технологічні властивості сплаву
(ливарний, обробка різанням та ін.).
Наприклад, тверді розчини мають низькі
ливарні характеристики, а двофазні,
особливо евтектичні, мають хороші
ливарні властивості. Краще деформуються
в холодному і гарячому стані однофазні
сплави. Двофазні сплави легко обробляти
різанням. У однофазних сплавів краща
координатна стійкість.
Алотропія
Алотропія (поліморфізм) заліза визначає перетворення у сталях при їх охолодженні від аустенітного стану.
Основні структурні складові у залізовуглецевих славах
Ферит (Ф) - твердий розчин проникнення вуглецю в α-залізо. Ферит має ОЦК- ґратку (К8). Структура фериту складається з однієї фази змінного складу, тобто твердого розчину. Максимальна розчинність вуглецю в α - залізі дорівнює 0,025% при температурі 727°С; мінімальна розчинність (при кімнатній температурі) дорівнює 0,006%. 3. Аустеніт (А) - твердий розчин проникнення вуглецю в γ-залізо. Аустеніт має ГЦК-ґратку (К12). Структура аустеніту - твердий розчин змінного складу. Максимальна розчинність вуглецю в γ-залізі дорівнює 2,14% при температурі 1147°С; мінімальна розчинність дорівнює 0,8% при температурі 727°С. З наведених даних випливає, що розчинність вуглецю в γ-залізі значно більша, ніж в α-залізі (при температурі 727°С ≈ 32 рази). Це пояснюється тим, що в центрі елементарної комірки К12 є «дірка» (порожнеча) великих розмірів, в яку вільно може проникнути атом вуглецю. У еле-ментарній комірці К8 є дірки всередині кожного ребра куба, їх багато, тому щільність цієї ґратки менша, ніж ґратки К12, проте розмір дірок значно менший за розмір атомів вуглецю. 4. Цементит (Ц) - карбід заліза, хімічна сполука заліза з вуглецем, що містить 6,67% вуглецю. Він має складну кристалічну ґратку, високу твердість (НВ = 800 кгс/мм2) і крихкість, що говорить про високу температуру плавлення (~ 1600оС). Відрізняється від заліза і графіту металевим блиском, тепло- та електропровідністю, слабкими магнітними властивостями. Розрізняють: а) первинний цементит ЦІ. Він виділяється при кристалізації з рідкої фази в усіх залізовуглецевих сплавах, що містять вуглецю більше 4,3 % (нижче лінії DС, рис. 1); б) вторинний цементит ЦII виділяється при вторинній кристалізації з аустеніту по лінії ES, у всіх залізовуглецевих сплавів, що містять вуглецю більше 0,8% в інтервалі температур від 1147 до 727°С; в) третинний цементит ЦIII виділяється при третинній кристалізації з фериту в усіх залізовуглецевих сплавів, що містять вуглецю більше 0,006% в інтервалі температур від 727 до 0°С. Якщо у залізовуглецевих сплавах знаходяться одночасно кілька різновидів цементиту (наприклад, у сплавах, що містять вуглецю більше 4,3%, при нормальній температурі наявні ЦI, ЦII, ЦIII, а також цементиту, що входить до складу ледебуриту і перліту) - всі вони є однією фазою, тобто хімічною сполукою, оскільки мають один і той самий хімічний склад, будову та властивості. В системі залізо-вуглець формуються наступні структурні складові. Ледебурит (Л)- евтектична механічна суміш, утворюється з рідкої фази певного постійного складу 4,3% С при температурі 1147°С. При температурі 1147 і до 727°С ледебурит складається з двох фаз - аустеніту і цементиту. Перліт (П) - евтектоїдна механічна суміш, утворюється при розпаді аустеніту певного постійного складу 0,8% С при температурі 727°С. Евтектоїд цей названий перлітом, тому що після травлення сталі, що містить 0,8% С, її по-верхня має своєрідний блиск. Перліт складається з двох фаз: фериту і цементиту.
Структура сталей і білих чавунів
Залізовуглецеві сплави, які містять до 0,02 %С мають назву технічне залізо. Якщо вміст вуглецю складає від 0,02 % до 2,14 %, то такі сплави називаються сталями, а вище 2,14% - чавунами.
Технічне залізо, що вміщує менш ніж 0,0002 %С при кімнатній температурі, має структуру фериту.
При збільшенні вмісту вуглецю до 0,02 % на межах зерен з'являються прошарки третинного цементиту. Його поява знижує пластичність заліза. Цементит, як і ферит, після травлення розчином азотної кислоти у спирті залишається світлим, протравлюються тільки границі зерен. Для посилення контрасту між цементитом та феритом мікрошліф протравлюють пікратом натрія, який надає цементиту темного кольору.
Залежно від вмісту вуглецю сталі поділяють на:
доевтектоїдні, що вміщують до 0,8 %С. Структура цих сталей - світлі зерна фериту та темні перліту. При великому збільшенні перліт виглядає під мікроскопом як набір світлих пластин фериту та цементиту, які чергуються і мають темні границі між собою. При невеликому збільшенні (у 100...200 разів) границі таких пластин зливаються, що надає перліту темного забарвлення. Разом із збільшенням вмісту вуглецю кількість перліту збільшується, а фериту - зменшується .
евтектоїдну, що вміщує 0,8 %С. Структура сталі перлітна.
заевтектоїдні, що вмішують понад 0,8 %С. Структура цих сталей -темні зерна перліту, на границі між ними світла сітка цементиту.
Властивості сталі, як і структура, залежать від вмісту вуглецю. Структуру сталей формують дві фази: пластичний та м'який ферит (HB 80...100) і крихкий, твердий цементит (HB 800).
Із збільшенням вмісту вуглецю в сталі кількість цементиту зростає, а фериту знижується, що і зумовлює підвищення твердості та зниження пластичності і в'язкості (рис.12). Частки цементиту збільшують опір переміщенню дислокацій, тобто збільшують границю міцності та границю текучості. Проте при вмісті вуглецю більше 0,8...1,O % границя міцності зменшується, що пояснюється виділенням у таких сталях по межах перлітних зерен суцільної сітки дуже крихкого вторинного цементиту. При випробуваннях на розтяг у цій сітці з'являються високі напруги і має місце руйнування зразка при відносно невеликому навантаженні. Мікроструктурний аналіз дає можливість більш-менш точно визначити вміст вуглецю в сталі. Якщо не враховувати дуже малого вмісту вуглецю в фериті, можна вважати, що в доевтектоїдних сталях весь вуглець міститься в перліті.
![]()
де П% - площа, що займає перліт.
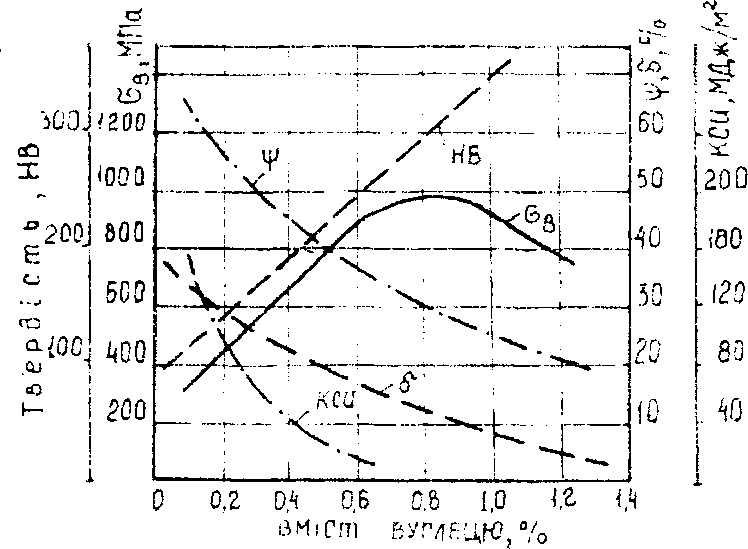
Рис. 12. Залежність механічних властивостей сталей від
