
- •ФІЗИЧНА ТА КОЛОЇДНА ХІМІЯ
- •КИЇВ НУХТ 2012
- •ВСТУП
- •Лабораторна робота № 1
- •Теоретичні відомості
- •Поверхневий натяг розчинів оцтової кислоти
- •Лабораторна робота № 8
- •Прилади, лабораторний посуд та реактиви
- •Опрацювання результатів
- •Таблиця 8.1
- •Результати розрахунку адсорбції на межі поділу тверде тіло – рідина
- •Номери
- •Лабораторна робота № 9
- •Теоретичні відомості
- •Прилади, лабораторний посуд, реактиви
- •Перевірка на ефект Тіндаля
- •Одержання емульсії типу М/В
- •Одержання емульсії типу В/М
- •Одержання емульсій, стабілізованих порошками
- •Емульсії соняшникової олії у воді
- •Опрацювання результатів
- •Лабораторна робота № 10
- •Теоретичні відомості
- •Швидкість електрофоретичного перенесення визначають за рівнянням:
- •Градієнт потенціалу дорівнює:
- •Прилади, лабораторний посуд, реактиви
- •Опрацювання результатів
- •Лабораторна робота № 11
- •Теоретичні відомості
- •Опрацювання результатів
- •Лабораторна робота № 12
- •Теоретичні відомості
- •Лабораторна робота № 12.1
- •Прилади, лабораторний посуд, реактиви
- •Опрацювання результатів
- •Лабораторна робота № 12.2
- •Опрацювання результатів
- •Результати дослідження кінетики набухання желатину
- •Залежність граничного набухання желатину від рН розчину
- •Порядок виконання роботи
- •Опрацювання результатів
- •Залежність граничного ступеня набухання желатину від рН розчину
- •Прилади, лабораторний посуд та реактиви
- •Опрацювання результатів
Ізобутиловий спирт |
74,1 |
0,81 |
1,00 |
Ізоаміловий спирт |
88,2 |
0,82 |
0,30 |
Опрацювання результатів
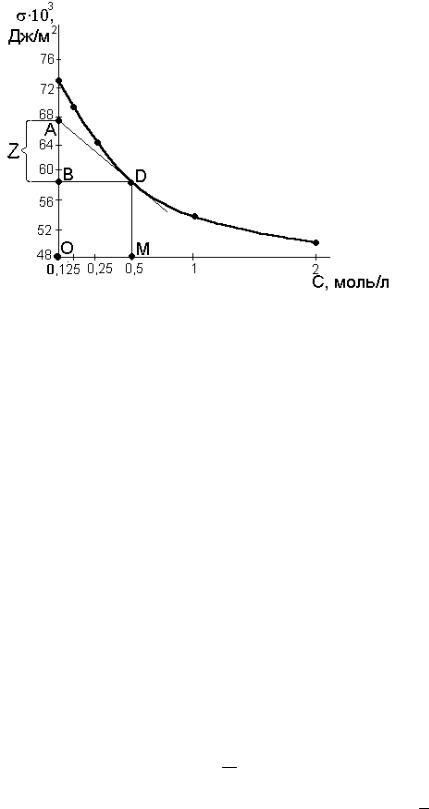
1. Експериментальні дані, отримані при роботі з2 н розчином оцтової кислоти при 20 ºС наведено в таблиці7.2. За даними таблиці в координатах s = f(С) побудована ізотерма поверхневого натягу розчинів оцтової кислоти при 20ºС (рис. 7.4).
|
|
|
|
Таблиця 7.2 |
|
|
Поверхневий натяг розчинів оцтової кислоти |
|
|||
|
|
Концентрація |
Кількість |
Поверхневий |
|
№ п/п |
|
ПАР |
краплин рідини |
||
|
натяг σ·103, Дж/м2 |
||||
|
|
С, моль/л |
n, шт. |
|
|
1 |
|
0 |
40 |
72,75 |
|
2 |
|
0,125 |
45 |
64,67 |
|
3 |
|
0,250 |
49 |
59,39 |
|
4 |
|
0,500 |
52 |
55,96 |
|
5 |
|
1,000 |
56 |
51,96 |
|
6 |
|
2,000 |
58 |
50,17 |
|
2. Ізотерму |
адсорбції |
Гіббса |
|
|
|
|
за |
ізотермою |
поверхневого |
натягу |
||||||||||||
розраховують та будують на підставі таких міркувань. Зв’язок між гіббсівською |
|
|||||||||||||||||||||
адсорбцією, |
концентрацію |
ПАР |
|
та |
зміною |
|
поверхневого |
натягу |
||||||||||||||
концентрацією встановлюється рівнянням Гіббса |
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
Γ = - |
|
|
C |
× |
dσ |
. |
|
|
|
|
(7.9) |
|
||||||
|
|
|
|
R ×T |
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
dC |
|
|
|
|
|
|
|||||||
Кожній концентрації С на кривій ізотерми поверхневого натягу(рис. 7.4) |
|
|||||||||||||||||||||
відповідає |
своє |
значення похідної |
dσ |
|
, |
що |
входить |
у |
|
рівняння |
Гіббса |
і |
||||||||||
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
dC |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
використовується |
для |
розрахунку |
|
адсорбціїГ. За |
методом графічного |
|
||||||||||||||||
розв’язування ізотерми |
поверхневого натягуσ = f(C) до |
цієї кривої в п’яти |
|
|||||||||||||||||||
точках, що відповідають п’яти концентраціям робочих розчинів ПАР у воді, |
|
|||||||||||||||||||||
проводять дотичні та горизонтальні лінії до перетину з віссю ординат (рис. 7.4). |
|
|||||||||||||||||||||
Довжина відрізка BD у трикутнику ABD дорівнює довжині відрізкаОМ і |
|
|||||||||||||||||||||
відповідає концентрації розчину оцтової кислоти0,250 моль/л. Позначивши |
|
|||||||||||||||||||||
відрізок АВ літерою z, наводимо його в одиницях поверхневого натягу та |
||||||||||||||||||||||
одержуємо: |
|
|
|
|
|
Z |
|
|
|
|
dσ |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
= - |
|
|
|
|
(7.14) |
|
||||||||||
|
|
|
|
|
|
|
dC |
|
|
|
|
|||||||||||
або |
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
dσ |
|
|
|
|
|
|
|||
|
|
|
|
|
|
Z = -C × |
. |
|
|
(7.15) |
|
|||||||||||
|
|
|
|
|
|
dC |
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
55 |
|
3. Після підстановки z у рівняння Гіббса(7.9) отримуємо рівняння для
розрахунку значень адсорбції(Г) ПАР у поверхневому |
моношарі на межі |
||
поділу розчин – повітря: |
|
||
Γ = |
1 |
×Z . |
(7.16) |
|
|||
|
RT |
|
|
Рис. 7.4. Ізотерма поверхневого натягу розчинів оцтової кислоти у воді та її графічне опрацювання
Отже, кожному значенню концентрації на ізотермі поверхневого натягу відповідає свій відрізок Z і відповідно своє значення Г. Ці значення заносять до табл. 7.3.
|
|
|
|
Таблиця 7.3 |
|
Розрахунок значень адсорбції Гіббса (R=8,314 Дж/(моль×К)) |
|||||
№ пор. |
Концентрація |
Відрізок Z·103, |
Адсорбція Г, |
|
|
ПАР С, моль/л |
Дж/м2 |
|
моль/м2 |
||
1 |
0,125 |
|
|
|
|
2 |
0,250 |
|
|
|
|
3 |
0,500 |
|
|
|
|
4 |
1,000 |
|
|
|
|
5 |
2,000 |
|
|
|
|
4. Побудову |
ізотерми адсорбції Гіббса |
проводять у координатах |
|||
(Г, моль/м2) =f(С, моль/л).
5.Для розрахунку ємності моношаруГ¥ , моль/м2, користуються рівнянням Ленгмюра, приведеного до рівняння прямої (7.13).
6.Будують графік у координатах C = f(C) (рис. 7.3) і визначають значення
Γ
граничної адсорбції Г¥ як котангенс кута нахилу прямої: ctgα = a = Γ ¥ , моль/м2. b
56
