
- •1. Предмет і завдання курсу "біохімія"
- •2. Історія розвитку біохімії
- •3. Рівні структурної організації та хімічний склад живих організмів.
- •Відокремлюється тільки при хімічній взаємодії, зокрема при відщепленні гідроксильних (-он) груп від окремих молекул
- •Осмотичне утримування
- •Добова потреба організму у воді - 2,5...3,0 л.
- •4.Роль обміну речовин у життєдіяльності організму
- •1. Білки. Амінокислотний склад
- •2. Біологічна роль білків в організмі
- •3. Сучасні уявлення про структуру білків у білках розрізняють чотири рівні структурної організації:
- •4. Фізико-хімічні властивості білків
- •1. Нуклеїнові кислоти, їх хімічна природа
- •2. Відмінні властивості днк і рнк
- •3. Будова нуклеозидів та нуклеотидів
- •4. Атф - хімічна природа, біологічна роль
- •5.Структура нуклеїнових кислот
- •Тема 5. Ферменти
- •1. Ферменти як біологічні каталізатори
- •2. Хімічна природа та будова ферментів
- •3. Механізм дії ферментів та основи кінетики каталізу
- •4. Активність ферментів, вплив на неї різних факторів. Властивості ферментів
- •5. Номенклатура та класифікація ферментів
- •6. Використання ферментів у харчових технологіях
- •1. Класифікація вітамінів, їх біологічна роль
- •2. Будова вітамінів та їх добова потреба
- •3.Антивітаміни.Гормони
- •Тема 7. Основні поняття динамічної біохімії. Вільна енергія. Механізм дихального ланцюга
- •1. Динамічна біохімія. Вільна енерпя
- •(Окислення, відновлення, гідроліз, фосфорилювання таін.)
- •2. Біологічне окиснення. Тканинне дихання. Дихальний ланцюг
- •3. Окиснювальне фосфорилювання
- •Теми 8-9. Вуглеводи та їх обмін
- •1. Вуглеводи, їх функції
- •2. Класифікація вуглеводів
- •3. Характеристика основних представників вуглеводів
- •4. Перетравлювання та всмоктування вуглеводів в організмі людини
- •5. Взаємоперетворення моносахаридів в організмі
- •6. Анаеробне перетворення вуглеводів -хімізм гліколізу
- •7. Аеробне перетворення вуглеводів. Цикл кребса
- •8. Поняття про пентозний цикл перетворення вуглеводів
- •9. Біосинтез вуглеводів в організмі
- •9. Фотосинтез. Синтез оліго- та полісахаридів
- •25 – 30 Г/добу
- •Теми 10 -11. Ліпіди та їх обмін
- •1. Функції ліпідів в організмі
- •2. Класифікація ліпідів
- •3. Хімічна природа простих та складних ліпідів
- •4.Перетворення ліпідів у шлунково-кишковому тракті
- •5. Внутрішньоклітинний обмін ліпідів
- •6. Біосинтез ліпідів
- •Модуль 3 Тема 12. Білковий обмін
- •1. Перетворення білкових речовин у шлунково-кишковому тракті
- •2. Катаболізм білкових речовин в організмі. Хімізм перетворень
- •4. Синтез білків
- •Тема 13. Взаємозв'язок обмінних процесів
- •1. Взаємозв'язок основних видів обміну речовин
- •2. Ключові метаболіти - ланки переходу вуглеводного, білкового та ліпідного обмінів
- •2.Боєчко ф. Ф. Біологічна хімія. - к.: Вища шк., 1995. - 538 с.
- •3.Филиппович ю.Б. Основн биохимии. -м.: Висш. Шк., 1985. -503с.
- •4.Комов в.П., Шведова в.Н. Биохимия: Учеб. Для вузов. - м.: Дрофа, 2006. - 638с. Для студ Тмя та Тмо
Тема 5. Ферменти
Нові терміни, поняття: каталіз, ферменти, коферменти, активатори, інгібітори, простетичні групи, субстрат, апофермент, холофермент, кофактор, активний центр, алостерич-ний центр, модулятори, ефектори, рибозіми
1. Ферменти як біологічні каталізатори
!! Ферменти - це біологічні каталізатори білкової природи, що виробляються живими клітинами, але в своїй дії від них не залежать (від лат.fermentum - закваска, enzyme - в дріжджах).
Відмінні властивості ферментів від небіологічних каталізаторів
Майже всі ферменти є білками. У 80-х роках відкриті рибозіми -ферменти, утворені з РНК.
Ферментативні реакції проходять в 106- 10!2 разів швидше за некоферментативні реакції у водному розчині.
Ферменти здатні каталізувати реакціїу відносно м'яких умовах (при температуратурі 25-40°С, атмосферному тиску, фізіологічній концентрації іонів водню (рН 7,0 - 7,5)).
Ферменти характеризується специфічністю, яка обумовлена конформаційною і електростатичною комплементарністю ферменту субстратом (речовиною, на яку діє фермент).
Дія більшості ферментів високо специфічна. Поняття специфічності відноситься не тільки до типів каталітичних реакцій (реакційна специфічність), але й до природи сполук -субстратів (субстратна специфічність).
Приклади реакційної специфічності
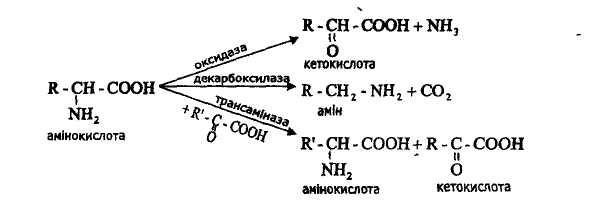
Специфічність ферментів по відношенню до субстратів
Абсолютна специфічність - фермент каталізує лише одну реакцію. Абсолютна специфічність характерна для уреази, яка каталізує гідролітичне розщеплення сечовини.
Групова специфічність виявляється тоді, коли фермент каталізує реакцію одного класу речовин, наприклад, окиснення амінокислот, або діє на певний тип зв'язку в молекулі, наприклад, розщеплення пептидного зв'язку.
Стереоспецифічність (просторова) - фермент каталізує реакцію перетворення певних оптично активних сполук, наприклад, тільки L-амінокислот, або D-амінокислот (оксидази L-амінокислот, оксидази D-амінокислот), або цис- і транс-ізомерів.
2. Хімічна природа та будова ферментів
► Ферменти є біокаталізаторами, тобто речовинами біологічного походження, які прискорюють хімічні реакції. Організована послідовність процесів обміну речовин можлива при умовах, коли кожна клітина забезпечена власним генетично заданим набором ферментів. Тільки за таких умов здійснюється погоджена послідовність метаболічних реакцій.
► Ферменти (ензими, Е) утворюються в клітинах живих організмів і здатні прискорювати в них перебіг хімічних реакцій. Ферменти також містяться у різних рідинах організмів, наприклад, слині (амілаза), шлунковому соку (пепсин), соку підшлункової залози (ліпаза, амілаза та ін.) тощо.
За хімічною природою розрізняють прості та складні ферменти
Прості ферменти (однокомпонентні), так само, як і прості білки, при гідролізі розщеплюються до амінокислот. Прикладом простих ферментів є естераза печінки (альбуміни), уреаза, трипсин (глобуліни) та ін. Більшість простих ферментів каталізує реакції гідролізу (пепсин, трипсин, рибонуклеаза).
Складні ферменти (двокомпонентні) - належать до групи складних білків. Такі ферменти, крім білкової частини (апоферменту), містять групу небілкової природи - кофактор. Весь активний комплекс називається холоферментом.
Х
 олофермент
Апофермент + Кофактор
олофермент
Апофермент + Кофактор
Класифікація кофакторів



Кофермент
Простетичні
групи (ФМН,
ФАД, ТПФ)
Активатори
(Са2+,Мn2+
,Zn2+
тощо)
! Якщо група небілкового походження (кофактор) сполучена з білковою частиною ферменту слабкими електростатичними або ван-дер-ваальсівськими силами, то вона має назву - кофермент. Основними коферментами є НАД*, ФАД, КоА та ін.
Будова ферментів
В молекулах ферментів розрізняють активні та алостеричні центри.
В активному центрі (АЦ) є субстратна та каталітична ділянки.
!! Субстратна (контактна, якірна) ділянка відповідає за приєднання ферментів до субстрату.
!! Каталітична ділянка відповідає за перетворення субстрату.
Роль АЦ у простих ферментах виконують просторово орієнтовані залишки амінокислот (Сер, Гіс, Тир, Тре, Цис, Глу, Асп).
У складних ферментах - роль АЦ виконують кофактори та безпосередньо сполучена з ними частина апоферменту
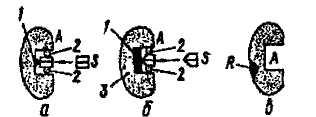
Будова молекули простого (а), складного (б) і алостернчного (в) ферментів:
А - активний центр; S - субстрат; R - алостеричний центр; 1 -каталітична ділянка; 2 - контактна ділянка; 3 - кофактор
!! Алостеричний центр - це регуляторна ділянка, приєднання до якої речовин, що не мають структурної спорідненості з субстратом призводить- до зміни конформації (просторової структури) ферменту і різкої зміни його активності.
Розрізняють негативні та позитивні модулятори або ефектори.
