
- •1. Фізичні основи класичної механіки Основні формули Елементи кінематики
- •Елементи динаміки
- •Приклади розв’язання задач.
- •Тема № 2. Молекулярна фізика та термодинаміка. Основні формули
- •Окремі випадки розподілу Гіббса:
- •Приклади розв’язання задач Приклад 1. Знайти густину кисню при нормальних умовах.
- •Тема №3 електростатика. Електричний струм. Основні формули
- •Приклади розв’язання задач.
- •Тема № 4 електромагнетизм Основні формули
- •Коливання та хвилі Основні формули
- •Приклади розв’язання задач
- •Тема №5
- •Основні формули
- •Фотометрія
- •Геометрична оптика
- •Хвильова оптика
- •Елементи релятивістської динаміки
- •Квантова теорія випромінювання. Фотони.
- •Приклади розв’язання задач
Окремі випадки розподілу Гіббса:
а) розподіл молекул по швидкостям (закон Максвелла)
![]() (2.36)
(2.36)
де
N
– кількість молекул, відносні швидкості
яких лежать в інтервалі від u до u +
u;
![]() –
відносна швидкість,
– швидкість молекули і
–
відносна швидкість,
– швидкість молекули і
![]() –найбільш
імовірна швидкість молекул;
–найбільш
імовірна швидкість молекул;
N – загальне число молекул;
При розв’язуванні задач на розподіл молекул по швидкостям зручно використовувати таблицю (1)
Таблиця 2.1
|
U |
|
U |
|
U |
|
|
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 |
0 0,02 0,09 0,18 0,31 0,44 0,57 0,68 0,76 |
0,9 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 |
0,81 0,83 0,82 0,78 0,71 0,63 0,54 0,46 0,36 |
1,8 1,9 2,0 2,1 2,2 2,3 2,4 2,5 |
0,29 0,22 0,16 0,12 0,09 0,06 0,04 0,03 |
б) барометрична формула (у припущенні, що температура в усіх точках однакова) дає залежність тиску газу від висоти h в полі сили тяжіння
![]() (2.37)
(2.37)
де
![]() – тиск на висоті h = 0; g – прискорення
сили тяжіння.
– тиск на висоті h = 0; g – прискорення
сили тяжіння.
Рівняння стану реального газу (рівняння Ван-дер-Ваальса) для одного моля
![]() (2.38)
(2.38)
де
![]() – об’єм моля; a і b – постійні, які
залежать від природи газу.
– об’єм моля; a і b – постійні, які
залежать від природи газу.
Рівняння для будь-якої кількості газу
![]() (2.39)
(2.39)
Постійні a і b зв’язані з критичними параметрами співвідношеннями
![]()
![]() (2.40)
(2.40)
Властивості рідини.
Коефіцієнт поверхневого натягу рідини
![]() або
або ![]() (2.41)
(2.41)
де F – сила поверхневого натягу, яка діє на контур довжиною l, що обмежує поверхню рідини; W – енергія, яку треба затратити для збільшення площі поверхні на величину S.
Формула Лапласа для додаткового тиску, викликаного кривиною поверхні рідини
![]() (2.42)
(2.42)
де
![]() і
і![]() - радіуси кривини двох взаємно
перпендикулярних перерізів поверхні
рідини. Радіус вважається додатним,
якщо меніск опуклий і від’ємним, якщо
меніск угнутий.
- радіуси кривини двох взаємно
перпендикулярних перерізів поверхні
рідини. Радіус вважається додатним,
якщо меніск опуклий і від’ємним, якщо
меніск угнутий.
Висота підняття рідини у капілярі
![]() (2.43)
(2.43)
де r – радіус капіляра; - густина рідини; - крайовий кут. При повному змочуванні = 0, при повному незмочуванні = 180.
Приклади розв’язання задач Приклад 1. Знайти густину кисню при нормальних умовах.
Розв’язання
Застосуємо рівняння Менделєєва – Клапейрона (2.3)
![]() (1)
(1)
де P – тиск газу, V – об’єм газу; m – маса газу; M – молярна маса газу; R – газова постійна; T – термодинамічна температура.
Густина речовини
![]() (2)
(2)
Розв’язуємо сумісно (1) і (2). Для цього з (2) виразимо m і підставимо в (1)
![]() або
або ![]()
звідки ![]()
Перевіримо одиницю вимірювання
![]()
Підставимо числові дані.
При
нормальних умовах P = 760 мм. рт. ст.
![]() ,
T = 0
С = 273К;
,
T = 0
С = 273К;
R
= 8,31 Дж / (моль
K), M =
![]() .
.
![]()
Відповідь
![]()
Приклад2. Скільки молекул міститься у посудині ємністю 5л, заповненому вуглекислим газом? Температура у посудині 127 С, тиск 0,1 МПа.
Розв’язання
Кількість
молекул ![]() ,
,
де
– кількість речовини;
![]() – постійна Авогадро.
– постійна Авогадро.
Кількість речовини знайдемо, скориставшись рівнянням Менделєєва – Клапейрона (2.3)
![]()
де P – тиск газу, V – об’єм газу; R – газова постійна;
T – термодинамічна температура.
![]()
Тоді ![]()
Перевіримо одиницю вимірювання.
![]() (безрозмірна
величина).
(безрозмірна
величина).
Підставимо числові дані, виразивши їх в системі Сі
![]()
Т = 127 + 273 = 400К
![]()
![]()
Відповідь ![]()
Приклад 3. У балоні об’ємом 5л міститься гелій під тиском 2МПа і температурі 127 С. Після того як з балону було взято деяку масу гелію, температура у балоні зменшилась на 10 градусів, а тиск зменшився до 1,5 МПа. Яку масу гелію було взято з балону?
Розв’язання
Скористаємось рівнянням Менделєєва – Клапейрона (2.3) записавши його для початкового і кінцевого станів газу у балоні.
![]() (1)
(1)
![]() (2)
(2)
де
![]() ,
,![]() ,
,![]() – тиск, маса, термодинамічна температура
у початковому стані;
– тиск, маса, термодинамічна температура
у початковому стані;![]() ,
,![]() ,
,![]() – відповідні величини у кінцевому
стані; V – об’єм балону;
– молярна маса гелію; R – газова
постійна.
– відповідні величини у кінцевому
стані; V – об’єм балону;
– молярна маса гелію; R – газова
постійна.
З
(1) виразимо
![]() ,
з (2) виразимо
,
з (2) виразимо![]() .
.
![]()
![]()
Тоді
![]()
Перевіримо одиницю вимірювання
![]()
Знайдемо числове значення з урахуванням того, що
![]()
R = 8,31 Дж / (моль K),
![]()
![]()
M
=
![]() .
.
![]()
Відповідь
![]() = 2,77г.
= 2,77г.
Приклад
4.
У посудині об’ємом V =25л міститься
![]() =100г
гелію і
=100г
гелію і![]() =140г
азоту при температур t =27
=140г
азоту при температур t =27![]() .
Знайти тиск у посудині.
.
Знайти тиск у посудині.
Розв’язання
Скористаємося законом Дальтона (2.8), згідно з яким тиск у суміші газів дорівнює сумі парціальних тисків.
![]() ,
(1)
,
(1)
де
![]() і
і![]() (2)
(2)
![]() і
і
![]() -
малярні маси гелію і азоту відповідно.
-
малярні маси гелію і азоту відповідно.
Підставимо (2) в (1).
![]()
Перевіримо одиницю вимірювання.
![]()
Обчислення.
![]() Па
Па
Відповідь:Р=2,99 МПа.
Приклад
5.
Знайти густину ρ деякого газу,
якщо тиск Р у балоні 380 мм рт. ст. , а
середня квадратична швидкість руху
його молекул
![]() =800м/с.
=800м/с.
Розв’язання
Середня квадратична швидкість теплового руху молекул газу за формулою (2.16) дорівнює
![]()
![]() ,
(1)
,
(1)
де
![]() ;
Т – абсолютна температура; M– молярна
маса газу.
;
Т – абсолютна температура; M– молярна
маса газу.
Звідки ![]()
![]()
![]() .
(2)
.
(2)
Порівняємо з рівнянням Менделєєва-Клапейрона
![]() (3)
(3)
З
(2) виразимо
 і підставимо в (3):
і підставимо в (3):
 ,
або
,
або
 (4)
(4)
За визначенням густина ρ= m/V, тому з (4)
ρ .
(5)
.
(5)
Перевіримо одиницю вимірювання.
[ρ] .
.
Переведемо
тиск у одиницю вимірювання в системі
![]() :
:
P=380
мм рт. ст.
![]() 133
= 0,5
133
= 0,5![]() Па.
Па.
Підставимо у (5) числові дані
ρ![]() кг/
кг/![]() .
.
Відповідь:
ρ=0,23 кг/![]() .
.
Приклад
6. Визначити
середню довжину вільного пробігу
![]() молекул азоту при нормальних умовах, а
також середнє число зіткнень
молекул азоту при нормальних умовах, а
також середнє число зіткнень![]() молекули за одну секунду при даних
умовах.
молекули за одну секунду при даних
умовах.
Розв’язання
Середню довжину вільного пробігу молекул можна визначити за допомогою співвідношення (2.17):
де
![]() - ефективний діаметр молекули. Із таблиць
визначаємо, що для азоту
- ефективний діаметр молекули. Із таблиць
визначаємо, що для азоту![]() =
=![]() м;
м;
n – концентрація молекул при даних умовах.
Концентрація молекул можна зв’язати з параметрами стану газу за допомогою рівняння (2.13):
P
=
nkT,
звідки
![]() ,
(2)
,
(2)
де Р – тиск газу; Т – термодинамічна температура; k – постійна Больцмана.
Підставимо (2) у (1)
![]()
 .
(3)
.
(3)
Перевіримо одиницю вимірювання
![]() .
.
Для
нормальних умов Т=273 К і Р=![]() Па, k=
Па, k=![]() Дж/К.
Дж/К.
Обчислення.
![]() =
=![]() м.
м.
Середнє число зіткнень кожної молекули за 1 сек. можна визначити за формулою (2.18).
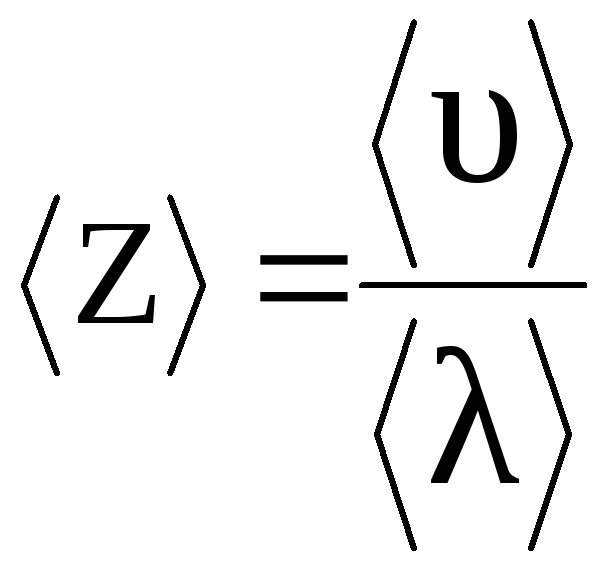 ,
(4)
,
(4)
де
![]() - середня арифметична швидкість теплового
руху молекул;
- середня арифметична швидкість теплового
руху молекул;![]() - середня довжина вільного пробігу
молекул, яку вже визначено за формулою
(3).
- середня довжина вільного пробігу
молекул, яку вже визначено за формулою
(3).
Середню арифметичну швидкість молекул знайдемо за допомогою формули (2.15).
 м/с.
м/с.
Підставимо
значення
![]() і
і![]() у (4)
у (4)
![]()
![]() .
.
Відповідь:
![]() м;
м;![]()
![]() .
.
Приклад
7. Знайти
енергію W обертального руху молекул,
які містяться у
![]() =2
кг водню при температурі t=27
=2
кг водню при температурі t=27![]() .
.
Розв’язання
Кількість молекул, які містяться у даній масі газу, згідно з (2.2)
![]() ,
(1)
,
(1)
де
![]() - кількість речовини, а
- кількість речовини, а![]() - постійна Авогадро.
- постійна Авогадро.
У
свою чергу
![]() ,
де M – малярна маса.
,
де M – малярна маса.
Тоді ![]() .
(2)
.
(2)
Так
як молекула водню
![]() складається з двох атомів і має між ними
жорсткий зв'язок, кількість ступенів
свободи для такої молекули i=5 з них 2
припадає на обертальний рух:
i=2.
Середня кінетична енергія однієї
молекули (2.12)
складається з двох атомів і має між ними
жорсткий зв'язок, кількість ступенів
свободи для такої молекули i=5 з них 2
припадає на обертальний рух:
i=2.
Середня кінетична енергія однієї
молекули (2.12)
![]() ,
(3)
,
(3)
де k – постійна Больцмана; Т – термодинамічна температура.
Тоді загальна енергія обертального руху всіх молекул
![]() ,
або
,
або
![]() .
.
Так
як
![]() ,
де k – газова постійна,
,
де k – газова постійна,
![]() .
(4)
.
(4)
Перевіримо одиницю вимірювання
![]() .
.
Підставимо
числові дані, зважаючи на те, що i=2;
М=![]() кг/моль;
Т=27
кг/моль;
Т=27![]() +273=300
К; R=8,31Дж/
+273=300
К; R=8,31Дж/![]() .
.
![]() Дж.
Дж.
Відповідь:
W=
![]() Дж.
Дж.
Приклад
8. Вуглекислий
газ масою m=66г, який має температуру t=![]() ,
ізотермічно розширюється так, що його
об’єм збільшується вдвічі. Яку роботу
виконує при цьому газ?
,
ізотермічно розширюється так, що його
об’єм збільшується вдвічі. Яку роботу
виконує при цьому газ?
Розв’язання
Роботу, яку виконує газ, можна знайти, скориставшись формулою (2.24):
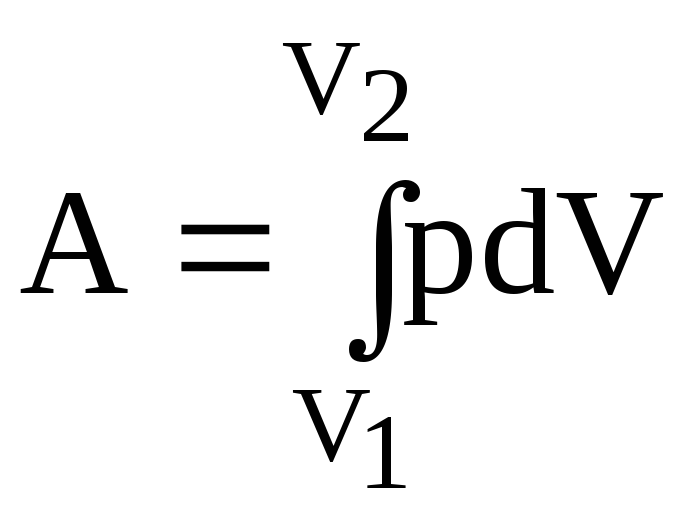 .
(1)
.
(1)
Так як під час ізотермічного процесу тиск Р теж змінюється, виразимо тиск через об’єм газу з рівняння Менделєєва – Клапейрона (2.3):
![]() ,
звідки
,
звідки
 .
(2)
.
(2)
Підставимо (2) у (1) і виконаємо інтегрування:
 .
(3)
.
(3)
Зважаючи
на те , що
![]() =m/M,
маємо
=m/M,
маємо
![]() .
.
Перевіримо одиницю вимірювання
![]() .
.
З
урахуванням того, що за умовою задачі
![]() і крім того
і крім того
m=66г=![]() кг;
кг;
Т=7+273=280К;
![]() кг/моль.
кг/моль.
одержимо
![]() Дж=2,41
кДж.
Дж=2,41
кДж.
Відповідь: А=2,41 кДж.
Приклад
9.
При ізобаричному нагріванні m=6г водню
з початковою температурою t=![]() ,
його об’єм зріс у два рази (
,
його об’єм зріс у два рази (![]() ).
Знайти: 1) роботу А газу; 2) зміну внутрішньої
енергії
).
Знайти: 1) роботу А газу; 2) зміну внутрішньої
енергії![]() газу; 3) кількість теплоти Q, яку надано
газу.
газу; 3) кількість теплоти Q, яку надано
газу.
Розв’язання
Робота газу при ізобаричному нагріванні (2.25):
![]() .
.
Скористаємося рівнянням Менделєєва – Клапейрона, записавши його двічі: для початкового і кінцевого станів.
![]() (1)
(1)
![]() (2)
(2)
З (2) віднімаємо (1)
![]() ,
або
,
або
![]() .
(3)
.
(3)
Різницю температур можна знайти з (2.26):
При
Р=const
![]() ;
за умовою задачі
;
за умовою задачі![]() ,
тому
,
тому![]() .
Тобто
.
Тобто
![]() К.
К.
Тоді
![]() К.
К.
Робота
газу
![]() Дж =7,48 кДж.
Дж =7,48 кДж.
Внутрішня енергія газу визначається за формулою (2.23).
 ,
,
Тоді
зміна внутрішньої енергії  ,
(4)
,
(4)
де
i – кількість ступені свободи; для водню
![]() (двохатомна молекула) і=5.
(двохатомна молекула) і=5.
Обчислення:
![]() Дж
= 18,68 кДж.
Дж
= 18,68 кДж.
Згідно з першим началом термодинаміки (2.22)
![]()
Тому
![]() кДж.
кДж.
Відповідь:
А=7,48 кДж;
![]() =18,68
кДж; Q=26,16 кДж.
=18,68
кДж; Q=26,16 кДж.
Приклад
10.
Ідеальна теплова машина працює за
циклом Карно. Температура нагрівача
![]() =400
К, охолоджувача
=400
К, охолоджувача![]()
![]() =300
К. За кожен цикл машина отримує від
нагрівача кількість теплоти
=300
К. За кожен цикл машина отримує від
нагрівача кількість теплоти![]() =2,1
кДж. Визначити коефіцієнт корисної дії
=2,1
кДж. Визначити коефіцієнт корисної дії![]() машини і корисну роботу А, яку виконує
машина за один цикл.
машини і корисну роботу А, яку виконує
машина за один цикл.
Розв’язання
Коефіцієнт корисної дії можна визначити або за формулою (2.29)
![]() , (1)
, (1)
або (для циклу Карно) за формулою (2.30)
![]() (2)
(2)
Спочатку за формулою (2) знайдемо коефіцієнт корисної дії
![]() .
.
Потім за формулою (1) знайдемо А.
![]() =525
Дж.
=525
Дж.
Відповідь:
![]() =25%;
А=525 Дж.
=25%;
А=525 Дж.
Приклад
11.
m=10г водню ізобарично нагрівають від
![]() до
до![]() .
Знайти зміну ентропії газу
.
Знайти зміну ентропії газу![]() у цьому процесі.
у цьому процесі.
Розв’язання
Згідно з (2.31) зміна ентропії визначається за формулою
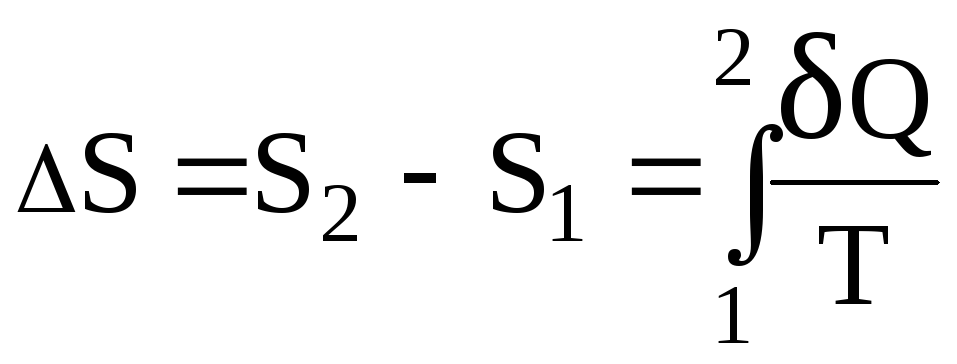 , (1)
, (1)
де
![]() і
і![]() - значення ентропії відповідно у кінцевому
і у початковому станах;
- значення ентропії відповідно у кінцевому
і у початковому станах;![]() - кількість теплоти, яку отримує газ у
елементарному процесі; Т – термодинамічна
температура, при якій відбувалась
теплопередача.
- кількість теплоти, яку отримує газ у
елементарному процесі; Т – термодинамічна
температура, при якій відбувалась
теплопередача.
При ізобаричному процесі
![]() , (2)
, (2)
де
![]() - молярна теплоємність водню при
ізобаричному нагріванні;
- молярна теплоємність водню при
ізобаричному нагріванні;![]() - кількість речовини; dT – збільшення
температури.
- кількість речовини; dT – збільшення
температури.
У свою чергу
![]() , (3)
, (3)
де
i – ступені свободи молекул (для водню
![]() i=5); R – газова стала. R=8,31
i=5); R – газова стала. R=8,31![]() .
.
 , (4)
, (4)
де
m – маса газу; M– молярна маса газу. Для
водню M=![]() кг/моль.
кг/моль.
Підставимо (2), (3), (4) у (1) і виконаємо інтегрування:
 .
.
Виразимо
температури
![]() і
і![]() у кельвінах (К):
у кельвінах (К):
![]() К;
К;
![]() 327+273=600
К.
327+273=600
К.
Обчислення.
![]() 100
Дж/К.
100
Дж/К.
Відповідь:
![]() =100
Дж/К.
=100
Дж/К.
Приклад
12.
Коефіцієнт внутрішнього тертя азоту
при нормальних умовах дорівнює
![]() =1,78
=1,78![]()
![]() .
Знайти коефіцієнт дифузії азоту D при
цих умовах.
.
Знайти коефіцієнт дифузії азоту D при
цих умовах.
Розв’язання
Скористаємося
формулами для коефіцієнтів D і
![]() (2.35):
(2.35):
![]() (1)
(1)
 (2)
(2)
де
![]() - середня арифметична теплового руху
молекул;
- середня арифметична теплового руху
молекул;![]() - середня довжина вільного пробігу
молекул;
- середня довжина вільного пробігу
молекул;![]() - густина газу.
- густина газу.
З порівняння (1) і (2) випливає, що
![]() =D
=D![]() . (3)
. (3)
Таким чином, для знаходження коефіцієнту дифузії азоту треба знайти його густину при нормальних умовах. З цією метою скористаємося рівнянням Менделєєва – Клапейрона (2.3):
![]() (4)
(4)
За
визначенням густина речовини
![]() =m/V,
тому виразимо звідси m і підставимо у
(4):
=m/V,
тому виразимо звідси m і підставимо у
(4):
![]() ,
,
звідки
![]() . (5)
. (5)
Тоді рівняння (3) з урахуванням співвідношення (5) має вигляд:
![]() ,
звідки
,
звідки
 .
.
Перевіримо одиницю вимірювання.
 Обчислення
проводимо з урахуванням того що при
нормальних умовах Р=760 мм рт. ст. =
Обчислення
проводимо з урахуванням того що при
нормальних умовах Р=760 мм рт. ст. =
![]() Па; Т=
Па; Т=![]() +273=273
К;
+273=273
К;
R=8,31
Дж/![]() ;
M=28
;
M=28![]() кг/моль.
кг/моль.
![]()
![]()
Відповідь:
В=1,44![]()
![]() .
.
Приклад
13.
Яка частина молекул азоту при температурі
t=![]() має швидкості від
має швидкості від![]() =300м/с
до
=300м/с
до![]() =310м/с?
=310м/с?
Розв’язок
Розподіл молекул по швидкостям має вигляд (2.36):
 , (1)
, (1)
де
![]() –
відносна швидкість. Вона дорівнює
–
відносна швидкість. Вона дорівнює

де
![]() - швидкість молекули;
- швидкість молекули;![]() - найбільш імовірна швидкість молекул.
За формулою (2.16)
- найбільш імовірна швидкість молекул.
За формулою (2.16)
![]()
У нашому випадку
![]() м/с.
м/с.
Тоді,
![]() ;
;![]() ;
;![]() ;
;
і формула (1) дає:
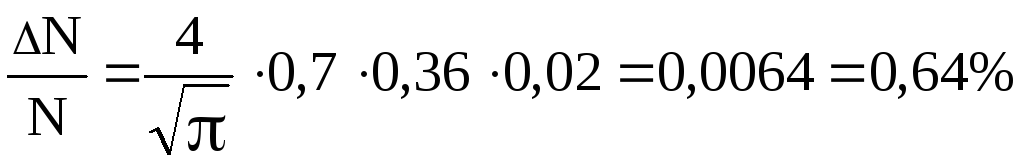
Відповідь:
![]() =0,64%.
=0,64%.
Приклад
14.
На якій висоті h атмосферний тиск Р
складає 50% від тиску на рівні моря?
Температуру вважати постійною і рівною
t=![]() ,
молярну масу для повітря вважати рівною
M=0,029 кг/моль.
,
молярну масу для повітря вважати рівною
M=0,029 кг/моль.
Розв’язання
Залежність атмосферного тиску від висоти над рівнем моря представлена барометричною формулою (2.37):
![]() , (1)
, (1)
де
Р – тиск на висоті h;
![]() -
тиск на рівні моря; M– молярна маса
повітря; g=9,8
-
тиск на рівні моря; M– молярна маса
повітря; g=9,8![]() - прискорення сили тяжіння; R=8,31 Дж/
- прискорення сили тяжіння; R=8,31 Дж/![]() - газова постійна; Т – теплодинамічна
температура.
- газова постійна; Т – теплодинамічна
температура.
Поділимо обидві частини рівняння (1) на Р:
 ,
звідки
,
звідки
 .
.
За
умовою задачі
![]() =2,
тому
=2,
тому![]() .
(2)
.
(2)
Логарифмуємо вираз (2): звідки
![]() .
(3)
.
(3)
Перевіримо одиницю вимірювання.
![]() .
.
Підставимо у (3) числові дані:
![]() м
=5,53 км.
м
=5,53 км.
Відповідь: h=5,53 км.
Приклад 15. Дві краплині ртуті радіусом r=1 мм кожна, зливаються в одну. Скільки теплоти Q при цьому виділяється?
Розв’язання
Кількість
теплоти Q дорівнює енергії
![]() ,
яка звільнюється тому, що зменшилося
площа поверхні. Цю енергію можна знайти
з формули (2.41):
,
яка звільнюється тому, що зменшилося
площа поверхні. Цю енергію можна знайти
з формули (2.41):
![]() , (1)
, (1)
де
![]() - коефіцієнт поверхневого натягу ртуті;
- коефіцієнт поверхневого натягу ртуті;![]() - площа, на яку зменшилась поверхня
однієї краплі порівняно з площею поверхні
двох попередніх.
- площа, на яку зменшилась поверхня
однієї краплі порівняно з площею поверхні
двох попередніх.
![]() , (2)
, (2)
де r – радіус маленької краплі; R – радіус великої краплі.
Радіус великої краплі можна знайти з тих міркувань, що об’єм великої краплі повинен дорівнювати двом об’ємам малої краплі.
![]() ;
звідки
;
звідки
![]() .
.
Підставимо у (2):
![]() .
.
Тоді
![]() .
.
Перевіримо одиницю вимірювання:
![]() .
.
Коефіцієнт поверхневого натягу для ртуті знаходимо з таблиць.
![]() =0,5
Н/м.
=0,5
Н/м.
Обчислення.
![]() Дж
= 2,57 мкДж.
Дж
= 2,57 мкДж.
Відповідь: Q=2,57 мкДж.
