
14.Многоядерные арены
.pdf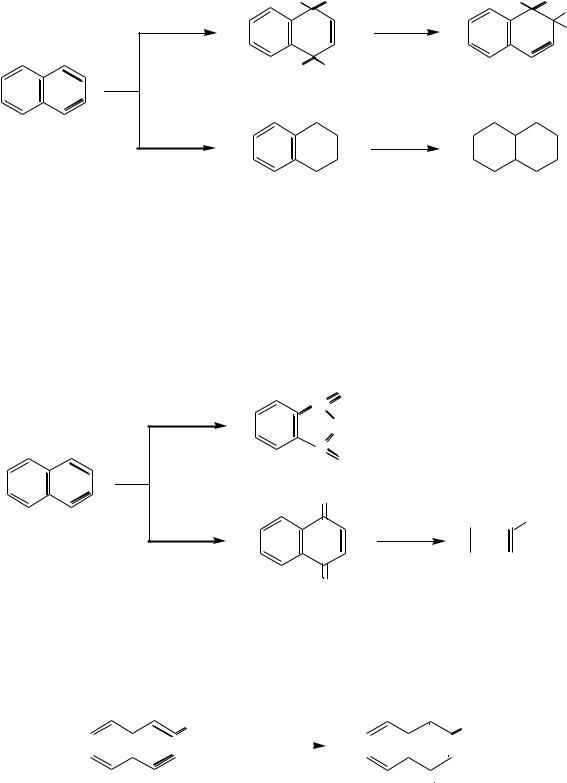
Гидрирование. Водород, образующийся при взаимодействии натрия с амиловым спиртом, реагирует с нафталином в момент выделения, давая 1,4- дигидронафталин, который легко изомеризуется в 1,2-дигидронафталин. Гидрирование нафталина водородом на никелевом катализаторе при 150 ˚С приводит к образованию 1,2,3,4-тетрагидронафталина (тетралина), при 200 ˚С – к образованию декагидронафталина (декалина):
|
H |
H |
изомери- |
H |
H H |
|
H2 |
|
зация |
|
H |
|
(Na, амил.сп.) |
|
|
|
|
|
|
|
|
|
|
|
H |
H |
|
|
|
|
1,4-дигидронафталин |
|
1,2-дигидронафталин |
||
нафталин |
2H2 |
|
3H2 |
|
|
|
|
|
|
||
|
Ni, 150 оC |
|
Ni, 200 оC |
|
|
|
1,2,3,4-тетрагидро- |
|
декагидронафталин |
||
|
нафталин (тетралин) |
|
(декалин) |
|
|
Тетралин и декалин широко применяются в качестве растворителей и компонентов моторного топлива.
Реакции окисления
Нафталин окисляется гораздо легче, чем бензол, и в зависимости от условий проведения окисления может превращаться во фталевый ангидрид, 1,4- нафтохинон или при более глубоком окислении во фталевую кислоту:
|
O2 |
С О |
|
О |
|
|
V2O5 |
|
|
С О |
|
|
|
|
|
|
фталевый ангидрид |
|
|
O |
нафталин |
CrO3 |
КМnO4 |
|
||
|
CH3COOH |
H2O |
O

 COOH
COOH

 COOH
COOH
1,4-нафтохинон |
фталевая кислота |
При окислении гомологов нафталина в первую очередь окисляется нафталиновое ядро, боковая цепь, как правило, не затрагивается (в отличие от гомологов бензола, где в первую очередь окисляется боковая цепь):
|
|
|
|
|
|
|
|
|
O |
||||
|
|
|
|
CH3 |
CrO |
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3COOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
2-метилнафталин |
|
|
|
|
O |
||||||||
(β-метилнафталин) |
|
2-метил-1,4-нафтохинон |
|||||||||||
312
НАПРАВЛЯЮЩЕЕ ДЕЙСТВИЕ ЗАМЕСТИТЕЛЕЙ
ВНАФТАЛИНОВОМ ЯДРЕ НА ПРОТЕКАНИЕ РЕАКЦИЙ ЗАМЕЩЕНИЯ
ВПРОИЗВОДНЫХ НАФТАЛИНА
Если в нафталиновом ядре содержится заместитель, то под его влиянием происходит перераспределение -электронной плотности цикла и новая группа вступает в строго определенные положения по отношению к имеющемуся заместителю. Направление электрофильного замещения в монозамещѐнных нафталина определяется, в основном, следующими факторами: электронной природой уже имеющегося в ядре заместителя (I род, II род); положением (α-,
β-) этого заместителя; повышенной реакционной способностью свободных α-
положений в нафталиновом ядре. В большинстве случаев в первую очередь атаке электрофильных реагентов подвергаются свободные α-положения (1, 4, 5, 8) монозамещѐнных нафталина.
І. Электронодонорные заместители (заместители І рода), нагнетая электронную плотность на нафталиновое ядро, активируют его к реакциям электрофильного замещения, причѐм в большей степени активируют то кольцо, с которым связан заместитель. Поэтому новый заместитель вступает, как правило, в это же кольцо, преимущественно в α-положение (как более реакционноспособное).
Если в ядре нафталина есть заместитель І рода (Д) в α-положении, то он направляет входящие электрофилы в положение 4:
8 |
Д |
Например: |
8 |
CH3 |
|
8 |
CH3 |
1 |
1 |
|
1 |
||||
7 |
2 |
|
7 |
2 |
HNO3 |
7 |
2 |
6 |
3 |
|
6 |
3 |
- H2O |
6 |
3 |
5 |
4 |
|
5 |
4 |
|
5 |
4 |
|
|
|
|
|
|
|
NO2 |
|
|
|
-метилнафталин |
|
1-метил-4-нитронафталин |
||
Следующие входящие электрофильные заместители направляются в положение 2:
8 |
|
1 |
CH3 |
|
8 |
|
CH3 |
|
|||||
|
|
|
|
|
1 |
|
|
NO2 |
|||||
7 |
|
|
|
|
2 |
HNO3 |
7 |
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
||||||
6 |
|
|
|
|
3 |
- H2O |
6 |
|
|
|
|
3 |
|
|
|
4 |
|
|
|
4 |
|
|
|||||
5 |
|
|
|
|
5 |
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
||||||||
|
|
|
NO2 |
|
|
|
|
NO2 |
|
||||
1-метил-4-нитронафталин |
|
1-метил-2,4-динитронафталин |
|||||||||||
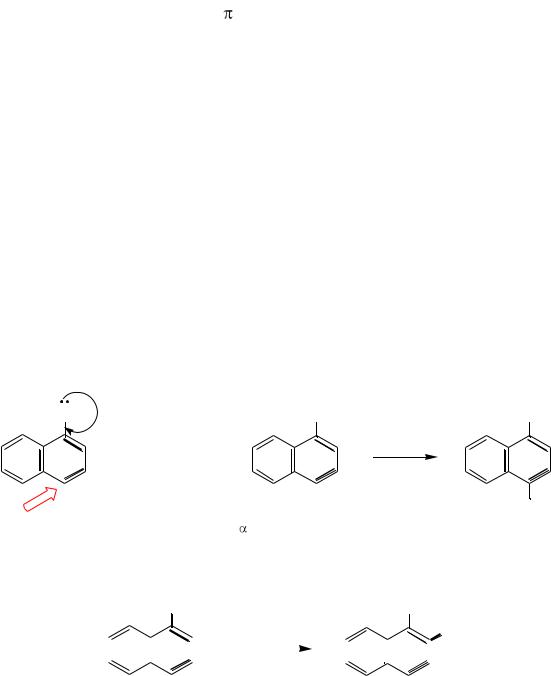
Если в ядре нафталина есть заместитель І рода (Д) в β-положении, то он направляет входящие электрофилы в положение 1:
313
8 |
1 |
|
Например: |
8 |
1 |
|
|
|
8 |
NO2 |
|
Д |
|
ОH |
|
1 |
ОH |
||||||
7 |
|
|
7 |
|
2 |
HNO3 |
7 |
2 |
|||
2 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|||
6 |
3 |
|
|
6 |
|
3 |
|
- H2O |
6 |
3 |
|
5 |
4 |
|
|
5 |
4 |
|
|
|
5 |
4 |
|
|
|
|
|
-нафтол |
|
|
|
|
1-нитро-2-оксинафталин |
||
Следующие входящие электрофильные заместители направляются в положение 6:
8 |
|
NO2 |
|
|
|
8 |
|
NO2 |
|
||||
|
1 |
|
ОH |
|
|
|
1 |
|
ОH |
||||
7 |
|
|
|
2 |
HNO3 |
|
7 |
|
|
|
2 |
||
|
|
|
|
|
|
|
|
|
|||||
6 |
|
|
|
3 |
|
- H2O |
О2N |
6 |
|
|
|
3 |
|
|
|
4 |
|
|
|
|
4 |
|
|||||
5 |
|
|
|
|
5 |
|
|
|
|||||
|
|
|
|
|
|
|
|
||||||
1-нитро-2-оксинафталин |
|
1,6-динитро-2-оксинафталин |
|||||||||||
ІІ. Электроноакцепторные заместители (заместители ІІ рода),
стягивая электронную плотность с нафталинового ядра, дезактивируют его к реакциям электрофильного замещения, причѐм в большей степени дезактивируют то кольцо, с которым связан заместитель. Новый заместитель вступает, как правило, в α-положения соседнего кольца.
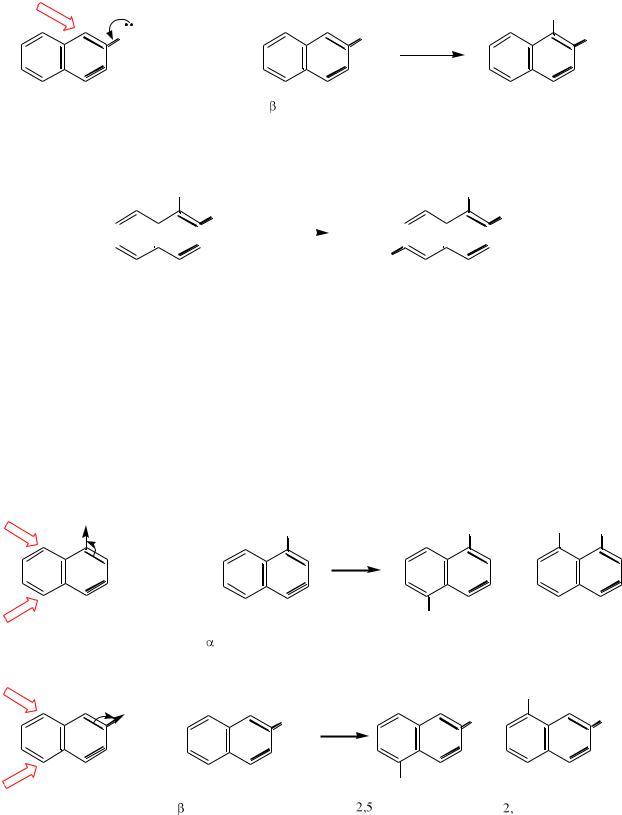
Заместитель ІІ рода (А), находящийся в α-положении или в β-
положении нафталинового ядра, направляет входящие электрофилы в
положения 5, 8:
|
А |
Например: |
NO2 |
NO2 |
NO2 |
NO2 |
8 |
|
|||||
1 |
|
1 |
1 |
8 |
1 |
|
7 |
|
2 |
|
2HNO3 |
+ |
|
6 |
|
2 |
- 2H2O |
|
||
|
3 |
|
|
|
||
5 |
4 |
|
|
5 |
|
|
|
|
|
|
NO2 |
|
|
|
|
|
-нитронафталин |
1,5-динитронафталин |
1,8-динитронафталин |
|
8 |
1 |
|
Например: |
|
|
|
NO2 |
|
|
А |
|
NO2 |
|
NO2 |
8 |
NO2 |
|||
7 |
|
|
2HNO3 |
|
|||||
|
2 |
2 |
2 |
2 |
+ |
|
2 |
||
6 |
|
- 2H2O |
|
||||||
|
3 |
|
|
|
|
|
|
||
5 |
4 |
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
NO2 |
|
|
|
|
|
|
|
-нитронафталин |
|
-динитронафталин |
|
8-динитронафталин |
|
Следующие входящие электрофильные заместители направляются в свободные положения 5 или 8.
Исключение из приведенніх правил ориентации в нафталиновом ядре составляют реакции сульфирования. В них строение продуктов реакции зависит, в основном, от температуры и продолжительности нагрева. Продукты замещения сульфогруппой водорода в α-положениях нафталинового ядра
314
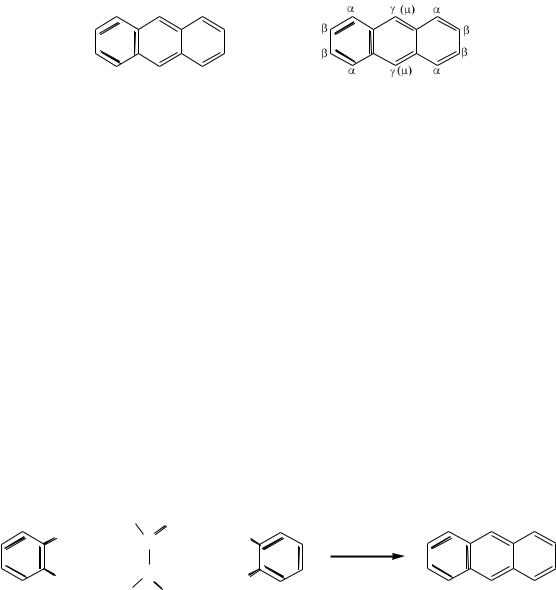
можно получить лишь на холоду. При продолжительном нагреве до высоких температур сульфогруппа направляется преимущественно в β-положения.
14.2.2. АНТРАЦЕН
Молекула антрацена состоит из трех линейно конденсированных бензольных циклов. Подобно нафталину, в молекуле антрацена нумеруются только те атомы углерода, которые принадлежат лишь одному кольцу, т.е. лишь атомы углерода, несущие водород. Положения углеродных атомов в молекуле антрацена имеют специальные названия: 1,4,5,8 – α-положения; 2,3,6,7 – β- положения; 9,10 – γ-положения или μ-положения (от мезо-средний):
8 |
9 |
1 |
7 |
|
2 |
6 |
|
3 |
5 |
10 |
4 |
антрацен
Антрацен имеет структуру, подчиняющуюся правилу Хюккеля: все три бензольных кольца лежат в одной плоскости и содержат 4п + 2 = 4×3+ 2 = 14 π- электронов. Однако электронная плотность в антрацене распределена ещѐ более неравномерно, чем в нафталине, поэтому антрацен – менее ароматичное соединение, чем нафталин, и еще менее ароматичное, чем бензол. Энергия сопряжения антрацена составляет 350 кДж/моль, что значительно меньше утроенной энергии сопряжения бензола (3×150 = 450 кДж/моль).
СПОСОБЫ ПОЛУЧЕНИЯ АНТРАЦЕНА
Из каменноугольной смолы. В промышленности антрацен получают из фракции каменноугольной смолы, кипящей при 300-350 ˚С. Она называется антраценовым или зелѐным маслом и содержит до 1% антрацена.
Остальные приведенные ниже методы получения антрацена являются синтетическими.
Алкилирование бензола 1,1,2,2-тетрабромэтаном по Фриделю-
Крафтсу. Две молекулы бензола алкилируются 1,1,2,2-тетрабромэтаном с разрывом в нем углерод-углеродной связи:
Br |
Br |
Н |
Н |
CH |
|
+ |
|
+ |
Н |
CH |
Н |
Br |
Br |
|
AlBr3
- 4HBr
бензол |
1,1,2,2-тетрабромэтан |
бензол |
антрацен |
С использованием реакции Фиттига. Производные бензола,
содержащие в орто-положениях галоген и галогенметильную группу, под
315
действием металлического натрия превращаются в 9,10-дигидроантрацен (реакция Фиттига). Окислением последнего получают антрацен:
CH2Br |
Br |
|
|
+ 4Na |
+ |
- 4NaBr |
|
Br |
BrН2С |
||
|
|||
1-бром-2-бромметилбензол |
1-бром-2-бромметилбензол |
|
|
CH2 |
О |
|
|
|
|
||
CH2 |
- Н2О |
|
|
|
|
||
9,10-дигидроантрацен |
антрацен |
||
Из фталевого ангидрида и бензола с последующим образованием и восстановлением 9,10-антрахинона:
C O |
|
O |
|
|
C |
||
O |
+ |
AlCl3 |
|
O |
|||
|
|
||
C O |
|
C OH |
|
фталевый ангидрид |
бензол |
о-бензоилбензойная кислота |
|
|
O |
|
|
Н2SО4 |
C |
6 Н |
|
|
|||
- Н2О |
C |
- 2Н2О |
|
|
|
||
|
O |
|
|
|
9,10-антрахинон |
антрацен |
ХИМИЧЕСКИЕ СВОЙСТВА АНТРАЦЕНА
Антрацен – менее ароматичное (более непредельное) соединение, чем нафталин (и тем более чем бензол). Поэтому антрацен в большей степени склонен к реакциям присоединения и окисления. Реакции протекают, как правило, по наиболее активным в молекуле антрацена мезо-положениям (9 и 10). Активность этих положений связана с тем, что они находятся под влиянием двух бензольных ядер.
Окисление антрацена азотной кислотой приводит к антрахинону:
|
|
O |
|
3[O] |
C |
|
+ H2O |
|
|
(HNO3) |
|
|
C |
|
|
|
|
|
|
O |
антрацен |
|
9,10-антрахинон |
316
Гидрирование антрацена водородом в момент выделения приводит к образованию 9,10-дигидроантрацена:
H2
(Na + R-OH)
H H

 C
C

 C
C

H H
антрацен |
9,10-дигидроантрацен |
Галогенирование антрацена протекает через стадию присоединения галогена к мезо-углеродным атомам с образованием 9,10-дигалогендигидро- антрацена. Далее при нагревании отщепляется галогеноводород с образованием 9-галогенантрацена:
H Br

 C
C

+ Br2

 C
C

H Br
Br
t
- HBr
антрацен |
9,10-дибром-9,10-дигидроантрацен |
9-бромантрацен |
Нитрование антрацена азотной кислотой в смеси с ледяной уксусной протекает по положению 9 с образованием 9-нитроантрацена:
|
|
|
|
NO2 |
|
|
|
HNO3 |
+ H2O |
|
|
|
CH3COOH |
|
|
|
|
|
|
|
|
|
20оC |
|
|
антрацен |
|
9-нитроантрацен |
|
|
Сульфирование антрацена протекает по положениям 1, 2: |
|||
|
|
|
SO3H |
|
|
2Н SО |
|
SO3H |
|
|
2 |
4 |
|
+ |
2 |
- 2Н2О |
|
|
|
|
|
|
|
|
|
антрацен |
|
1-антраценсульфокислота |
2-антраценсульфокислота |
14.2.3.ФЕНАНТРЕН
Фенантрен является структурным изомером антрацена. Его молекула состоит из трех ангулярно (под углом) конденсированных бензольных циклов. Структурную формулу фенантрена представляют двояко:
317
|
|
6 |
|
|
|
|
|
5 |
7 |
|
9 |
10 |
|
|
|
|
|
|
||
4 |
|
8 |
|
|
|
1 |
|
|
8 |
|
|
||
3 |
|
|
|
|
|
|
|
или |
|
|
|
|
|
2 |
|
7 |
|
|
2 |
|
|
9 |
|
|
|
|
|
1 |
10 |
|
6 |
5 |
4 |
3 |
Получают фенантрен, главным образом, из антраценовой фракции каменноугольной смолы. По химическим свойствам фенантрен близок антрацену, но обладает большей ароматичностью. Он легко вступает в реакции электрофильного замещения, а также восстановления и окисления. Наиболее активными являются положения 9 и 10. Химическая связь между девятым и десятым атомами углерода в фенантрене напоминает двойную, поэтому при электрофильном замещении в отдельных случаях образуются промежуточные продукты присоединения.
Галогенирование фенантрена:
|
H |
C C |
H |
|
Br |
|
Br |
Br |
|
|
|
|
Br2 |
|
|
t |
|
|
|
|
- HBr |
|
|
фенантрен |
9,10-дибром-9,10-дигидрофенантрен |
|
9-бромфенантрен |
||
Гидрирование фенантрена: |
|
|
|
|
|
|
|
|
H |
C C |
H |
|
|
|
Н |
Н |
|
|
|
2H |
|
|
|
|
фенантрен |
|
9,10-дигидрофенантрен |
||
Окисление фенантрена:
O O C C
3 [O]
- Н2О
Н2О
[O]
HООС COOH
фенантрен |
9,10-фенантренхинон |
дифеновая кислота |
При нитровании фенантрена азотной кислотой в среде уксусной кислоты образуется 9-нитрофенантрен. Легко протекает сульфирование фенантрена с образованием 2-, 3- или 9-моносульфокислот.
Частично или полностью гидрированные производные фенантрена входят в состав стероидов, алкалоидов и многих других природных соединений, обладающих физиологической активностью. Так, в основе стероидов лежит
318
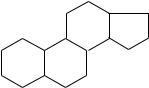
скелет стерана, который представляет собой конденсированную систему, состоящую из полностью гидрированного фенантренового ядра (пергидрофенантрена) и циклопентана:
стеран (циклопентанпергидрофенантрен)
319
