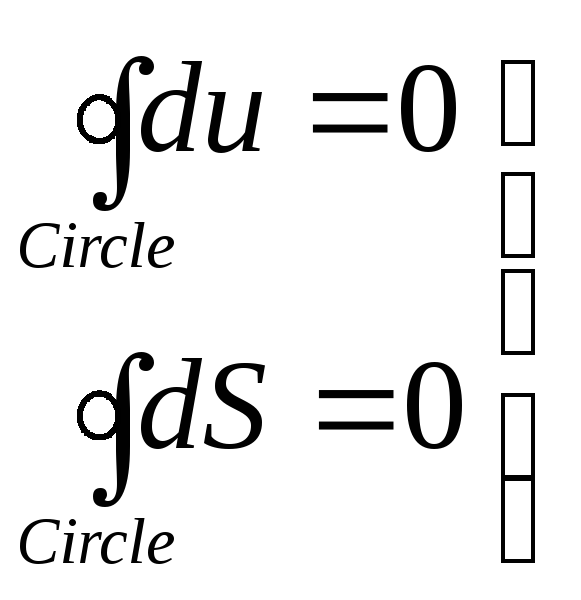- •Внутрішня енергія та ентропія великої системи як функції стану
- •Другий закон термодинаміки та його статистичний зміст
- •„Будь-які спонтанні процеси в замкненій термодинамічній системі можуть відбуватися лише за умови, що ентропія системи при цьому не зменшується” :
- •Теплові двигуни та холодильні машини. Ккд теплових двигунів. Цикл Карно та його ккд (формула Карно)
- •Третій закон термодинаміки (теплова теорема Нернста)
- •“При наближенні температури системи до абсолютного нуля, ентропія рівноважної системи наближається до свого мінімального значення, яке завжди можна вважати нульовим”.
|
Херсонський національний технічний університет Кафедра загальної та прикладної фізики |
ІІ ЗАКОН ТЕРМОДИНАМІКИ Лекція 2.4. |
|
|
|
|---|---|
|
|
|
|
|
|
|
|
|
|
|
-
Внутрішня енергія та ентропія великої системи як функції стану
Статистична
фізика не розглядає руху системи як
цілого, отже центр мас системи вважається
нерухомим. В системі можливий лише
внутрішній рух її частинок, проте без
переміщень центру мас. Внутрішня
енергія
![]() системи є просто середньою енергією
такого внутрішнього руху частинок та
їх взаємодії поміж собою. Отже, внутрішня
енергія великої системи є просто
макропараметром, який характеризує
систему в цілому. Внутрішня енергія
зберігається, якщо система ізольована
(її флуктуації в такому випадку є
нульовими), втім вона може й передаватися
іншим системам, якщо система є відкритою,
обмінюється енергією з іншими системами.
В цьому випадку внутрішня енергія має
ненульові флуктуації. Внутрішню енергію
вважають адитивною функцією стану
системи (При цьому нехтують енергією
взаємодії поміж підсистемами, вважаючи,
що така енергія пропорційна до кількості
частинок на кордонах взаємодіючих
підсистем, отже вона значно менша від
енергій підсистем, які пропорційні
кількості всіх мікрочастинок в
підсистемах
системи є просто середньою енергією
такого внутрішнього руху частинок та
їх взаємодії поміж собою. Отже, внутрішня
енергія великої системи є просто
макропараметром, який характеризує
систему в цілому. Внутрішня енергія
зберігається, якщо система ізольована
(її флуктуації в такому випадку є
нульовими), втім вона може й передаватися
іншим системам, якщо система є відкритою,
обмінюється енергією з іншими системами.
В цьому випадку внутрішня енергія має
ненульові флуктуації. Внутрішню енергію
вважають адитивною функцією стану
системи (При цьому нехтують енергією
взаємодії поміж підсистемами, вважаючи,
що така енергія пропорційна до кількості
частинок на кордонах взаємодіючих
підсистем, отже вона значно менша від
енергій підсистем, які пропорційні
кількості всіх мікрочастинок в
підсистемах
![]() ).
).
Адитивність означає, що внутрішня енергія системи є просто сумою внутрішніх енергій її підсистем. Зміна внутрішньої енергії системи під час переходу з одного стану до іншого не залежить від способу такого переходу, а залежить лише від початкового та кінцевого стану системи. Ця властивість вказує на те, що внутрішня енергія є функцією стану, а не функцією процесу.
Ентропія системи є також адитивною функцією стану великої системи. Ентропія пов’язана з статистичною вагою макростану системи формулою Больцмана:
|
|
(2.4.1) |
де
![]() Дж/К – так звана стала Больцмана.
Дж/К – так звана стала Больцмана.
Ентропія (2.4.1) є тим більшою, чим більшою є статистична вага стану в якому перебуває система. Отже, свого максимуму ентропія набуває в стані з найвищою ймовірністю. Такий стан вочевидь є найбільш невпорядкованим, хаотичним. Ентропія росте, якщо система переходить до більш ймовірного стану (більш хаотичного), і навпаки, зменшується, коли система впорядковується.
Принцип Ле-Шательє-Брауна стверджує, що будь-яка велика система, виведена з рівноважного стану, з часом сама собою, за рахунок внутрішніх процесів релаксації, повертається до стану рівноваги. Отже, ентропія системи сягає свого максимуму саме в її рівноважному стані.
Ймовірність
термодинамічного стану системи
характеризується ентропією системи
![]() .
Ентропія є функцією термодинамічного
стану системи і типовим адитивним
(екстенсивним) внутрішнім параметром
ТД-системи.
.
Ентропія є функцією термодинамічного
стану системи і типовим адитивним
(екстенсивним) внутрішнім параметром
ТД-системи.
Як
і внутрішня енергія ентропія системи
є функцією температури системи та
зовнішніх параметрів:
![]() .
Ентропія сягає свого максимуму в
рівноважному стані системи, як це
випливає з відомої нам статистичної
формули Больцмана для ентропії. Більше
того ентропія росте (
.
Ентропія сягає свого максимуму в
рівноважному стані системи, як це
випливає з відомої нам статистичної
формули Больцмана для ентропії. Більше
того ентропія росте (![]() )
якщо система переходить у більш ймовірний
стан, тобто наближається до рівноваги,
і навпаки (
)
якщо система переходить у більш ймовірний
стан, тобто наближається до рівноваги,
і навпаки (![]() ),
у зворотних процесах.
),
у зворотних процесах.
Поміж
зміною ентропії системи
![]() та кількістю отриманої теплоти існує
корисне співвідношення Клаузіуса:
та кількістю отриманої теплоти існує
корисне співвідношення Клаузіуса:
|
|
(2.4.2) |
де
права частина часто називається
„приведеною
теплотою”,
а через
![]() позначена температура системи. Враховуючи,
вираз для термодинамічної роботи системи
у вигляді (2.4.5),( відповідний до частого
у практиці випадку, коли із зовнішніх
параметрів змінюється лише об’єм
системи) можна записати, рівняння для
першого закону термодинаміки у наступному
вигляді:
позначена температура системи. Враховуючи,
вираз для термодинамічної роботи системи
у вигляді (2.4.5),( відповідний до частого
у практиці випадку, коли із зовнішніх
параметрів змінюється лише об’єм
системи) можна записати, рівняння для
першого закону термодинаміки у наступному
вигляді:
|
|
(2.4.3) |
Розглянемо два важливих частинних випадки виконання першого закону термодинаміки:
-
Перший випадок відповідає так званому адіабатичному процесу:
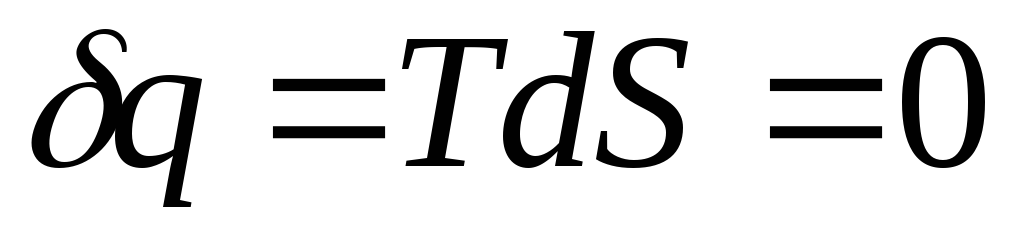 .
В таких процесах відсутній
теплообмін, система є теплоізольованою,
її ентропія не змінюється.
З першого закону маємо:
.
В таких процесах відсутній
теплообмін, система є теплоізольованою,
її ентропія не змінюється.
З першого закону маємо:
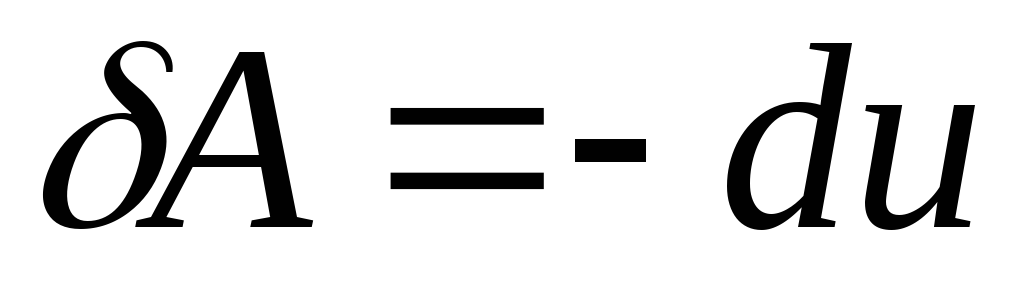 - робота в адіабатичному процесі
виконується за рахунок зменшення
внутрішньої енергії.
- робота в адіабатичному процесі
виконується за рахунок зменшення
внутрішньої енергії. -
Інший випадок відповідає незмінності всіх зовнішніх параметрів:
 .
Отже й
.
Отже й
 ,
робота в таких умовах системою не
виконується. З першого закону термодинаміки
випливає, що у такому разі:
,
робота в таких умовах системою не
виконується. З першого закону термодинаміки
випливає, що у такому разі:
 ,
при фіксованих
зовнішніх параметрах внутрішня енергія
та ентропія системи змінюються за
рахунок теплообміну
(нагрівання, або охолодження).
,
при фіксованих
зовнішніх параметрах внутрішня енергія
та ентропія системи змінюються за
рахунок теплообміну
(нагрівання, або охолодження).
Отже
адіабатичний процес (![]() )
можна розглядати також як ізоентропійний:
)
можна розглядати також як ізоентропійний:
![]() ,
іншими словами такий, в якому ентропія
системи не змінюється.
,
іншими словами такий, в якому ентропія
системи не змінюється.
Ц икловими,
або замкненими ТД-процесами
називають такі процеси, в яких кожний
стан системи можна вважати одночасно
початковим та кінцевим, оскільки
наприкінці циклового (колового,
замкненого) процесу система повертається
у початковий стан. Такі процеси (цикли)
в будь-якій системі координат повинні
зображуватися замкненими кривими
(рис.1). Умовимося цикли, які відбуваються
у напрямі годинникової стрілки вважати
прямими, а цикли протилежного напряму
(проти годинникової стрілки), навпаки,
оберненими циклами.
икловими,
або замкненими ТД-процесами
називають такі процеси, в яких кожний
стан системи можна вважати одночасно
початковим та кінцевим, оскільки
наприкінці циклового (колового,
замкненого) процесу система повертається
у початковий стан. Такі процеси (цикли)
в будь-якій системі координат повинні
зображуватися замкненими кривими
(рис.1). Умовимося цикли, які відбуваються
у напрямі годинникової стрілки вважати
прямими, а цикли протилежного напряму
(проти годинникової стрілки), навпаки,
оберненими циклами.
Зміна будь-якої функції стану системи (наприклад внутрішньої енергії, або ентропії) повинна бути нульовою:
|
|
(2.4.4) |
З першого закону термодинаміки в інтегральній формі маємо, що робота цикла внаслідок (2.4.4) дорівнюватиме балансу тепла отриманого та відданого у циклі:
|
|
(2.4.5) |
Якщо
баланс тепла за один цикл записати у
вигляді
![]() ,
де
,
де
![]() -
загальна кількість тепла отриманого
системою у циклі, а
-
загальна кількість тепла отриманого
системою у циклі, а
![]() - загальна кількість відданого за цикл
системою тепла, тоді роботу циклу можна
записати так:
- загальна кількість відданого за цикл
системою тепла, тоді роботу циклу можна
записати так:
|
|
(2.4.6) |
Ефективність перетворення тепла у роботу під час циклу оцінюють відношенням:
|
|
(2.4.7) |
який
отримав назву коефіцієнту
корисної дії циклу
(к.к.д циклу). Цей коефіцієнт не може
перевищувати одиниці:
![]() .
Отже, жоден
термодинамічний цикл не може виробляти
механічної роботи
.
Отже, жоден
термодинамічний цикл не може виробляти
механічної роботи
![]() більше, ніж на це витрачається тепла
більше, ніж на це витрачається тепла
![]() :
:
![]() .
Або інакше надлишок роботи можна було
б знов перетворювати у додаткове тепло,
з якого виробляти „дармову роботу”.
Тобто реалізувати „вічний двигун
першого роду”, що неможливо за першим
законом термодинаміки.
.
Або інакше надлишок роботи можна було
б знов перетворювати у додаткове тепло,
з якого виробляти „дармову роботу”.
Тобто реалізувати „вічний двигун
першого роду”, що неможливо за першим
законом термодинаміки.

 2.4.
ІІ ЗАКОН ТЕРМОДИНАМІКИ
2.4.
ІІ ЗАКОН ТЕРМОДИНАМІКИ