
- •Розділ ііі. Молекулярна фізика і термодинаміка Лекція 1. Молекулярно-кінетична теорія речовини
- •1. Атомно-молекулярна будова речовини.
- •Лекція 2. Елементи статистичної фізики.
- •1. Розподіл молекул ідеального газу за їхніми швидкостями.
- •2. Барометрична формула, розподіл Больцмана.
- •3. *Зіткнення молекул, середня довжина вільного пробігу молекул.
- •4. *Поведінка газів за умов низького тиску.
- •5. *Вакуумна техніка.
- •Лекція 3. Основи термодинаміки.
- •2. Внутрішня енергія системи як функція стану.
- •3. Перше начало термодинаміки.
- •4. Термодинамічні діаграми.
- •5. Ізопроцеси в газах.
- •6. Адіабатний процес.
- •Для адіабатного процесу,
- •7. Теплоємність газів.
- •Лекція 4. Друге начало термодинаміки
- •1. Термодинамічні цикли, робочі цикли теплових та холодильних машин.
- •2. Цикл Карно.
- •3. Оборотні та необоротні процеси.
- •4. Ентропія. Друге начало термодинаміки та його статистичне розуміння. *Теорема Нернста.
- •Лекція 5. Реальні гази
- •Лекція 6. Тверді тіла. Рідини
2. Цикл Карно.
Вивчаючи проблеми можливого підвищення ККД теплових машин Саді Карно довів теорему: із всіх періодично діючих теплових машин, що мають однакові температури нагрівачів i холодильників, найбільший коефіцієнт корисної дії (ККД) мають оборотні машини; при цьому ККД оборотних машин, що працюють при однакових температурах нагрівачів i холодильників, дорівнюють один одному i не залежать від природи робочого тіла.
Цикл Карно – цикл ідеальної теплової машини (немає втрат на теплопровідність, теплове випромінювання, тертя тощо) складається з двох ізотерм (1→2 і 3→4) і двох адіабат (2→3 і 4→1) (див. рис.):
1
 →2
– ізотермічний процес
→2
– ізотермічний процес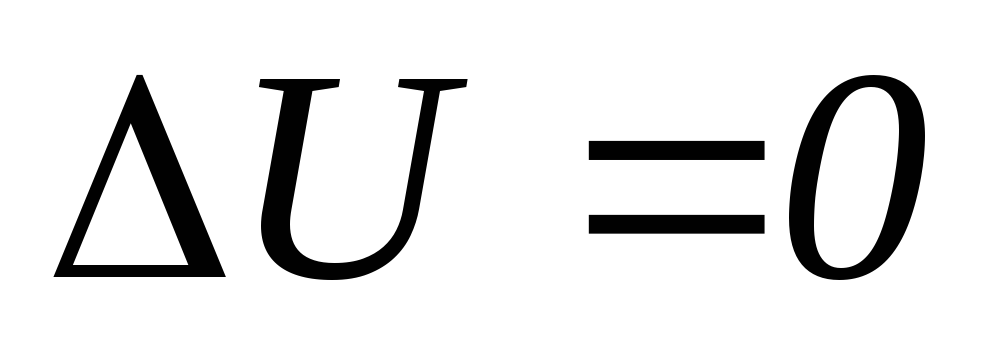 ,
робота розширення газу
,
робота розширення газу дорівнює кількості теплоти
дорівнює кількості теплоти , що отримав газ від нагрівника:
, що отримав газ від нагрівника:
![]() ;
;
2→3 – адіабатне розширення газу, робота виконується за рахунок зменшення внутрішньої енергії:
![]() ;
;
3→4 – ізотермічне стискання газу, виконується робота
 i газ віддає холодильнику кількість
теплоти
i газ віддає холодильнику кількість
теплоти :
:
![]() ;
;
4→1 – над газом виконується робота адіабатного стискання для підвищення його внутрішньої енергії до початкового значення:
![]() .
.
В результаті колового циклу виконується робота
![]()
![]() .
.
Термічний ККД циклу
![]() .
.
Підставляючи
рівняння адіабат
![]() ,
,![]() у формули кількості теплоти ізотермічних
процесів
у формули кількості теплоти ізотермічних
процесів
![]() і
і
![]() ,
отримують
,
отримують
ККД циклу Карно:
 ,
,
де
![]() – температура нагрівника,
– температура нагрівника,![]() – температура холодильника.
– температура холодильника.
Отже, ККД циклу Карно визначається лише температурами нагрівника i холодильника.
Для підвищення
ККД необхідно збільшити різницю
температур нагрівача і холодильника.
Наприклад, при
![]() і
і![]()
![]() .
Якщо ж температура нагрівника зросте
до
.
Якщо ж температура нагрівника зросте
до![]() ,
тобто різниця температур збільшиться
на
,
тобто різниця температур збільшиться
на![]() ,
то
,
то![]() .
.
3. Оборотні та необоротні процеси.
Оборотним термодинамічним процесом називають таку зміну стану системи, яка, будучи проведена у зворотному напрямку, повертає її в початковий стан так, щоб система пройшла через ті самі проміжні стани, що i у прямому процесі, але у зворотній послідовності, а стан тіл поза системою залишився незмінним.
Процеси, які не задовольняють цим вимогам оборотності, називають необоротними.
Оборотні процеси – це до деякої міри ідеалізація реальних процесів. Всі реальні процеси є необоротними.
4. Ентропія. Друге начало термодинаміки та його статистичне розуміння. *Теорема Нернста.
Відношення теплоти
ΔQ,
одержаної тілом в ізотермічному процесі,
до температури Т
тіла, що віддає тепло. Цю величину
називають зведеною
кількістю теплоти.
Зведена визначається кількістю теплоти,
що передається тілу на нескінченно
малій ділянці процесу
![]() .
.
Відношення
кількості переданої теплоти до температури
тепловіддавача або теплоприймача
![]() є функцією стану системи, яку називаютьзведеною
кількістю теплоти.
є функцією стану системи, яку називаютьзведеною
кількістю теплоти.
Найсуттєвіша відмінність теплового руху молекул від інших форм руху – його безладність, хаотичність. Тому для опису теплового руху вводять кількісну міру ступеня молекулярного безладу.
Під
час виконання циклу Карно зведені
кількості теплоти при процесах
ізотермічного розширення і стиску
однакові. Вираз
![]() є повним диференціалом деякої функції,
яка визначається лише станом системи
і не залежить від виду процесу, в ході
якого система прийшла в цей стан.
є повним диференціалом деякої функції,
яка визначається лише станом системи
і не залежить від виду процесу, в ході
якого система прийшла в цей стан.
Функцію
стану термодинамічної системи, диференціал
якої
![]() ,
називаютьентропією
S:
,
називаютьентропією
S:
![]() .
.
Поняття ентропії було вперше введено у 1865 році Рудольфом Клаузіусом. Рудольф Клаузіус дав величині S назву «ентропія», утворивши її від грецького слова τρoπή, «зміна» (зміна, перетворення).
Зміна ентропії при оборотному процесі
![]() .
.
Ентропія системи, що здійснює необоротній процес, зростає
![]() .
.
Ентропія замкненої системи може або зростати (для необоротних процесів), або залишатися величиною сталою (для оборотних процесів):
![]() –нерівність
Клаузіуса.
–нерівність
Клаузіуса.
Оскільки
![]() і
і![]() мають один і той же знак, тоза
характером зміни ентропії можна визначати
напрямок процесу теплообміну.
При нагріванні тіла
мають один і той же знак, тоза
характером зміни ентропії можна визначати
напрямок процесу теплообміну.
При нагріванні тіла
![]() і його ентропія зростає
і його ентропія зростає![]() ,
при охолодженні
,
при охолодженні![]() і ентропія спадає
і ентропія спадає![]() .
.
Термодинамічна
ймовірність стану тіла або системи
![]() визначається кількістю способів, якими
може бути реалізований даний конкретний
термодинамічний стан, тобто це кількість
можливих мікророзподілів частинок за
координатами і швидкостями (мікростанів),
якими може бути реалізований даний
макростан.
визначається кількістю способів, якими
може бути реалізований даний конкретний
термодинамічний стан, тобто це кількість
можливих мікророзподілів частинок за
координатами і швидкостями (мікростанів),
якими може бути реалізований даний
макростан.
Статистичне тлумачення ентропії: ентропія є мірою невпорядкованості системи – чим більше мікростанів, що реалізують даний мікростан, тим більша ентропія. Визначається логарифмом числа мікростанів, за допомогою яких може бути реалізований даний мікростан:
![]() –формула
Больцмана,
–формула
Больцмана,
де
![]() – стала Больцмана.
– стала Больцмана.
Принцип зростання ентропії: всі процеси у замкнутій системі ведуть до збільшення її ентропії.
У замкненій системі процеси відбуваються у напрямі від менш ймовірних станів до більш ймовірних, до тих пір, доки ймовірність стану не стане максимальною. В стані рівноваги – найбільш ймовірному стані системи – кількість мікростанів максимальна, при цьому максимальна і ентропія.
Перше начало термодинаміки встановлює кількісний закон збереження і перетворення енергії при термодинамічних процесах. Другий закон термодинаміки визначає напрям протікання термодинамічних процесів та встановлює максимально можливі границі перетворення теплоти в роботу при колових процесах (термодинамічних циклах).
Друге начало термодинаміки: будь-який необоротній процес в замкненій системі протікає так, що ентропія системи при цьому зростає (закон зростання ентропії).
Існують й інші формулювання другого начала термодинаміки.
Карно довів неможливість повного перетворення тепловою машиною наданого їй тепла в роботу, оскільки частина тепла віддається холодильнику – друге начало термодинаміки.
Ломоносов давав таке формулювання другого начала термодинаміки: самовільно тепло переходить від нагрітого тіла до холодного, а не навпаки.
За Клаузіусом: неможливий коловий процес, єдиним результатом якого є перетворення теплоти, отриманої від нагрівника, в еквівалентну їй роботу.
За Кельвіном і Планком – неможливо створити такий замкнений цикл, єдиною дією якого є перетворення тепла в роботу (вічний двигун другого роду неможливий).
Як би такий двигун був можливий, то людство мало невичерпну енергію, наприклад, за рахунок охолодження океанів.
Третє начало термодинаміки – теорема Нернста-Планка – постулює поведінку термодинамічних систем при абсолютному нулі (нулі Кельвін): ентропія усіх тіл у стані рівноваги прямує до нуля по мірі наближення температури до нуля Кельвін:
![]() .
.
