
- •Государственная фармакопея республики беларусь первое издание
- •Республики Беларусь
- •1. Общие сведения
- •1.1. Общие положения
- •1.2. Другие положения, распространяющиеся на общие и частные фармакопейные статьи
- •Условия хранения лекарственного средства
- •Пределы, указываемые на упаковке
- •1.5. Сокращения и обозначения
- •1.6. Единицы международной системы (си), используемые в фармакопейных статьях, и их соответствие другим единицам
- •2. Методы анализа
- •2.1. Оборудование
- •2.1.1. Каплемер
- •2.1.2. Сравнительная таблица пористости стеклянных фильтров
- •Пористость фильтра (ф.Евр.) (1)
- •Максимальный диаметр пор в микрометрах
- •2.1.3. Лампы с ультрафиолетовым излучением для аналитических целей
- •2.1.4. Сита
- •2.2. Физические и физико-химические методы
- •2.2.1. Определение прозрачности и степени мутности жидкостей
- •2.2.2. Определение степени окрашивания жидкостей
- •2.2.3. Потенциометрическое определение рН
- •2.2.4. Зависимость между реакцией раствора, приблизительным значением рН и цветом индикаторов
- •Изменение цвета
- •2.2.5. Относительная плотность
- •2.2.6. Показатель преломления (индекс рефракции)
- •2.2.7. Оптическое вращение
- •2.2.8. Вязкость
- •1/Прив 1
- •2.2.9. Метод капиллярной вискозиметрии
- •2.2.10. Метод ротационной вискозиметрии
- •2.2.11. Температурные пределы перегонки
- •2.2.14. Температура плавления - капиллярный метод
- •2.2.17. Температура каплепадения
- •2.2.18. Температура затвердевания
- •2.2.21. Флуориметрия
- •2.2.22. Атомно-эмиссионная спектрометрия
- •2.2.23. Атомно-абсорбционная спектрометрия
- •2.2.24. Абсорбционная спектрофотометрия в инфракрасной
- •2.2.25. Абсорбционная спектрофотометрия в ультрафиолетовой видимой областях
- •2. Многокомпонентный спектрофотометрический анализ.
- •2.2.26. Бумажная хроматография
- •2.2.27. Тонкослойная хроматография
- •2.2.28. Газовая хроматография
- •2.2.29. Жидкостная хроматография
- •2.2.30. Эксклюзионная хроматография
- •2.2.31. Электрофорез
- •2.2.32. Потеря в массе при высушивании
- •2.2.33. Спектрометрия ядерного магнитного резонанса
- •2.2.34. Термогравиметрия
- •2.2.35. Осмоляльность
- •2.2.36. Потенциометрическое определение концентрации ионов с использованием ионселективных электродов
- •2.2.37. Рентгенофлуоресцентная спектрометрия
- •2.2.38. Удельная электропроводность
- •2.2.39. Молекулярно-массовое распределение декстранов
- •2.2.40. Спектрофотометрия ближнего ик-диапазона
- •2.2.41. Круговой дихроизм
- •2.2.42. Плотность твердых тел
- •2.2.43. Масс-спектрометрия
- •2.2.44. Определение содержания общего органического углерода в воде для фармацевтического применения
- •2.2.45. Сверхкритическая флюидная хроматография
- •2.2.46. Хроматографические методы разделения
- •2.2.47. Капиллярный электрофорез
- •2.2.48. Рамановская спектрометрия (# спектрометрия комбинационного рассеяния)
- •2.2.54. Изоэлектрическое фокусирование
- •2.3.1. Реакции подлинности (идентификации) на ионы и функциональные группы
- •2.3.2. Идентификация жирных масел методом тонкослойной хроматографии
- •2.3.3. Идентификация фенотиазинов методом тонкослойной хроматографии
- •2.3.4. Определение запаха
- •2.4. Испытания на предельное содержание примесей
- •2.4.1. Аммония соли
- •2.4.2. Мышьяк
- •2.4.3. Кальций
- •2.4.6. Магний
- •2.4.7. Магний и щелочноземельные металлы
- •2.4.8. Тяжелые металлы
- •2.4.15. Никель в полиолах
- •2.4.1.6. Общая зола
- •2.4.21. Посторонние масла в жирных маслах методом тонкослойной хроматографии
- •2.4.22. Посторонние жирные кислоты в маслах методом газовой хроматографии
- •2.4.23. Стерины в жирных маслах
- •2.4.24. Идентификация остаточных растворителей и их количественное определение
- •2.4.25. Остаточные количества этиленоксида и диоксана
- •2.4.27. Никель в гидрогенизированных растительных маслах
- •2.5. Методы количественного определения 2.5.1. Кислотное число
- •2.5.3. Гидроксильное число
- •2.5.4. Йодное число
- •2.5.5. Перекисное (пероксидное) число
- •2.5.6. Число омыления
- •2.5.7. Неомыляемые вещества
- •2.5.8. Определение аминного азота в соединениях, которые содержат первичную ароматическую аминогруппу
- •2.5.9. Определение азота после минерализации серной кислотой
- •2.5.10. Метод сжигания в колбе с кислородом
- •2.5.11. Комплексометрическое титрование
- •2.5.12. Вода: полумикрометод (#Метод к.Фишера)
- •2.5.13. Алюминий в адсорбированных вакцинах
- •2.5.14. Кальций в адсорбированных вакцинах
- •2.5.20. Гексозамины в полисахаридных вакцинах
- •2.5.21. Метилпентозы в полисахаридных вакцинах
- •2.5.24. Диоксид углерода в газах
- •2.5.25. Оксид углерода в газах
- •2.5.26. Оксид азота и диоксид азота в газах
- •2.5.27. Кислород в газах
- •2.5.30. Окисляющие вещества
- •2.5.33. Общий белок
- •2.5.34. Уксусная кислота в синтетических пептидах
- •2.6. Биологические испытания
- •2.6.1. Стерильность
- •2.6.2. Микобактерии
- •2.6.3. Испытания на посторонние вирусы с использованием куриных эмбрионов
- •2.6.4. Испытание на вирусы лейкоза
- •2.6.5. Испытание на посторонние вирусы с использованием клеточных культур
- •2.6.6. Испытание на посторонние агенты с использованием цыплят.
- •2.6.7. Микоплазмы
- •2.6.8 Пирогенность
- •2.6.9. Аномальная токсичность
- •2.6.10. Гистамин
- •2.6.11. Депрессорные вещества
- •2.6.12. Микробиологические испытания нестерильной продукции (суммарное количество жизнеспособных аэробов)
- •2.6.13. Микробилогические испытания нестерильной продукции (испытания на наличие специфических микроорганизмов)
- •0,9 % Раствор натрия хлорида
- •1 % Раствор фенолового красного
- •0,5 % Раствор малахитового зеленого
- •2.6.14. Бактериальные эндотоксины
- •1. Предварительные испытания
- •2. Предельное испытание (метод а) (I) Методика
- •2. Полуколичественное испытание (метод в)
- •1. Турбидиметрический принцип (методы с и f)
- •2.6.15. Активатор прекалликреина
- •2.6.16. Испытания на посторонние агенты в вирусных вакцинах для медицинского применения
- •2.6.17. Испытание на антикомплементарную активность иммуноглобулина
- •2.6.18. Испытание живых вирусных вакцин на нейровирулентность
- •2.6.19. Испытание пероральной вакцины полиомиелита на нейровирулентность
- •5.1. Предотвращение загрязнения
- •5.4 Детектирование
- •7.1 Валидация системы для количественного определения методом
- •7.2. Контроль качества реагентов.
- •7.3. Контроль хода испытания.
- •7.4. Внешняя оценка качества
- •2.6.22. Активированные факторы свертывания крови
- •2.7 Биологические методы количественного определения
- •2.7.1. Иммунохимические методы
- •2.7.2. Количественное определение антибиотиков микробиологическим методом
- •2.7.3. Количественное определение кортикотропина
- •2.7.4. Количественное определение фактора свертывания крови VIII
- •2.7.5. Количественное определение гепарина
- •2.7.6. Количественное определение вакцины дифтерии (адсорбированной)
- •2.7.7. Количественное определение вакцины коклюша
- •2.7.8. Количественное определение вакцины столбняка (адсорбированной)
- •2.7.9. Определение функционального состояния Fc-фрагмента иммуноглобулина
- •2.7.10. Количественное определение фактора свертывания крови человека VII
- •2.7.11. Количественное определение фактора свертывания крови человека IX
- •2.7.12. Количественное определение гепарина в концентратах
- •2.7.13. Количественное определение человеческого анти-d-иммуноглобулина
- •2.7.14. Количественное определение антигенной (иммуногенной) активности вакцины гепатита а
- •2.7.15. Количественное определение вакцины гепатита в (rdna)
- •2.7.16. Количественное определение вакцины коклюша (бесклеточной)
- •2.7.17. Количественное определение антитромбина III человека
- •2.7.18. Количественное определение фактора свертывания крови II
- •2.7.19. Количественное определение фактора свертывания крови х
- •2.7.20. Количественное определение инактивированной вакцины полиомиелита in vivo
- •2.7.22. Количественное определение фактора свертывания крови человека XI
- •2.8. Методы анализа лекарственного растительного сырья и лекарственных средств из него
- •2.8.1. Зола, нерастворимая в хлористоводородной кислоте
- •2.8.4. Коэффициент набухания
- •2.8.5. Определение воды в эфирных маслах
- •2.8.10. Растворимость эфирных масел в спирте
- •2.8.11. Определение 1,8-цинеола в эфирных маслах
- •2.8.12. Определение эфирного масла
- •2.8.13. Остаточное количество пестицидов
- •1. Экстракция
- •2. Очистка
- •3. Количественный анализ
- •Относительные времена удерживания инсектицидов
- •2.8.15. Определение показателя горечи
- •2.8.16. Сухой остаток экстрактов
- •2.8.17. Потеря в массе при высушивании экстракта
- •2.9. Фармацевтико-технологические испытания
- •2.9.1. Распадаемость таблеток и капсул
- •2.9.2. Распадаемость суппозиториев и пессариев
- •2.9.3. Тест «растворение» для твердых дозированных форм
- •2.9.4. Тест «растворение» для трансдермальных пластырей
- •2.9.5. Однородность массы для единицы дозированного лекарственного средства
- •2.9.6. Однородность содержания действующего вещества в
- •2.9.7. Прочность таблеток без оболочки на истирание
- •2.9.8. Прочность таблеток на сжатие
- •2.9.9. Измерение консистенции методом пенетрометрии
- •2.9.10 Содержание этанола
- •2.9.11. Испытание на содержание метанола и 2-пропанола
- •2.9.12. Ситовой анализ
- •2.9.15. Насыпной объем
- •2.9.16. Сыпучесть
- •2.9.17. Определение извлекаемого объема парентеральных лекарственных средств
- •Масса действующего вещества высвобожденного при опорожнении
- •Фракция действующего вещества (%)
- •2.9.19. Загрязнение механическими включениями: невидимые частицы.
- •2.9.20. Загрязнение механическими включениями: видимые частицы
- •2.9.21. Загрязнение механическими включениями: метод микроскопии
- •2.9.22. Опредление времени деформации липофильных суппозиториев
- •2.9.23. Определение плотности твердых частиц при помощи пикнометра
- •2.9.24. Устойчивость суппозиториев и пессариев к разрушению
- •2.9.26. Опредедение удельной площади поверхности методом газовой адсорбции
- •III.1.3. Количество образца
- •III.2.1. Метод 1: метод динамического потока
- •III.2.2. Метод 2: метод объёмного анализа
- •2.9.27. Однородность массы одной дозы высвобожденной из многодозового контейнера
- •2.9.28. Определение массы или объема содержимого контейнера для жидких и мягких лекарственных средств
- •3.1. Материалы, используемые для производства контейнеров
- •3.1.1. Материалы, используемые для производства контейнеров для человеческой крови и компонентов
- •3.1.1.1. Материалы на основе пластифицированного поливинилхлорида, используемые для производства
- •3.1.1.2. Материалы на основе пластифицированного поливинилхлорида для трубок, используемых в комплектах для переливания крови и компонентов крови
- •3.1.3. Полиолефины
- •3.1.4. Полиэтилен без добавок для контейнеров для парентеральных и офтальмологических лекарственных средств
- •3.1.5. Полиэтилен с добавками для контейнеров для
- •3.1.6. Полипропилен для контейнеров и укупорочных материалов для парентеральных и офтальмологических лекарственных средств
- •3.1.7. Полиэтиленвинилацетат для контейнеров и трубок для лекарственных средств для парентерального питания
- •3.1.8. Силиконовое масло, используемое в качестве смазывающей добавки
- •3.1.9. Силиконовые эластомеры для укупорочных
- •3.1.10. Материалы на основе непластифицированного поливинилхлорида для контейнеров для неинъекционных водных растворов
- •3.1.11. Материалы на основе непластифицированного поливинилхлорида для контейнеров для твердых лекарственных форм для перорального применения
- •3.1.13. Добавки к пластмассе
- •3.1.14. Материалы на основе пластифицированного поливинилхлорида для контейнеров для водных растворов для внутривенного применения
- •3.1.15. Полиэтилентерефталат для контейнеров для лекарственных средств для непарентерального применения
- •3.2. Контейнеры
- •3.2.1. Стеклянные контейнеры для фармацевтического использования
- •3.2.2. Пластмассовые контейнеры и укупорочные средства для фармацевтического использования
- •3.2.2.1. Пластмассовые контейнеры для водных растворов для парентерального применения
- •3.2.3. Стерильные пластмассовые контейнеры для человеческой крови и ее компонентов
- •3.2.4. Пустые стерильные контейнеры из пластифицированного поливинилхлорида для человеческой крови и ее компонентов
- •3.2.5. Стерильные контейнеры из пластифицированного поливинилхлорида для человеческой крови, содержащие раствор антикоагулянта
- •3.2.6. Комплекты для переливания крови и компонентов крови
- •3.2.8. Стерильные одноразовые пластмассовые шприцы
- •3.2.9. Резиновые укупорочные средства для контейнеров, предназначенных для водных лекарственных средств для парентерального применения, порошков и лиофилизированных порошков
- •4. Реактивы
- •4.1. Реактивы, эталонные растворы, буферные растворы
- •4.1.1. Реактивы
- •4.1.2. Эталонные растворы для испытаний на предельное содержание примесей
- •0,1 М фосфатный буферный раствор рН 8,0. 4008400.
- •4.2. Реактивы, титрованные растворы для объемного нализа
- •1 М щелочной раствор меди-этилендиамина. 3008700
- •5.1 Общие тексты по стерилизации
- •5.1.1. Методы приготовления стерильных продуктов
- •5.1.2. Биологические индикаторы стерилизации
- •5.1.3. Эффективность антимикробных консервантов
- •24 Часа
- •5.1.4. Микробиологическая чистота лекарственных средств
- •5.1.5 .Применение f0 концепции при стерилизации паром водных растворов.
- •5.2. Общая информация о вакцинах
- •5.2.1. Общепринятая терминология
- •5.2.2. Стаи кур, не имеющих конкретных патогенов и используемые для производства вакцин и контроля их качества
- •5.2.3. Субстраты клеток для производства вакцин, используемых людьми
- •5.2.6. Оценка безопасности вакцин
- •5.2.7. Оценка эффективности вакцин
- •5.2.8. Снижение риска передачи возбудителей губчатой энцефалопатии через лекарственные средства
- •1. Общие замечания
- •2. Область применения общей главы
- •3.1. Животные как источник материала
- •3.2. Части тел животных, жидкости и выделения в качестве исходных материалов
- •3.3. Проверка процесса
- •5.3. Статистические методы обработки результатов анализа
- •5.3.1. Статистический анализ результатов биологических исследований и количественных определений
- •1.1. Общие положения и точность
- •2. Рандомизация и независимость конкретных исследований
- •3. Количественные определения, основанные на количественных эффектах
- •3.1. Статистические модели
- •3.2. Модель параллельных линий
- •3.2.2.1 Схема полной рандомизации
- •3.2.2.2 Схема рандомизированных блоков
- •3.3. Модель угловых коэффициентов
- •3.3.5.2 (/7С/)-схема
- •4. Тесты с альтернативным типом эффекта 4.1. Введение
- •4.2. Метод пробит-анализа
- •5.1. Модель параллельных линий.
- •5.2. Модель угловых коэффициентов
- •5.3. Альтернативные эффекты
- •6 Объединение результатов количественного определения 6.1. Введение
- •6.2. Взвешенное объединение результатов количественного определения
- •6.3. Невзвешенное объединение результатов количественного опре- деления
- •6.4. Пример определения взешенной средней активности с доверительн1м интервалом
- •7. Дополнение
- •7.1. Общие линейные модели
- •7.4. Ошибки корреляции
- •8. Таблицы и процедуры генерирования
- •8.5. Случайные размещения
- •8.6. Латинские квадраты
- •9. Принятые обозначения
- •1. Выборка
- •1.1. Среднее зна чение и дисперсия
- •1.3. Доверительные интервалы и оценка их величины.
- •1.4. Односторонние и двусторонние доверительные интервалы.
- •2. Метрологические характеристики методики анализа
- •2.1.1. Объединенная дисперсия и объединенное среднее
- •2.1.2. Критерий Бартлетта.
- •2.1.3. Критерий Кохрейна.
- •2.2. Проверка наличия значимой систематической погрешности.
- •3. Сравнение двух методик анализа по воспроизводимости
- •4. Метрологическая характеристика среднего результата.
- •5. Сравнение средних результатов двух выборок
- •5.3. Известно точное значение величины а.
- •6. Интерпретация результатов анализа, полученных с помощью метрологически аттестованной методики.
- •6.1. Оценка сходимости результатов параллельных определений.
- •6.2. Определение необходимого числа параллельных определений.
- •6.3. Гарантия качества продукции.
- •7. Расчет и статистическая оценка параметров линейной зависимости
- •8. Последовательная схема статистического анализа результатов химических измерений
- •9. Примеры
- •9.1 Вычисление среднего значения и дисперсии.
- •9.2 Проверка однородности выборки малого объема
- •9.3. Вычисление доверительных интервалов и неопределенностей измерений.
- •9.4. Проверка гипотезы равенства дисперсий.
- •9.4.1. Объединение результатов выборок разного объема.
- •9.4.2. Объединение результатов выборок одинакового объема.
- •9.5. Сравнение двух методик анализа по воспроизводимости.
- •9.6. Сравнение средних результатов двух выборок.
- •9.7. Оценка качества продукции.
- •9.8. Контроль содержания салициловой кислоты в салициловом спирте посредством секвенционального анализа.
- •10. Расчет неопределенности функции нескольких случайных переменных
- •10.1. Линейная модель
- •10.1.1. Взвешенное среднее
- •10.2. Подход Уэлча-Сатертуэйта
- •10.3. Примеры расчетов неопределенности функции нескольких переменных
- •10.3.1. Расчет неопределенности вэжх-анализа готового лекарственного средства
- •10.3.1.1. Конечная аналитическая операция
- •10.3.1.2. Суммарная неопределенность пробоподготовки asp,r.
- •10.3.1.3. Расчет суммарной неопределенности анализа aAs,r
- •10.3.2. Прогноз неопределенности спектрофотометрического анализа готового лекарственного средства
- •10.3.3. Расчет среднего значения нескольких неравноточных выборок
- •1. Введение
- •2. Аналитические испытания и методики, подлежащие валидации
- •3. Валидационные характеристики и требования
- •4. Словарь
- •2. Специфичность
- •5. Правильность
- •5.1. Количественное определение
- •5.2. Примеси (количественное содержание).
- •7. Предел обнаружения
- •8. Предел количественного определения
- •8.3. Использование калибровочной прямой и стандартного отклонения сигнала
- •9. Робастность
- •10. Проверка пригодности хроматографической системы
- •3. Неинструментальные испытания на чистоту и предельное содержание примесей
- •5. Разделительные методы
- •6.1. Метод добавок
- •6.2. Сравнение с арбитражным методом
- •5.4. Остаточные количества органических растворителей
- •5.4.1. Введение
- •5.4.2. Область применения
- •5.4.3. Общие положения
- •5.4.4. Предельные содержания остаточных растворителей
- •5.5. Алкоголеметрические таблицы
- •5.6. Отчет об исследовании интерферонов
- •3.3. Процедура исследования
- •3.3.1. Определение уровня доза-ответ
- •5.7. Таблица физических упоминаемых в фармакопеи
- •Вероятность эмиссии
- •Энергия (мЭв)
- •Энергия (мЭв)
- •Вероят ность эмиссии (на
- •Энергия (мЭв)
- •Вероятность эмиссии
- •5.8. Биодоступность и биоэквивалентность генерических лекарственных средств
- •3. Регистрационная оценка взаимозаменяемых лекарственных
- •4. Исследования эквивалентности, необходимые для
- •4.2.1. Исследования биоэквивалентности/биодоступности (исследования на человеке)
- •4.2.2. Общие методические подходы к выполнению исследований биоэк- вивалентности/биодоступности
- •4.2.3. Исследования сравнительной кинетики растворения (исследования вне живого организма)
- •4.3. Отсутствие необходимости в исследованиях биоэквивалентности или биодоступности
- •5. Дизайн и проведение исследований биологической эквивалентности и биодоступности на людях 5.1. Общие требования.
- •5.2. Испытуемые
- •6. Регламент фармакокинетического исследования
- •7. Аналитический метод
- •8. Анализ фармакокинетических данных
- •8.1. Параметры, подлежащие оценке
- •8.1.1. Однократное введение лекарственного средства
- •8.1.2. Многократное введение лекарственного средства
- •9. Исключение резко выделяющихся наблюдений
- •12. Фармакодинамические исследования
- •13. Клинические испытания
- •14. Тест сравнительной кинетики растворения in vitro
- •15. Клинически значимые колебания биодоступности, обуславливающие отказ в регистрации лекарственного средства
- •Лабораторных животных
- •Участие в испытаниях биоэквивалентности/биодоступности
- •Номограмма для определения достаточного числа добровольцев по результатам проведенного исследования.
- •Хорошо растворимые лекарственные средства
- •Средства с высокой степенью абсорбции
- •Перечень терапевтических (лечебных) доз средств на основе лекарственного растительного сырья
- •Основная литература
- •6. Общие статьи на лекарственные формы и субстанции
2.6.6. Испытание на посторонние агенты с использованием цыплят.
Если в частной статье нет иных указаний, испытание проводят не менее, чем на 10 цыплятах двухнедельного возраста, отобранных из групп, не содержащих специфических патогенов. Каждому из цыплят делают прививку в количестве 100 доз внутримышечно и 10 доз путем закапывания в глаза. Через две недели прививки повторяют. Птиц наблюдают в течение пяти недель со дня первой прививки. В течение периода наблюдения птицам не вводятся антимикробные агенты.
Проводят отбор сыворотки у каждого из цыплят перед первой прививкой и в конце испытания. Каждую из сывороток исследуют соответствующим методом. Определяют наличие антител против нижеперечисленных инфекционных агентов, за исключением антител против вируса, из которого была изготовлена вакцина. Вакцина не выдерживает испытания при наличии любых доказательств присутствия посторонних агентов. Результаты испытания недостоверны при обнаружении любых антител до прививки. В таком случае испытание повторяют. Результаты испытания также недостоверны, если к его концу выживает менее 80% животных. По согласованию с компетентными органами могут применяться и другие методы испытания при условии их соответствующей специфичности и чувствительности, не меньшей по сравнению с чувствительностью нижеуказанных методов.
Тип
испытания
Агаровый
гель - преципитин
или
ингибирование гемагглютинации
Агаровый
гель - преципитин
Агаровый
гель - преципитин Ингибирование
гемагглютинации Агглютинация
Агаровый
гель - преципитин Агаровый гель -
преципитин или твердофазное
иммуноферментное определение
(ELISA)
Агаровый
гель - преципитин Нейтрализация
сыворотки
Агаровый
гель - преципитин Нейтрализация
сыворотки
Инфекция
Инфекционный бронхит(1)
Инфекционный бурсит (болезнь Гумборо) Болезнь Марека Болезнь Ньюкасла Инфекции , вызываемые Salmonella pullorum
Аденовирусные инфекции(2) Инфекции, вызываемые вирусом птичьей энцефалопатии
Реовирусные инфекции (2) Инфекции, вызываемые вирусом лейкоза(2) Грипп А(2)
Инфекционный ларинготрахе-
ит(2Т
(1) По согласованию с компетентными органами, при рутинных испытаниях партий продукции данное испытание может не выполняться, если для каждой партии вы- полнено испытание на посторонние вирусы с использованием оплодотворенных яиц (2.6.3).
(2) По согласованию с компетентными органами, при рутинных испытаниях партий продукции данное испытание может не выполняться, за исключением случаев, ко- гда это требуется в соответствии с указаниями в частной статье.
2.6.7. Микоплазмы
Если испытание на микоплазмы предписано для основного или рабочего клеточного банка, для посевной партии вирусов или для контрольных клеток, применяют как метод культивирования, так и метод индикаторной клеточной культуры. Если испытание предписано для вирусного сбора, большого количества вакцины или готовой партии продукции, применяют метод культивирования. Метод индикаторной клеточной культуры может при необходимости также использоваться для контроля сред.
МЕТОД КУЛЬТИВИРОВАНИЯ
ВЫБОР ПИТАТЕЛЬНОЙ СРЕДЫ
Испытание выполняют с использованием достаточного количества как твердых, так и жидких питательных сред для того, чтобы в избранных условиях инкубации был обеспечен рост небольшого количества микоплазм, которые могут присутствовать в испытуемом продукте. Жидкие среды должны содержать феноловый красный. Для ряда сред показано наличие удовлетворительных питательных свойств, по крайней мере, для нижеперечисленных организмов. Для каждой новой партии среды должны быть подтверждены питательные свойства в отношении соответствующих организмов из списка.
Acholeplasma laidlawii (вакцины для медицинского и ветеринарного применения, в процессе производства которых используются антибиотики)
Mycoplasma gallisepticum (в случаях, когда для производства вакцин используются материалы, имеющие птичье происхождение или для вакцин, предназначенных для применения в птицеводстве)
Mycoplasma hyorhinis (ветеринарные вакцины, кроме птичьих)
Mycoplasma orale (вакцины для медицинского и ветеринарного применения)
Mycoplasma pneumoniae (вакцины для медицинского применения) или другие подходящие виды, связанные с ферментацией D-глюкозы
Mycoplasma synoviae (в случаях, когда для производства вакцин используются материалы, имеющие птичье происхождение или для вакцин, предназначенных для применения в птицеводстве).
Тест-штаммы представляют собой изоляты, подвергнутые не более, чем 15 пересевам, и хранящиеся в замороженном или лиофилизированном состоянии. После клонирования принадлежность штамма к требуемому виду определяется подходящим методом путем сравнения с типовыми культурами, например:
A. laidlawii NCTC 10116 CIP 75.27 ATCC 23206
M. gallisepticum NCTC 10115 CIP 104967 ATCC 19610
M. hyorhinis NCTC 10130 CIP 104968 ATCC 17981
M. orale NCTC 10112 CIP 104969 ATCC 23714
M. pneumoniae NCTC 10119 CIP 103766 ATCC 15531
M. synoviae NCTC 10124 CIP 104970 ATCC 25204
УСЛОВИЯ ИНКУБАЦИИ
Инокулированную среду делят на две равные части, одну из которых инкубируют в аэробных условиях, а другую - в микроаэрофильных условиях; в случае твердых сред поддерживают атмосферную влажность, достаточную для предотвращения высыхания поверхности. В случае аэробных условий при инкубации твердых сред в атмосфере должно присутствовать от 5 до 10% диоксида углерода. Инкубацию в микроаэрофильных условиях проводят в атмосфере азота, в которой, в случае твердых сред, содержится от 5 до 10% диоксида углерода.
ПИТАТЕЛЬНЫЕ СВОЙСТВА
Питательные свойства испытывают для каждой новой партии среды. Выбранные среды засевают соответствующими тест-организмами. На чашку диаметром 60 мм, содержащую 9 мл твердой среды, наносят не менее 100 колоние-образующих единиц, а в контейнер вместимостью 100 мл, содержащий соответствующую жидкую среду, вносят не менее 40 колониеобразующих единиц; для каждого вида организмов используют отдельные чашки и контейнеры. Среды инкубируют в условиях, в которых проводится основное испытание (аэробных, микроаэ-рофильных или тех и других, в зависимости от потребностей тест-организма). Среда выдерживает испытание на питательные свойства, если наблюдается адекватный рост тест-организмов, сопровождаемый соответствующим изменением окраски жидкой среды.
ИНГИБИРУЮЩИЕ ВЕЩЕСТВА
Проводят испытание на питательные свойства в присутствии испытуемого продукта. Если рост тест-организмов заметно менее выражен, чем в отсутствии испытуемого продукта, то последний содержит ингибирующие вещества, требующие нейтрализации (или исключения их влияния другим способом, например, разбавлением) перед проведением испытания на микоплазмы. Эффективность нейтрализации или иного процесса проверяется путем повторения испытания на ингибирующие вещества после нейтрализации.
ИСПЫТАНИЕ АНАЛИЗИРУЕМОГО ПРОДУКТА НА МИКОПЛАЗМЫ
В случае твердых сред используют чашки диаметром 60 мм, содержащие 9 мл питательной среды. Каждая из используемых сред должна содержаться не менее, чем в двух чашках. На каждую чашку наносят по 0,2 мл испытуемого продукта; в каждую жидкую среду вносят испытуемый продукт в соотношении 10 мл на 100 мл среды. Инкубируют при температуре от 35 до 380С в аэробных и микроаэ-рофильных условиях в течение 21 дня. Одновременно инкубируют порции по 100 мл каждой среды без испытуемого продукта для контроля. Если при добавлении испытуемого продукта происходит существенное изменение показателя рН, исходное значение восстанавливают добавлением раствора хлористоводородной кислоты или гидроксида натрия. В первый, второй и третий дни после инокуляции выполняют пересев по 0,2 мл каждой из жидких культур на чашки с твердыми средами (по две чашки для каждой из сред) и инкубируют при температуре от 35 до 380С в аэробных и микроаэрофильных условиях в течение не менее 21 дня. Процедуру повторяют на шестой, седьмой и восьмой, а также на тринадцатый и четырнадцатый дни испытания. Состояние жидких сред контролируют каждые два или три дня и, в случае изменения окраски, выполняют пересев немедленно. Состояние твердых сред оценивают один раз в неделю.
Если в жидких средах обнаруживается бактериальное или грибковое загрязнение, испытание повторяют. Если не ранее, чем через семь дней после инокуляции, не более, чем одна чашка с каждой стадии испытания имеет случайные бактериальные или грибковые примеси или разбита, результаты, связанные с этой чашкой могут не учитываться, если при немедленной проверке на ней не обнаруживается признаков роста микоплазм. Если на любой стадии испытания более одной чашки подвергаются случайному загрязнению бактериями или грибами, или разбивается, испытание считают недействительным и повторяют.
Испытание проводят также для положительных контролей, приготовленных путем инокуляции не более 100 колониеобразующих единиц подходящего штамма, например, M. orale или M. pneumoniae.
В конце периодов инкубации все инокулированные твердые среды изучают под микроскопом для установления наличия микоплазм. Продукт выдерживает испытание, если ни на одной инокулированной среде не обнаружено роста мико-плазм. При обнаружении роста микоплазм испытание может быть проведено повторно с использованием удвоенного количества инокулята, сред и чашек; если роста микоплазм не обнаруживается, то продукт выдерживает испытание. Результаты испытания недостоверны, если в положительных контролях не наблюдается роста соответствующих тест-организмов.
МЕТОД ИНДИКАТОРНОЙ КЛЕТОЧНОЙ КУЛЬТУРЫ
Клеточные культуры окрашиваются флуоресцентным красителем, обладающим способностью связываться с ДНК. Микоплазмы детектируются по их характерной точечной или волокнистой флуоресценции на клеточной поверхности и, при высоком уровне загрязнения, в прилегающем пространстве.
ПРОВЕРКА СУБСТРАТА
Метод подвергают предварительному испытанию с использованием субстрата клеточной культуры Веро и инокулята, содержащего не более 100 коло-ниеобразующих единиц хорошо растущего на жидкой или твердой среде штамма, и показывают возможность определения этим методом потенциальных примесей микоплазм, например, подходящих штаммов Mycoplasma hyorhinis и Mycoplasma orale. Могут использоваться и другие клеточные субстраты, например, производственная линия клеток, если было показано, что чувствительность определения микоплазм не будет меньшей.
Метод испытания
Отбирают не менее 1 мл испытуемого продукта и используют его для засева в двух повторностях индикаторной клеточной культуры, представляющей в совокупности не менее 25 см2 площади клеточной культуры. Руководствуются указаниями подраздела «Процедура».
В испытание включают отрицательный (неинфицированный) контроль и два положительных контроля, содержащих микоплазмы, например, M. hyorhinis и M.
orale. В положительных контролях используют инокулят, содержащий не более 100 колониеобразующих единиц.
Если для вирусных суспензий на интерпретацию результатов влияют заметные цитопатические эффекты, вирус может быть нейтрализован с использованием специфической антисыворотки, не обладающей ингибирующим эффектом в отношении микоплазм или может использоваться субстрат клеточной культуры, не поддерживающий рост вируса. Для демонстрации отсутствия ингибирующего эффекта сыворотки выполняют положительные контрольные тесты в ее присутствии и отсутствии.
Процедура
Среду однородно засевают культурой (от 2х104 до 2х105 клеток в миллилитре, от 4х103 до 2,5х104 клеток на см2) и инкубируют при температуре 36±10С не менее 2 дней. Вносят испытуемый продукт и инкубируют не менее 2 дней; выполняют не менее одного пересева. Последнюю субкультуру выращивают на покровных стеклах в подходящих контейнерах или на другой подходящей поверхности. Не допускают достижения слияния в последней субкультуре, так как это может привести к ингибированию окрашивания и ухудшить визуализацию микоплазм.
Среду извлекают и выбрасывают.
Монослой промывают раствором хлорида натрия в фосфатном буфере рН 7,4 R, затем смесью равных объемов этого раствора и подходящего фиксирующего раствора и, наконец, чистым фиксирующим раствором; если для окрашивания используется бисбензимид R, то подходящим фиксирующим раствором является свежеприготовленная смесь 1 объема ледяной уксусной кислоты R и 3 объемов метанола R.
Добавляют фиксирующий раствор и оставляют на 10 минут.
Фиксирующий раствор удаляют и выбрасывают.
Если монослой будет подвергаться окрашиванию позже, его полностью высушивают. (Требуется особое внимание при окрашивании высушенных стекол ввиду возможности возникновения артефактов).
Если монослой подлежит окрашиванию немедленно, фиксирующий раствор смывают дважды стерильной водой; промывные воды отбрасывают.
Добавляют рабочий раствор бисбензимида R или другой подходящий агент, обладающий способностью вызывать появление окраски при взаимодействии с ДНК, и выдерживают в течение 10 минут.
Краситель удаляют и промывают монослой водой.
При необходимости каждое покровное стекло готовят к изучению путем нанесения капли смеси равных объемов глицерина и раствора хлорида натрия в фосфатном буфере рН 7,4 R; удаляют с краев стекла излишки смеси.
Стекла изучают методом эпифлуоресценции (фильтр возбуждения 330 нм / 380 нм, барьерный фильтр LP 440 нм) при 100-400-кратном (или большем) увеличении.
Изучая внеядерную флуоресценцию, сравнивают микроскопическую картину тест-культур с микроскопическими картинами отрицательного и положительных контролей. Микоплазмы проявляют себя в виде точек или волокон, расположенных над цитоплазмой и иногда в межклеточном пространстве.
Испытуемый продукт выдерживает испытание, если в тест-культурах, на которые он был нанесен, нет признаков присутствия микоплазм. Результаты испытания недостоверны, если в положительных контролях не обнаруживается присутствия соответствующих тест-организмов.
Следующий раздел публикуется для информации.
СРЕДЫ, РЕКОМЕНДУЕМЫЕ ДЛЯ МЕТОДА КУЛЬТИВИРОВАНИЯ
Рекомендуются нижеследующие среды. Могут использоваться и другие среды при условии, что на каждой партии в присутствии и отсутствии испытуемого продукта продемонстрирована способность к поддерживанию роста микоплазм.
СРЕДЫ, РЕКОМЕНДУЕМЫЕ ДЛЯ ОПРЕДЕЛЕНИЯ MYCOPLASMA GALLISEPTICUM
90,0
мл 20,0 мл 10,0 мл 1,0 мл 5,0 мл 0,25 мл 1,2 мл
Жидкая среда
Бульон из экстракта говяжьего сердца (1) Лошадиная сыворотка (не подвергнутая нагреву) Дрожжевой экстракт (250 г/л) Ацетат таллия (раствор концентрацией 10 г/л) Феноловый красный (раствор концентрацией 0,6 г/л) Пенициллин (20 000 МЕ/мл)
Дезоксирибонуклеиновая кислота (раствор концентрацией 0,6 г/л) Значение рН доводят до 7,8. Твердая среда
Готовят так же, заменяя бульон из экстракта говяжьего сердца на агар из экстракта говяжьего сердца, содержащий агар в концентрации 15 г/л.
СРЕДЫ, РЕКОМЕНДУЕМЫЕ ДЛЯ ОПРЕДЕЛЕНИЯ MYCOPLASMA SYNOVIAE
Жидкая среда
Бульон из экстракта говяжьего сердца (1) 90,0 мл
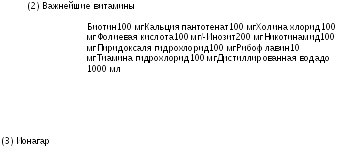
Важнейшие витамины (2) 0,025 мл
Глюкозы моногидрат (раствор концентрацией 500 г/л) 2,0 мл
Поросячья сыворотка (инактивированная при 560С 30 минут) 12,0 мл (З-Никотинамидадениндинуклеотид (раствор концентрацией 10 г/л) 1,0 мл
Цистеина гидрохлорид (раствор концентрацией 10 г/л) 1,0 мл
Феноловый красный (раствор концентрацией 0,6 г/л) 5,0 мл
Пенициллин (20 000 МЕ/мл) 0,25 мл
Смешивают растворы ( -никотинамидадениндинуклеотида и цистеина гидрохлорида и через 10 минут добавляют к остальным компонентам. Значение рН доводят до 7,8.
Твердая среда
Бульон из экстракта говяжьего сердца (1) 90,0 мл
Ионагар (3) 1,4 г
Значение рН доводят до 7,8, стерилизуют автоклавированием, после чего добавляют:
Важнейшие витамины (2) 0,025 мл
Глюкозы моногидрат (раствор концентрацией 500 г/л) 2,0 мл
Поросячья сыворотка (не подвергнутая нагреву) 12,0 мл
( -Никотинамидадениндинуклеотид (раствор концентрацией 10 г/л) 1,0 мл
Цистеина гидрохлорид (раствор концентрацией 10 г/л) 1,0 мл
Феноловый красный (раствор концентрацией 0,6 г/л) 5,0 мл
Пенициллин (20 000 МЕ/мл) 0,25 мл
СРЕДЫ, РЕКОМЕНДУЕМЫЕ ДЛЯ ОПРЕДЕЛЕНИЯ МИКОПЛАЗМ, ИМЕЮЩИХ ОТЛИЧНОЕ ОТ ПТИЧЬЕГО ПРОИСХОЖДЕНИЕ
(4)
800 мл 67 мл 135 мл 248 мл 60 мл 250 мг 250 мг 4,5 мл
3 мл 165 мл 165 мл
Жидкая среда
Сбалансированный солевой раствор Хэнкса (модифицированный) Дистиллированная вода Экстракт из сердца и мозгов (5) Бульон PPLO (6) Дрожжевой экстракт (170 г/л) Бацитрацин Метициллин
Феноловый красный (5 г/л) Ацетат таллия (раствор концентрацией 56 г/л) Лошадиная сыворотка Поросячья сыворотка
Значение рН доводят до 7,4 - 7,45.
Твердая среда
Сбалансированный солевой раствор Хэнкса (модифицированный) (4) 200 мл
DEAE-декстран 200 мг
Ионагар (3) 15,65 мг
Хорошо перемешивают и стерилизуют автоклавированием. Охлаждают до 1000С. Добавляют к 1740 мл вышеописанной жидкой среды.
(1) Бульон из настоя говяжьего сердца
Говяжье сердце (для приготовления экстракта) 500 г
Пептон 10 г
Натрия хлорид 5 г
Дистиллированная вода до 1000 мл
Стерилизуют автоклавированием.
 Высокочистый
агар для использования в микробиологии
и иммунологии готовят ионообменным
методом с получением продукта
исключительной чистоты, прозрачности
и прочности образующегося геля.
Приблизительное содержание в ионагаре:
Высокочистый
агар для использования в микробиологии
и иммунологии готовят ионообменным
методом с получением продукта
исключительной чистоты, прозрачности
и прочности образующегося геля.
Приблизительное содержание в ионагаре:
|
Вода |
12,2% |
|
Зола |
1,5% |
|
Зола, нерастворимая в кислоте |
0,2% |
|
Хлор |
0 |
|
Фосфаты (в пересчете на Р2О5) |
0,3% |
|
Общий азот |
0,3% |
|
Медь |
0,0008% |
|
Железо |
0,017% |
|
Кальций |
0,28% |
|
Магний |
0,32% |
(4) Сбалансированный солевой раствор Хэнкса (модифицированный)
Натрия хлорид 6,4 г
Калия хлорид 0,32 г
Магния сульфат гептагидрат 0,08 г
Магния хлорид гексагидрат 0,08 г
Кальция хлорид безводный 0,112 г
Натрия гидрофосфат дигидрат 0,0596 г
Калия дигидрофосфат безводный 0,048 г
Дистиллированная вода до 1000 мл
(5) Экстракт из сердца и мозгов
Экстракт мозга теленка 200 г
Экстракт говяжьего сердца 250 г
Протеозный пептон 10 г
Глюкозы моногидрат 2 г
Натрия хлорид 5 г
Натрия гидрофосфат безводный 2,5 г
Дистиллированная вода до 1000 мл
(6) Бульон PPLO
Экстракт говяжьего сердца Пептон
Натрия хлорид Дистиллированная вода
50 г 10 г 5 г
до 1000 мл
