
- •Государственная фармакопея республики беларусь первое издание
- •Республики Беларусь
- •1. Общие сведения
- •1.1. Общие положения
- •1.2. Другие положения, распространяющиеся на общие и частные фармакопейные статьи
- •Условия хранения лекарственного средства
- •Пределы, указываемые на упаковке
- •1.5. Сокращения и обозначения
- •1.6. Единицы международной системы (си), используемые в фармакопейных статьях, и их соответствие другим единицам
- •2. Методы анализа
- •2.1. Оборудование
- •2.1.1. Каплемер
- •2.1.2. Сравнительная таблица пористости стеклянных фильтров
- •Пористость фильтра (ф.Евр.) (1)
- •Максимальный диаметр пор в микрометрах
- •2.1.3. Лампы с ультрафиолетовым излучением для аналитических целей
- •2.1.4. Сита
- •2.2. Физические и физико-химические методы
- •2.2.1. Определение прозрачности и степени мутности жидкостей
- •2.2.2. Определение степени окрашивания жидкостей
- •2.2.3. Потенциометрическое определение рН
- •2.2.4. Зависимость между реакцией раствора, приблизительным значением рН и цветом индикаторов
- •Изменение цвета
- •2.2.5. Относительная плотность
- •2.2.6. Показатель преломления (индекс рефракции)
- •2.2.7. Оптическое вращение
- •2.2.8. Вязкость
- •1/Прив 1
- •2.2.9. Метод капиллярной вискозиметрии
- •2.2.10. Метод ротационной вискозиметрии
- •2.2.11. Температурные пределы перегонки
- •2.2.14. Температура плавления - капиллярный метод
- •2.2.17. Температура каплепадения
- •2.2.18. Температура затвердевания
- •2.2.21. Флуориметрия
- •2.2.22. Атомно-эмиссионная спектрометрия
- •2.2.23. Атомно-абсорбционная спектрометрия
- •2.2.24. Абсорбционная спектрофотометрия в инфракрасной
- •2.2.25. Абсорбционная спектрофотометрия в ультрафиолетовой видимой областях
- •2. Многокомпонентный спектрофотометрический анализ.
- •2.2.26. Бумажная хроматография
- •2.2.27. Тонкослойная хроматография
- •2.2.28. Газовая хроматография
- •2.2.29. Жидкостная хроматография
- •2.2.30. Эксклюзионная хроматография
- •2.2.31. Электрофорез
- •2.2.32. Потеря в массе при высушивании
- •2.2.33. Спектрометрия ядерного магнитного резонанса
- •2.2.34. Термогравиметрия
- •2.2.35. Осмоляльность
- •2.2.36. Потенциометрическое определение концентрации ионов с использованием ионселективных электродов
- •2.2.37. Рентгенофлуоресцентная спектрометрия
- •2.2.38. Удельная электропроводность
- •2.2.39. Молекулярно-массовое распределение декстранов
- •2.2.40. Спектрофотометрия ближнего ик-диапазона
- •2.2.41. Круговой дихроизм
- •2.2.42. Плотность твердых тел
- •2.2.43. Масс-спектрометрия
- •2.2.44. Определение содержания общего органического углерода в воде для фармацевтического применения
- •2.2.45. Сверхкритическая флюидная хроматография
- •2.2.46. Хроматографические методы разделения
- •2.2.47. Капиллярный электрофорез
- •2.2.48. Рамановская спектрометрия (# спектрометрия комбинационного рассеяния)
- •2.2.54. Изоэлектрическое фокусирование
- •2.3.1. Реакции подлинности (идентификации) на ионы и функциональные группы
- •2.3.2. Идентификация жирных масел методом тонкослойной хроматографии
- •2.3.3. Идентификация фенотиазинов методом тонкослойной хроматографии
- •2.3.4. Определение запаха
- •2.4. Испытания на предельное содержание примесей
- •2.4.1. Аммония соли
- •2.4.2. Мышьяк
- •2.4.3. Кальций
- •2.4.6. Магний
- •2.4.7. Магний и щелочноземельные металлы
- •2.4.8. Тяжелые металлы
- •2.4.15. Никель в полиолах
- •2.4.1.6. Общая зола
- •2.4.21. Посторонние масла в жирных маслах методом тонкослойной хроматографии
- •2.4.22. Посторонние жирные кислоты в маслах методом газовой хроматографии
- •2.4.23. Стерины в жирных маслах
- •2.4.24. Идентификация остаточных растворителей и их количественное определение
- •2.4.25. Остаточные количества этиленоксида и диоксана
- •2.4.27. Никель в гидрогенизированных растительных маслах
- •2.5. Методы количественного определения 2.5.1. Кислотное число
- •2.5.3. Гидроксильное число
- •2.5.4. Йодное число
- •2.5.5. Перекисное (пероксидное) число
- •2.5.6. Число омыления
- •2.5.7. Неомыляемые вещества
- •2.5.8. Определение аминного азота в соединениях, которые содержат первичную ароматическую аминогруппу
- •2.5.9. Определение азота после минерализации серной кислотой
- •2.5.10. Метод сжигания в колбе с кислородом
- •2.5.11. Комплексометрическое титрование
- •2.5.12. Вода: полумикрометод (#Метод к.Фишера)
- •2.5.13. Алюминий в адсорбированных вакцинах
- •2.5.14. Кальций в адсорбированных вакцинах
- •2.5.20. Гексозамины в полисахаридных вакцинах
- •2.5.21. Метилпентозы в полисахаридных вакцинах
- •2.5.24. Диоксид углерода в газах
- •2.5.25. Оксид углерода в газах
- •2.5.26. Оксид азота и диоксид азота в газах
- •2.5.27. Кислород в газах
- •2.5.30. Окисляющие вещества
- •2.5.33. Общий белок
- •2.5.34. Уксусная кислота в синтетических пептидах
- •2.6. Биологические испытания
- •2.6.1. Стерильность
- •2.6.2. Микобактерии
- •2.6.3. Испытания на посторонние вирусы с использованием куриных эмбрионов
- •2.6.4. Испытание на вирусы лейкоза
- •2.6.5. Испытание на посторонние вирусы с использованием клеточных культур
- •2.6.6. Испытание на посторонние агенты с использованием цыплят.
- •2.6.7. Микоплазмы
- •2.6.8 Пирогенность
- •2.6.9. Аномальная токсичность
- •2.6.10. Гистамин
- •2.6.11. Депрессорные вещества
- •2.6.12. Микробиологические испытания нестерильной продукции (суммарное количество жизнеспособных аэробов)
- •2.6.13. Микробилогические испытания нестерильной продукции (испытания на наличие специфических микроорганизмов)
- •0,9 % Раствор натрия хлорида
- •1 % Раствор фенолового красного
- •0,5 % Раствор малахитового зеленого
- •2.6.14. Бактериальные эндотоксины
- •1. Предварительные испытания
- •2. Предельное испытание (метод а) (I) Методика
- •2. Полуколичественное испытание (метод в)
- •1. Турбидиметрический принцип (методы с и f)
- •2.6.15. Активатор прекалликреина
- •2.6.16. Испытания на посторонние агенты в вирусных вакцинах для медицинского применения
- •2.6.17. Испытание на антикомплементарную активность иммуноглобулина
- •2.6.18. Испытание живых вирусных вакцин на нейровирулентность
- •2.6.19. Испытание пероральной вакцины полиомиелита на нейровирулентность
- •5.1. Предотвращение загрязнения
- •5.4 Детектирование
- •7.1 Валидация системы для количественного определения методом
- •7.2. Контроль качества реагентов.
- •7.3. Контроль хода испытания.
- •7.4. Внешняя оценка качества
- •2.6.22. Активированные факторы свертывания крови
- •2.7 Биологические методы количественного определения
- •2.7.1. Иммунохимические методы
- •2.7.2. Количественное определение антибиотиков микробиологическим методом
- •2.7.3. Количественное определение кортикотропина
- •2.7.4. Количественное определение фактора свертывания крови VIII
- •2.7.5. Количественное определение гепарина
- •2.7.6. Количественное определение вакцины дифтерии (адсорбированной)
- •2.7.7. Количественное определение вакцины коклюша
- •2.7.8. Количественное определение вакцины столбняка (адсорбированной)
- •2.7.9. Определение функционального состояния Fc-фрагмента иммуноглобулина
- •2.7.10. Количественное определение фактора свертывания крови человека VII
- •2.7.11. Количественное определение фактора свертывания крови человека IX
- •2.7.12. Количественное определение гепарина в концентратах
- •2.7.13. Количественное определение человеческого анти-d-иммуноглобулина
- •2.7.14. Количественное определение антигенной (иммуногенной) активности вакцины гепатита а
- •2.7.15. Количественное определение вакцины гепатита в (rdna)
- •2.7.16. Количественное определение вакцины коклюша (бесклеточной)
- •2.7.17. Количественное определение антитромбина III человека
- •2.7.18. Количественное определение фактора свертывания крови II
- •2.7.19. Количественное определение фактора свертывания крови х
- •2.7.20. Количественное определение инактивированной вакцины полиомиелита in vivo
- •2.7.22. Количественное определение фактора свертывания крови человека XI
- •2.8. Методы анализа лекарственного растительного сырья и лекарственных средств из него
- •2.8.1. Зола, нерастворимая в хлористоводородной кислоте
- •2.8.4. Коэффициент набухания
- •2.8.5. Определение воды в эфирных маслах
- •2.8.10. Растворимость эфирных масел в спирте
- •2.8.11. Определение 1,8-цинеола в эфирных маслах
- •2.8.12. Определение эфирного масла
- •2.8.13. Остаточное количество пестицидов
- •1. Экстракция
- •2. Очистка
- •3. Количественный анализ
- •Относительные времена удерживания инсектицидов
- •2.8.15. Определение показателя горечи
- •2.8.16. Сухой остаток экстрактов
- •2.8.17. Потеря в массе при высушивании экстракта
- •2.9. Фармацевтико-технологические испытания
- •2.9.1. Распадаемость таблеток и капсул
- •2.9.2. Распадаемость суппозиториев и пессариев
- •2.9.3. Тест «растворение» для твердых дозированных форм
- •2.9.4. Тест «растворение» для трансдермальных пластырей
- •2.9.5. Однородность массы для единицы дозированного лекарственного средства
- •2.9.6. Однородность содержания действующего вещества в
- •2.9.7. Прочность таблеток без оболочки на истирание
- •2.9.8. Прочность таблеток на сжатие
- •2.9.9. Измерение консистенции методом пенетрометрии
- •2.9.10 Содержание этанола
- •2.9.11. Испытание на содержание метанола и 2-пропанола
- •2.9.12. Ситовой анализ
- •2.9.15. Насыпной объем
- •2.9.16. Сыпучесть
- •2.9.17. Определение извлекаемого объема парентеральных лекарственных средств
- •Масса действующего вещества высвобожденного при опорожнении
- •Фракция действующего вещества (%)
- •2.9.19. Загрязнение механическими включениями: невидимые частицы.
- •2.9.20. Загрязнение механическими включениями: видимые частицы
- •2.9.21. Загрязнение механическими включениями: метод микроскопии
- •2.9.22. Опредление времени деформации липофильных суппозиториев
- •2.9.23. Определение плотности твердых частиц при помощи пикнометра
- •2.9.24. Устойчивость суппозиториев и пессариев к разрушению
- •2.9.26. Опредедение удельной площади поверхности методом газовой адсорбции
- •III.1.3. Количество образца
- •III.2.1. Метод 1: метод динамического потока
- •III.2.2. Метод 2: метод объёмного анализа
- •2.9.27. Однородность массы одной дозы высвобожденной из многодозового контейнера
- •2.9.28. Определение массы или объема содержимого контейнера для жидких и мягких лекарственных средств
- •3.1. Материалы, используемые для производства контейнеров
- •3.1.1. Материалы, используемые для производства контейнеров для человеческой крови и компонентов
- •3.1.1.1. Материалы на основе пластифицированного поливинилхлорида, используемые для производства
- •3.1.1.2. Материалы на основе пластифицированного поливинилхлорида для трубок, используемых в комплектах для переливания крови и компонентов крови
- •3.1.3. Полиолефины
- •3.1.4. Полиэтилен без добавок для контейнеров для парентеральных и офтальмологических лекарственных средств
- •3.1.5. Полиэтилен с добавками для контейнеров для
- •3.1.6. Полипропилен для контейнеров и укупорочных материалов для парентеральных и офтальмологических лекарственных средств
- •3.1.7. Полиэтиленвинилацетат для контейнеров и трубок для лекарственных средств для парентерального питания
- •3.1.8. Силиконовое масло, используемое в качестве смазывающей добавки
- •3.1.9. Силиконовые эластомеры для укупорочных
- •3.1.10. Материалы на основе непластифицированного поливинилхлорида для контейнеров для неинъекционных водных растворов
- •3.1.11. Материалы на основе непластифицированного поливинилхлорида для контейнеров для твердых лекарственных форм для перорального применения
- •3.1.13. Добавки к пластмассе
- •3.1.14. Материалы на основе пластифицированного поливинилхлорида для контейнеров для водных растворов для внутривенного применения
- •3.1.15. Полиэтилентерефталат для контейнеров для лекарственных средств для непарентерального применения
- •3.2. Контейнеры
- •3.2.1. Стеклянные контейнеры для фармацевтического использования
- •3.2.2. Пластмассовые контейнеры и укупорочные средства для фармацевтического использования
- •3.2.2.1. Пластмассовые контейнеры для водных растворов для парентерального применения
- •3.2.3. Стерильные пластмассовые контейнеры для человеческой крови и ее компонентов
- •3.2.4. Пустые стерильные контейнеры из пластифицированного поливинилхлорида для человеческой крови и ее компонентов
- •3.2.5. Стерильные контейнеры из пластифицированного поливинилхлорида для человеческой крови, содержащие раствор антикоагулянта
- •3.2.6. Комплекты для переливания крови и компонентов крови
- •3.2.8. Стерильные одноразовые пластмассовые шприцы
- •3.2.9. Резиновые укупорочные средства для контейнеров, предназначенных для водных лекарственных средств для парентерального применения, порошков и лиофилизированных порошков
- •4. Реактивы
- •4.1. Реактивы, эталонные растворы, буферные растворы
- •4.1.1. Реактивы
- •4.1.2. Эталонные растворы для испытаний на предельное содержание примесей
- •0,1 М фосфатный буферный раствор рН 8,0. 4008400.
- •4.2. Реактивы, титрованные растворы для объемного нализа
- •1 М щелочной раствор меди-этилендиамина. 3008700
- •5.1 Общие тексты по стерилизации
- •5.1.1. Методы приготовления стерильных продуктов
- •5.1.2. Биологические индикаторы стерилизации
- •5.1.3. Эффективность антимикробных консервантов
- •24 Часа
- •5.1.4. Микробиологическая чистота лекарственных средств
- •5.1.5 .Применение f0 концепции при стерилизации паром водных растворов.
- •5.2. Общая информация о вакцинах
- •5.2.1. Общепринятая терминология
- •5.2.2. Стаи кур, не имеющих конкретных патогенов и используемые для производства вакцин и контроля их качества
- •5.2.3. Субстраты клеток для производства вакцин, используемых людьми
- •5.2.6. Оценка безопасности вакцин
- •5.2.7. Оценка эффективности вакцин
- •5.2.8. Снижение риска передачи возбудителей губчатой энцефалопатии через лекарственные средства
- •1. Общие замечания
- •2. Область применения общей главы
- •3.1. Животные как источник материала
- •3.2. Части тел животных, жидкости и выделения в качестве исходных материалов
- •3.3. Проверка процесса
- •5.3. Статистические методы обработки результатов анализа
- •5.3.1. Статистический анализ результатов биологических исследований и количественных определений
- •1.1. Общие положения и точность
- •2. Рандомизация и независимость конкретных исследований
- •3. Количественные определения, основанные на количественных эффектах
- •3.1. Статистические модели
- •3.2. Модель параллельных линий
- •3.2.2.1 Схема полной рандомизации
- •3.2.2.2 Схема рандомизированных блоков
- •3.3. Модель угловых коэффициентов
- •3.3.5.2 (/7С/)-схема
- •4. Тесты с альтернативным типом эффекта 4.1. Введение
- •4.2. Метод пробит-анализа
- •5.1. Модель параллельных линий.
- •5.2. Модель угловых коэффициентов
- •5.3. Альтернативные эффекты
- •6 Объединение результатов количественного определения 6.1. Введение
- •6.2. Взвешенное объединение результатов количественного определения
- •6.3. Невзвешенное объединение результатов количественного опре- деления
- •6.4. Пример определения взешенной средней активности с доверительн1м интервалом
- •7. Дополнение
- •7.1. Общие линейные модели
- •7.4. Ошибки корреляции
- •8. Таблицы и процедуры генерирования
- •8.5. Случайные размещения
- •8.6. Латинские квадраты
- •9. Принятые обозначения
- •1. Выборка
- •1.1. Среднее зна чение и дисперсия
- •1.3. Доверительные интервалы и оценка их величины.
- •1.4. Односторонние и двусторонние доверительные интервалы.
- •2. Метрологические характеристики методики анализа
- •2.1.1. Объединенная дисперсия и объединенное среднее
- •2.1.2. Критерий Бартлетта.
- •2.1.3. Критерий Кохрейна.
- •2.2. Проверка наличия значимой систематической погрешности.
- •3. Сравнение двух методик анализа по воспроизводимости
- •4. Метрологическая характеристика среднего результата.
- •5. Сравнение средних результатов двух выборок
- •5.3. Известно точное значение величины а.
- •6. Интерпретация результатов анализа, полученных с помощью метрологически аттестованной методики.
- •6.1. Оценка сходимости результатов параллельных определений.
- •6.2. Определение необходимого числа параллельных определений.
- •6.3. Гарантия качества продукции.
- •7. Расчет и статистическая оценка параметров линейной зависимости
- •8. Последовательная схема статистического анализа результатов химических измерений
- •9. Примеры
- •9.1 Вычисление среднего значения и дисперсии.
- •9.2 Проверка однородности выборки малого объема
- •9.3. Вычисление доверительных интервалов и неопределенностей измерений.
- •9.4. Проверка гипотезы равенства дисперсий.
- •9.4.1. Объединение результатов выборок разного объема.
- •9.4.2. Объединение результатов выборок одинакового объема.
- •9.5. Сравнение двух методик анализа по воспроизводимости.
- •9.6. Сравнение средних результатов двух выборок.
- •9.7. Оценка качества продукции.
- •9.8. Контроль содержания салициловой кислоты в салициловом спирте посредством секвенционального анализа.
- •10. Расчет неопределенности функции нескольких случайных переменных
- •10.1. Линейная модель
- •10.1.1. Взвешенное среднее
- •10.2. Подход Уэлча-Сатертуэйта
- •10.3. Примеры расчетов неопределенности функции нескольких переменных
- •10.3.1. Расчет неопределенности вэжх-анализа готового лекарственного средства
- •10.3.1.1. Конечная аналитическая операция
- •10.3.1.2. Суммарная неопределенность пробоподготовки asp,r.
- •10.3.1.3. Расчет суммарной неопределенности анализа aAs,r
- •10.3.2. Прогноз неопределенности спектрофотометрического анализа готового лекарственного средства
- •10.3.3. Расчет среднего значения нескольких неравноточных выборок
- •1. Введение
- •2. Аналитические испытания и методики, подлежащие валидации
- •3. Валидационные характеристики и требования
- •4. Словарь
- •2. Специфичность
- •5. Правильность
- •5.1. Количественное определение
- •5.2. Примеси (количественное содержание).
- •7. Предел обнаружения
- •8. Предел количественного определения
- •8.3. Использование калибровочной прямой и стандартного отклонения сигнала
- •9. Робастность
- •10. Проверка пригодности хроматографической системы
- •3. Неинструментальные испытания на чистоту и предельное содержание примесей
- •5. Разделительные методы
- •6.1. Метод добавок
- •6.2. Сравнение с арбитражным методом
- •5.4. Остаточные количества органических растворителей
- •5.4.1. Введение
- •5.4.2. Область применения
- •5.4.3. Общие положения
- •5.4.4. Предельные содержания остаточных растворителей
- •5.5. Алкоголеметрические таблицы
- •5.6. Отчет об исследовании интерферонов
- •3.3. Процедура исследования
- •3.3.1. Определение уровня доза-ответ
- •5.7. Таблица физических упоминаемых в фармакопеи
- •Вероятность эмиссии
- •Энергия (мЭв)
- •Энергия (мЭв)
- •Вероят ность эмиссии (на
- •Энергия (мЭв)
- •Вероятность эмиссии
- •5.8. Биодоступность и биоэквивалентность генерических лекарственных средств
- •3. Регистрационная оценка взаимозаменяемых лекарственных
- •4. Исследования эквивалентности, необходимые для
- •4.2.1. Исследования биоэквивалентности/биодоступности (исследования на человеке)
- •4.2.2. Общие методические подходы к выполнению исследований биоэк- вивалентности/биодоступности
- •4.2.3. Исследования сравнительной кинетики растворения (исследования вне живого организма)
- •4.3. Отсутствие необходимости в исследованиях биоэквивалентности или биодоступности
- •5. Дизайн и проведение исследований биологической эквивалентности и биодоступности на людях 5.1. Общие требования.
- •5.2. Испытуемые
- •6. Регламент фармакокинетического исследования
- •7. Аналитический метод
- •8. Анализ фармакокинетических данных
- •8.1. Параметры, подлежащие оценке
- •8.1.1. Однократное введение лекарственного средства
- •8.1.2. Многократное введение лекарственного средства
- •9. Исключение резко выделяющихся наблюдений
- •12. Фармакодинамические исследования
- •13. Клинические испытания
- •14. Тест сравнительной кинетики растворения in vitro
- •15. Клинически значимые колебания биодоступности, обуславливающие отказ в регистрации лекарственного средства
- •Лабораторных животных
- •Участие в испытаниях биоэквивалентности/биодоступности
- •Номограмма для определения достаточного числа добровольцев по результатам проведенного исследования.
- •Хорошо растворимые лекарственные средства
- •Средства с высокой степенью абсорбции
- •Перечень терапевтических (лечебных) доз средств на основе лекарственного растительного сырья
- •Основная литература
- •6. Общие статьи на лекарственные формы и субстанции
1.6. Единицы международной системы (си), используемые в фармакопейных статьях, и их соответствие другим единицам
МЕЖДУНАРОДНАЯ СИСТЕМА ЕДИНИЦ (СИ)
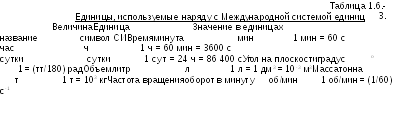
Международная система единиц состоит из трех классов единиц физических величин, а именно: основные единицы, производные единицы и вспомогательные единицы. Основные единицы и их определения приведены в Табл. 1.6.-1.
Таблица 1.6.-1.
Основные единицы СИ
|
Величина |
Единица |
Определение | ||
|
Наименование |
Символ |
Наименование |
Символ | |
|
Длина |
l |
метр |
м |
Один метр представляет собой длину пути, который проходит свет в вакууме за 1/299 792 458 долю секунды |
|
Масса |
m |
килограмм |
кг |
Один килограмм равен массе международного прототипа килограмма |
|
Время |
t |
секунда |
с |
Одна секунда представляет собой продолжительность 9 192 631 770 периодов излучения, соответствующих переходу между двумя сверхтонкими уровнями основного состояния атома цезия - 133 |
|
Сила тока |
I |
ампер |
А |
Один ампер представляет собой силу неизменяющегося тока, который при прохождении по двум прямолинейным параллельным проводникам бесконечной длины и пренебрежимо малой площади кругового поперечного сечения, расположенным на расстоянии 1 метр один от другого в вакууме, вызывал бы силу взаимодействия, равную 2.10-7 ньютона на один метр длины |
|
Термодинамическая (абсолютная) температура |
Т |
кельвин |
К |
Один кельвин представляет собой 1/273,16 часть термодинамической температуры тройной точки воды |
|
Количество вещества |
n |
моль |
М |
Один моль представляет собой количество вещества системы, содержащей столько же структурных элементов, сколько атомов содержится в 0,012 килограммах углерода-12() |
|
Сила света |
Iv |
кандела |
кд |
Кандела представляет собой силу света источника, испускающего в данном направлении монохроматическое излучение частотой 540 1012 герц, энергетическая сила которого в этом направлении составляет 1/683 ватта на один стерадиан |
п Если ..... . . .
например, атомы, молекулы, ионы, электроны, иные частицы или определенные группы таких объектов.
 Единицы
физических величин, входящие в систему,
но определяемые через основные единицы
этой системы, называются производными
единицами системы. Некоторые из таких
производных величин имеют свои названия
и символы. Единицы таких величин,
используемых в Фармакопейных статьях,
приведены в Табл. 1.6.-2.
Единицы
физических величин, входящие в систему,
но определяемые через основные единицы
этой системы, называются производными
единицами системы. Некоторые из таких
производных величин имеют свои названия
и символы. Единицы таких величин,
используемых в Фармакопейных статьях,
приведены в Табл. 1.6.-2.
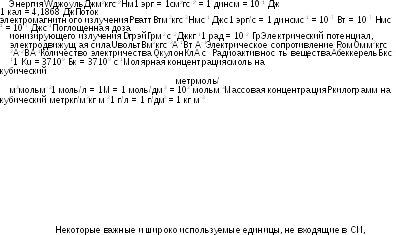
 приведены
в Табл. 1.6.-3.
приведены
в Табл. 1.6.-3.
Для обозначения температуры по Цельсию используется символ t. Температура по Цельсию определяется согласно уравнению t = Т-То, где То=273,15 К. Температура по Цельсию выражается в градусах Цельсия (символ оС). Один «градус Цельсия» равен одному кельвину.
Практические выражения для концентраций определены в Общих замечаниях.
Радиан представляет собой плоский угол, вырезающий на окружности дугу, равную по длине радиусу.
Условия центрифугирования определяются центробежным ускорением по отношению к ускорению свободного падения (g), которое принимается равным g = 9,806 65 мс-2.
Некоторые величины используются без размерности, как, например, относительная плотность (статья «Относительная плотность» 2.2.5.), оптическая плотность (статья «Абсорбционная спектрофотометрия в ультрафиолетовой и видимой областях» 2.2.25.), удельный показатель поглощения (статья « Абсорбционная спектрофотометрия в ультрафиолетовой и видимой областях» 2.2.25.) и показатель преломления (статья «Показатель преломления» 2.2.6.); равно как и величины, выраженные в иных единицах, как, например, удельный показатель оптического вращения (статья «Оптическое вращение» 2.2.7.).
Микрокатал определяется как энзиматическая активность, которая при указанных условиях приводит к превращению (например, к гидролизу) 1 микромоля субстрата за одну секунду.
# 1.7. ОТБОР ПРОБ
ОСНОВНЫЕ ПОНЯТИЯ
Выборка - количество штучной продукции, отобранной из контролируемой серии (партии).
Готовый продукт - продукт, прошедший все стадии техологического процесса, включая маркировку, упаковку, лабораторный контроль.
Контейнер - изделие, которое содержит продукцию или предназначено для ее хранения и находится или может находиться в непосредственном контакте с ней. Укупорочное средство является частью контейнера.
Контроль - процедура оценки соответствия путем измерений, наблюдений, испытаний или калибрования соответствующих характеристик.
Контаминация - процесс загрязнения
Нерасфасованный продукт (ангро или in bulk product) - продукт, прошедший все стадии технологического процесса, кроме упаковывания.
Отбор проб - действия по изъятию проб сырья, материалов, полупродуктов, промежуточной и готовой продукции для исследования их качества.
Объем выборки - число выборочных единиц в выборке.
Объединенная проба - проба продукции, состоящая из нескольких точечных проб, отобранных из контролируемой партии.
Образец продукции - единица конкретной продукции, используемая в качестве представителя этой продукции при исследовании, контроле и оценке.
Промежуточная продукция - частично обработанное сырье или продукция, которые должны пройти последующие технологические операции прежде, чем стать нерасфасованной продукцией.
Проба - количество нештучной продукции, отобранной из контролируемой серии (партии) для принятия решения и состоящая из нескольких точечных проб.
Сырье - фармацевтические субстанции, части лекарственных растений или продукты их переработки, вспомогательные вещества, собственного производства или получаемые от внешних поставщиков, используемые в производстве лекарственных средств, за исключением маркировочных и упаковочных материалов.
Серия (партия) - количество продукции одного наименования, полученное в одном технологическом цикле или в течение определенного интервала времени, в одних и тех же условиях и одновременно представленной на контроль. Качество серии (партии) должно быть удостоверено одним документом.
Точечная проба - количество продукции, взятое за один раз из одного места серии (партии) одномоментно.
Упаковка - средство или комплект средств, обеспечивающее: защиту продукции от повреждений и потерь, окружающую среду от загрязнения, а также процесс обращения продукции.
Упаковочная единица - упаковка, содержащая установленное количество продукции.
Чистая зона - зона, в которой контролируется окружающая среда на наличие контаминирующих частиц и микроорганизмов, построенная и эксплуатируемая таким образом, чтобы уменьшить проникновение, образование контаминантов внутри зоны.
ОБЩИЕ ПРАВИЛА
Отбор проб для испытаний должен проводиться в соответствии с процедурой отбора если не указано иное в частных статьях. Процедура отбора проб включает:
план или схему отбора проб;
место и время отбора проб;
извлечение и подготовку проб продукции для испытаний;
объем и тип отбора проб;
параметры окружающей среды при отборе и подготовке проб для испытаний.
Все оборудование, используемое для отбора проб, включая измерительное оборудование для проведения испытаний, связанных с отбором проб, должно удовлетворять требованиям нормативной документации или процедуре отбора проб и должно работать в соответствии с данной процедурой или инструкциями (эксплутационной документацией) на оборудование. Измерительное оборудование должно пройти в установленном порядке поверку или аттестацию.
Персонал, выполняющий отбор проб, должен владеть процедурой отбора. Документация по процедуре отбора проб должна находиться в местах отбора отбора проб и быть доступной для персонала.
В процессе проведения отбора проб необходимо учитывать факторы, которые должны контролироваться с тем, чтобы обеспечить достоверность результатов испытаний. К ним относятся: показатели, обеспечивающие соответствие контролируемых показателей качества и безопасности проб показателям объекта испытаний и стабильность этих показателей в течение периода проведения испытаний; параметры окружающей среды и других воздействующих на пробы факторов.
Пробы прошедшие отбор должны соответствующим образом идентифицироваться с использованием единой маркировки и оформляться актом отбора или другим документом, включающим дату, время и место отбора, условия окружающей среды при отборе, фамилию, имя и отчество лица, проводившего отбор и другую необходимую информацию.
Если поставка сырья или готовой продукции состоит из нескольких серий (партий), то каждую серию (партию) необходимо рассматривать как отдельную в отношении отбора проб и проведения испытаний.
Не допускается отбор проб одновременно от двух и более наименований, двух и более серий (партий) сырья или готовой продукии во избежании ошибок при отборе проб.
Отбор проб для нерасфасованной продукции (ангро или bulk product) должен осуществляться в стерильные контейнеры. Упаковка должна обеспечивать пригодность пробы для проведения испытаний.
К отбору от следующей серии (партии) поступившего сырья или готовой продукции можно приступать только после выполнения всей процедуры отбора от предыдущей серии (партии).
Отбор проб следует производить только из неповрежденных, укупоренных и упакованных согласно нормативной документации упаковочных единиц.
До и после проведения испытаний пробы должны храниться в отдельном помещении. Условия в помещении должны обеспечивать сохранность проб в течение срока хранения.
Перед отбором проб необходимо произвести внешний осмотр упаковочной тары (ящики, короба, барабаны, бутыли и т.д.), определить ее количество, целостность, наличие пломб, правильность маркировки и оформление сопроводительной документации, а также соответствие тары и упаковки требованиям спецификации.
Количество упаковочных единиц, отобранных для отбора, рассчитывают по формуле:
0,4^
где:
n - общее количество упаковочных единиц одной серии (партии).
Количество вскрытых упаковочных единиц должно быть не менее 3 и не более 30.
Отбор проб сырья необходимо производить в отдельном помещении или в складском помещении таким образом, чтобы предотвратить контаминацию.
Для проведения испытаний лекарственных средств на соответствие требованиям нормативной документации проводят многоступенчатый отбор проб. При многоступенчатом отборе пробу образуют по ступеням и продукцию в каждой ступени отбирают случайным образом в пропорциональных количествах из единиц, отобранных в предыдущей ступени. Число ступеней определяется видом упаковки.
I ступень: отбор единиц упаковочной тары (ящиков, коробок, мешков и др.)
ступень: отбор упаковочных единиц, находящихся в упаковочной таре (пакетов, флаконов,банок, бутылок, рулонов и др.)
ступень: отбор продукции в первичной упаковке (ампул, флаконов, туб, контурных упаковок и др.)
При отборе проб необходимо принимать меры предосторожности и требования безопасности, учитывая токсичность, взрывчатость, огнеопасность, гигроскопичность и другие свойства сырья, а также меры, направленные на предохранение проб (образцов) от повреждения и загрязнения во время работы с ними, к их упаковке, транспортировке, складированию и хранению с учетом требований и методов последующих испытаний.
При отборе проб лекарственных средств списка «А», наркотических и психотропных лекарственных средств следует руководствоваться правилами, инструкциями и положениями, утвержденными Министерством здравоохранения Республики Беларусь и частными статьями на эти лекарственные средства.
При отборе проб запрещается принимать пищу, пить, курить, а также хранить еду, средства для курения в специальной одежде или месте отбора проб.
Персонал, занятый отбором проб, должен строго соблюдать инструкции, регламентирующие состояние здоровья и требования личной гигиены, носить специальную обувь.
ОТБОР ПРОБ ИЗ НЕРАСФАСОВАННОЙ ПРОДУКЦИИ (АНГРО ИЛИ IN BULK PRODUCT)
Проба из нерасфасованной продукции должна представлять собой объединенные точечные пробы, взятые примерно в равных количествах.
Отбор точечных проб (объединенная проба) необходимо производить из верхнего, среднего и нижнего слоев каждой упаковочной единицы, убедиться в однородности сыпучих, вязких и гетерогенных препаратов.
При отборе проб сыпучих и вязких лекарственных средств и вспомогательных веществ, для предотвращения перекрестной контаминации точечные пробы необходимо отбирать чистыми и стерильными пробоотборниками, изготовленным из материала, не реагирующего с данным сырьем. Детали пробоотборников, контактирующие с сырьем, должны быть обработаны специальными антисептиками, разрешенными к применению Министерством здравоохранения Республики Беларусь
В случае, если перемешивание жидкости затруднено (большие емкости), точечные пробы отбирают без перемешивания из разных слоев.
ОТБОР ПРОБ ГОТОВЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ (ГОТОВОЙ ПРОДУКЦИИ)
Отбор проб готовых лекарственных средств должен производиться из ненарушенных заводских упаковочных единиц.
Отбор проб готовых лекарственных средств для инъекций и глазных лекарственных средств на отсутствие в них механических включений должен производиться согласно соответствующей документации, утвержденной Министерством здравоохранения Республики Беларусь.
Отбор проб аэрозолей проводят в соответствии с требованиями частных статей.
