
- •Государственная фармакопея республики беларусь первое издание
- •Республики Беларусь
- •1. Общие сведения
- •1.1. Общие положения
- •1.2. Другие положения, распространяющиеся на общие и частные фармакопейные статьи
- •Условия хранения лекарственного средства
- •Пределы, указываемые на упаковке
- •1.5. Сокращения и обозначения
- •1.6. Единицы международной системы (си), используемые в фармакопейных статьях, и их соответствие другим единицам
- •2. Методы анализа
- •2.1. Оборудование
- •2.1.1. Каплемер
- •2.1.2. Сравнительная таблица пористости стеклянных фильтров
- •Пористость фильтра (ф.Евр.) (1)
- •Максимальный диаметр пор в микрометрах
- •2.1.3. Лампы с ультрафиолетовым излучением для аналитических целей
- •2.1.4. Сита
- •2.2. Физические и физико-химические методы
- •2.2.1. Определение прозрачности и степени мутности жидкостей
- •2.2.2. Определение степени окрашивания жидкостей
- •2.2.3. Потенциометрическое определение рН
- •2.2.4. Зависимость между реакцией раствора, приблизительным значением рН и цветом индикаторов
- •Изменение цвета
- •2.2.5. Относительная плотность
- •2.2.6. Показатель преломления (индекс рефракции)
- •2.2.7. Оптическое вращение
- •2.2.8. Вязкость
- •1/Прив 1
- •2.2.9. Метод капиллярной вискозиметрии
- •2.2.10. Метод ротационной вискозиметрии
- •2.2.11. Температурные пределы перегонки
- •2.2.14. Температура плавления - капиллярный метод
- •2.2.17. Температура каплепадения
- •2.2.18. Температура затвердевания
- •2.2.21. Флуориметрия
- •2.2.22. Атомно-эмиссионная спектрометрия
- •2.2.23. Атомно-абсорбционная спектрометрия
- •2.2.24. Абсорбционная спектрофотометрия в инфракрасной
- •2.2.25. Абсорбционная спектрофотометрия в ультрафиолетовой видимой областях
- •2. Многокомпонентный спектрофотометрический анализ.
- •2.2.26. Бумажная хроматография
- •2.2.27. Тонкослойная хроматография
- •2.2.28. Газовая хроматография
- •2.2.29. Жидкостная хроматография
- •2.2.30. Эксклюзионная хроматография
- •2.2.31. Электрофорез
- •2.2.32. Потеря в массе при высушивании
- •2.2.33. Спектрометрия ядерного магнитного резонанса
- •2.2.34. Термогравиметрия
- •2.2.35. Осмоляльность
- •2.2.36. Потенциометрическое определение концентрации ионов с использованием ионселективных электродов
- •2.2.37. Рентгенофлуоресцентная спектрометрия
- •2.2.38. Удельная электропроводность
- •2.2.39. Молекулярно-массовое распределение декстранов
- •2.2.40. Спектрофотометрия ближнего ик-диапазона
- •2.2.41. Круговой дихроизм
- •2.2.42. Плотность твердых тел
- •2.2.43. Масс-спектрометрия
- •2.2.44. Определение содержания общего органического углерода в воде для фармацевтического применения
- •2.2.45. Сверхкритическая флюидная хроматография
- •2.2.46. Хроматографические методы разделения
- •2.2.47. Капиллярный электрофорез
- •2.2.48. Рамановская спектрометрия (# спектрометрия комбинационного рассеяния)
- •2.2.54. Изоэлектрическое фокусирование
- •2.3.1. Реакции подлинности (идентификации) на ионы и функциональные группы
- •2.3.2. Идентификация жирных масел методом тонкослойной хроматографии
- •2.3.3. Идентификация фенотиазинов методом тонкослойной хроматографии
- •2.3.4. Определение запаха
- •2.4. Испытания на предельное содержание примесей
- •2.4.1. Аммония соли
- •2.4.2. Мышьяк
- •2.4.3. Кальций
- •2.4.6. Магний
- •2.4.7. Магний и щелочноземельные металлы
- •2.4.8. Тяжелые металлы
- •2.4.15. Никель в полиолах
- •2.4.1.6. Общая зола
- •2.4.21. Посторонние масла в жирных маслах методом тонкослойной хроматографии
- •2.4.22. Посторонние жирные кислоты в маслах методом газовой хроматографии
- •2.4.23. Стерины в жирных маслах
- •2.4.24. Идентификация остаточных растворителей и их количественное определение
- •2.4.25. Остаточные количества этиленоксида и диоксана
- •2.4.27. Никель в гидрогенизированных растительных маслах
- •2.5. Методы количественного определения 2.5.1. Кислотное число
- •2.5.3. Гидроксильное число
- •2.5.4. Йодное число
- •2.5.5. Перекисное (пероксидное) число
- •2.5.6. Число омыления
- •2.5.7. Неомыляемые вещества
- •2.5.8. Определение аминного азота в соединениях, которые содержат первичную ароматическую аминогруппу
- •2.5.9. Определение азота после минерализации серной кислотой
- •2.5.10. Метод сжигания в колбе с кислородом
- •2.5.11. Комплексометрическое титрование
- •2.5.12. Вода: полумикрометод (#Метод к.Фишера)
- •2.5.13. Алюминий в адсорбированных вакцинах
- •2.5.14. Кальций в адсорбированных вакцинах
- •2.5.20. Гексозамины в полисахаридных вакцинах
- •2.5.21. Метилпентозы в полисахаридных вакцинах
- •2.5.24. Диоксид углерода в газах
- •2.5.25. Оксид углерода в газах
- •2.5.26. Оксид азота и диоксид азота в газах
- •2.5.27. Кислород в газах
- •2.5.30. Окисляющие вещества
- •2.5.33. Общий белок
- •2.5.34. Уксусная кислота в синтетических пептидах
- •2.6. Биологические испытания
- •2.6.1. Стерильность
- •2.6.2. Микобактерии
- •2.6.3. Испытания на посторонние вирусы с использованием куриных эмбрионов
- •2.6.4. Испытание на вирусы лейкоза
- •2.6.5. Испытание на посторонние вирусы с использованием клеточных культур
- •2.6.6. Испытание на посторонние агенты с использованием цыплят.
- •2.6.7. Микоплазмы
- •2.6.8 Пирогенность
- •2.6.9. Аномальная токсичность
- •2.6.10. Гистамин
- •2.6.11. Депрессорные вещества
- •2.6.12. Микробиологические испытания нестерильной продукции (суммарное количество жизнеспособных аэробов)
- •2.6.13. Микробилогические испытания нестерильной продукции (испытания на наличие специфических микроорганизмов)
- •0,9 % Раствор натрия хлорида
- •1 % Раствор фенолового красного
- •0,5 % Раствор малахитового зеленого
- •2.6.14. Бактериальные эндотоксины
- •1. Предварительные испытания
- •2. Предельное испытание (метод а) (I) Методика
- •2. Полуколичественное испытание (метод в)
- •1. Турбидиметрический принцип (методы с и f)
- •2.6.15. Активатор прекалликреина
- •2.6.16. Испытания на посторонние агенты в вирусных вакцинах для медицинского применения
- •2.6.17. Испытание на антикомплементарную активность иммуноглобулина
- •2.6.18. Испытание живых вирусных вакцин на нейровирулентность
- •2.6.19. Испытание пероральной вакцины полиомиелита на нейровирулентность
- •5.1. Предотвращение загрязнения
- •5.4 Детектирование
- •7.1 Валидация системы для количественного определения методом
- •7.2. Контроль качества реагентов.
- •7.3. Контроль хода испытания.
- •7.4. Внешняя оценка качества
- •2.6.22. Активированные факторы свертывания крови
- •2.7 Биологические методы количественного определения
- •2.7.1. Иммунохимические методы
- •2.7.2. Количественное определение антибиотиков микробиологическим методом
- •2.7.3. Количественное определение кортикотропина
- •2.7.4. Количественное определение фактора свертывания крови VIII
- •2.7.5. Количественное определение гепарина
- •2.7.6. Количественное определение вакцины дифтерии (адсорбированной)
- •2.7.7. Количественное определение вакцины коклюша
- •2.7.8. Количественное определение вакцины столбняка (адсорбированной)
- •2.7.9. Определение функционального состояния Fc-фрагмента иммуноглобулина
- •2.7.10. Количественное определение фактора свертывания крови человека VII
- •2.7.11. Количественное определение фактора свертывания крови человека IX
- •2.7.12. Количественное определение гепарина в концентратах
- •2.7.13. Количественное определение человеческого анти-d-иммуноглобулина
- •2.7.14. Количественное определение антигенной (иммуногенной) активности вакцины гепатита а
- •2.7.15. Количественное определение вакцины гепатита в (rdna)
- •2.7.16. Количественное определение вакцины коклюша (бесклеточной)
- •2.7.17. Количественное определение антитромбина III человека
- •2.7.18. Количественное определение фактора свертывания крови II
- •2.7.19. Количественное определение фактора свертывания крови х
- •2.7.20. Количественное определение инактивированной вакцины полиомиелита in vivo
- •2.7.22. Количественное определение фактора свертывания крови человека XI
- •2.8. Методы анализа лекарственного растительного сырья и лекарственных средств из него
- •2.8.1. Зола, нерастворимая в хлористоводородной кислоте
- •2.8.4. Коэффициент набухания
- •2.8.5. Определение воды в эфирных маслах
- •2.8.10. Растворимость эфирных масел в спирте
- •2.8.11. Определение 1,8-цинеола в эфирных маслах
- •2.8.12. Определение эфирного масла
- •2.8.13. Остаточное количество пестицидов
- •1. Экстракция
- •2. Очистка
- •3. Количественный анализ
- •Относительные времена удерживания инсектицидов
- •2.8.15. Определение показателя горечи
- •2.8.16. Сухой остаток экстрактов
- •2.8.17. Потеря в массе при высушивании экстракта
- •2.9. Фармацевтико-технологические испытания
- •2.9.1. Распадаемость таблеток и капсул
- •2.9.2. Распадаемость суппозиториев и пессариев
- •2.9.3. Тест «растворение» для твердых дозированных форм
- •2.9.4. Тест «растворение» для трансдермальных пластырей
- •2.9.5. Однородность массы для единицы дозированного лекарственного средства
- •2.9.6. Однородность содержания действующего вещества в
- •2.9.7. Прочность таблеток без оболочки на истирание
- •2.9.8. Прочность таблеток на сжатие
- •2.9.9. Измерение консистенции методом пенетрометрии
- •2.9.10 Содержание этанола
- •2.9.11. Испытание на содержание метанола и 2-пропанола
- •2.9.12. Ситовой анализ
- •2.9.15. Насыпной объем
- •2.9.16. Сыпучесть
- •2.9.17. Определение извлекаемого объема парентеральных лекарственных средств
- •Масса действующего вещества высвобожденного при опорожнении
- •Фракция действующего вещества (%)
- •2.9.19. Загрязнение механическими включениями: невидимые частицы.
- •2.9.20. Загрязнение механическими включениями: видимые частицы
- •2.9.21. Загрязнение механическими включениями: метод микроскопии
- •2.9.22. Опредление времени деформации липофильных суппозиториев
- •2.9.23. Определение плотности твердых частиц при помощи пикнометра
- •2.9.24. Устойчивость суппозиториев и пессариев к разрушению
- •2.9.26. Опредедение удельной площади поверхности методом газовой адсорбции
- •III.1.3. Количество образца
- •III.2.1. Метод 1: метод динамического потока
- •III.2.2. Метод 2: метод объёмного анализа
- •2.9.27. Однородность массы одной дозы высвобожденной из многодозового контейнера
- •2.9.28. Определение массы или объема содержимого контейнера для жидких и мягких лекарственных средств
- •3.1. Материалы, используемые для производства контейнеров
- •3.1.1. Материалы, используемые для производства контейнеров для человеческой крови и компонентов
- •3.1.1.1. Материалы на основе пластифицированного поливинилхлорида, используемые для производства
- •3.1.1.2. Материалы на основе пластифицированного поливинилхлорида для трубок, используемых в комплектах для переливания крови и компонентов крови
- •3.1.3. Полиолефины
- •3.1.4. Полиэтилен без добавок для контейнеров для парентеральных и офтальмологических лекарственных средств
- •3.1.5. Полиэтилен с добавками для контейнеров для
- •3.1.6. Полипропилен для контейнеров и укупорочных материалов для парентеральных и офтальмологических лекарственных средств
- •3.1.7. Полиэтиленвинилацетат для контейнеров и трубок для лекарственных средств для парентерального питания
- •3.1.8. Силиконовое масло, используемое в качестве смазывающей добавки
- •3.1.9. Силиконовые эластомеры для укупорочных
- •3.1.10. Материалы на основе непластифицированного поливинилхлорида для контейнеров для неинъекционных водных растворов
- •3.1.11. Материалы на основе непластифицированного поливинилхлорида для контейнеров для твердых лекарственных форм для перорального применения
- •3.1.13. Добавки к пластмассе
- •3.1.14. Материалы на основе пластифицированного поливинилхлорида для контейнеров для водных растворов для внутривенного применения
- •3.1.15. Полиэтилентерефталат для контейнеров для лекарственных средств для непарентерального применения
- •3.2. Контейнеры
- •3.2.1. Стеклянные контейнеры для фармацевтического использования
- •3.2.2. Пластмассовые контейнеры и укупорочные средства для фармацевтического использования
- •3.2.2.1. Пластмассовые контейнеры для водных растворов для парентерального применения
- •3.2.3. Стерильные пластмассовые контейнеры для человеческой крови и ее компонентов
- •3.2.4. Пустые стерильные контейнеры из пластифицированного поливинилхлорида для человеческой крови и ее компонентов
- •3.2.5. Стерильные контейнеры из пластифицированного поливинилхлорида для человеческой крови, содержащие раствор антикоагулянта
- •3.2.6. Комплекты для переливания крови и компонентов крови
- •3.2.8. Стерильные одноразовые пластмассовые шприцы
- •3.2.9. Резиновые укупорочные средства для контейнеров, предназначенных для водных лекарственных средств для парентерального применения, порошков и лиофилизированных порошков
- •4. Реактивы
- •4.1. Реактивы, эталонные растворы, буферные растворы
- •4.1.1. Реактивы
- •4.1.2. Эталонные растворы для испытаний на предельное содержание примесей
- •0,1 М фосфатный буферный раствор рН 8,0. 4008400.
- •4.2. Реактивы, титрованные растворы для объемного нализа
- •1 М щелочной раствор меди-этилендиамина. 3008700
- •5.1 Общие тексты по стерилизации
- •5.1.1. Методы приготовления стерильных продуктов
- •5.1.2. Биологические индикаторы стерилизации
- •5.1.3. Эффективность антимикробных консервантов
- •24 Часа
- •5.1.4. Микробиологическая чистота лекарственных средств
- •5.1.5 .Применение f0 концепции при стерилизации паром водных растворов.
- •5.2. Общая информация о вакцинах
- •5.2.1. Общепринятая терминология
- •5.2.2. Стаи кур, не имеющих конкретных патогенов и используемые для производства вакцин и контроля их качества
- •5.2.3. Субстраты клеток для производства вакцин, используемых людьми
- •5.2.6. Оценка безопасности вакцин
- •5.2.7. Оценка эффективности вакцин
- •5.2.8. Снижение риска передачи возбудителей губчатой энцефалопатии через лекарственные средства
- •1. Общие замечания
- •2. Область применения общей главы
- •3.1. Животные как источник материала
- •3.2. Части тел животных, жидкости и выделения в качестве исходных материалов
- •3.3. Проверка процесса
- •5.3. Статистические методы обработки результатов анализа
- •5.3.1. Статистический анализ результатов биологических исследований и количественных определений
- •1.1. Общие положения и точность
- •2. Рандомизация и независимость конкретных исследований
- •3. Количественные определения, основанные на количественных эффектах
- •3.1. Статистические модели
- •3.2. Модель параллельных линий
- •3.2.2.1 Схема полной рандомизации
- •3.2.2.2 Схема рандомизированных блоков
- •3.3. Модель угловых коэффициентов
- •3.3.5.2 (/7С/)-схема
- •4. Тесты с альтернативным типом эффекта 4.1. Введение
- •4.2. Метод пробит-анализа
- •5.1. Модель параллельных линий.
- •5.2. Модель угловых коэффициентов
- •5.3. Альтернативные эффекты
- •6 Объединение результатов количественного определения 6.1. Введение
- •6.2. Взвешенное объединение результатов количественного определения
- •6.3. Невзвешенное объединение результатов количественного опре- деления
- •6.4. Пример определения взешенной средней активности с доверительн1м интервалом
- •7. Дополнение
- •7.1. Общие линейные модели
- •7.4. Ошибки корреляции
- •8. Таблицы и процедуры генерирования
- •8.5. Случайные размещения
- •8.6. Латинские квадраты
- •9. Принятые обозначения
- •1. Выборка
- •1.1. Среднее зна чение и дисперсия
- •1.3. Доверительные интервалы и оценка их величины.
- •1.4. Односторонние и двусторонние доверительные интервалы.
- •2. Метрологические характеристики методики анализа
- •2.1.1. Объединенная дисперсия и объединенное среднее
- •2.1.2. Критерий Бартлетта.
- •2.1.3. Критерий Кохрейна.
- •2.2. Проверка наличия значимой систематической погрешности.
- •3. Сравнение двух методик анализа по воспроизводимости
- •4. Метрологическая характеристика среднего результата.
- •5. Сравнение средних результатов двух выборок
- •5.3. Известно точное значение величины а.
- •6. Интерпретация результатов анализа, полученных с помощью метрологически аттестованной методики.
- •6.1. Оценка сходимости результатов параллельных определений.
- •6.2. Определение необходимого числа параллельных определений.
- •6.3. Гарантия качества продукции.
- •7. Расчет и статистическая оценка параметров линейной зависимости
- •8. Последовательная схема статистического анализа результатов химических измерений
- •9. Примеры
- •9.1 Вычисление среднего значения и дисперсии.
- •9.2 Проверка однородности выборки малого объема
- •9.3. Вычисление доверительных интервалов и неопределенностей измерений.
- •9.4. Проверка гипотезы равенства дисперсий.
- •9.4.1. Объединение результатов выборок разного объема.
- •9.4.2. Объединение результатов выборок одинакового объема.
- •9.5. Сравнение двух методик анализа по воспроизводимости.
- •9.6. Сравнение средних результатов двух выборок.
- •9.7. Оценка качества продукции.
- •9.8. Контроль содержания салициловой кислоты в салициловом спирте посредством секвенционального анализа.
- •10. Расчет неопределенности функции нескольких случайных переменных
- •10.1. Линейная модель
- •10.1.1. Взвешенное среднее
- •10.2. Подход Уэлча-Сатертуэйта
- •10.3. Примеры расчетов неопределенности функции нескольких переменных
- •10.3.1. Расчет неопределенности вэжх-анализа готового лекарственного средства
- •10.3.1.1. Конечная аналитическая операция
- •10.3.1.2. Суммарная неопределенность пробоподготовки asp,r.
- •10.3.1.3. Расчет суммарной неопределенности анализа aAs,r
- •10.3.2. Прогноз неопределенности спектрофотометрического анализа готового лекарственного средства
- •10.3.3. Расчет среднего значения нескольких неравноточных выборок
- •1. Введение
- •2. Аналитические испытания и методики, подлежащие валидации
- •3. Валидационные характеристики и требования
- •4. Словарь
- •2. Специфичность
- •5. Правильность
- •5.1. Количественное определение
- •5.2. Примеси (количественное содержание).
- •7. Предел обнаружения
- •8. Предел количественного определения
- •8.3. Использование калибровочной прямой и стандартного отклонения сигнала
- •9. Робастность
- •10. Проверка пригодности хроматографической системы
- •3. Неинструментальные испытания на чистоту и предельное содержание примесей
- •5. Разделительные методы
- •6.1. Метод добавок
- •6.2. Сравнение с арбитражным методом
- •5.4. Остаточные количества органических растворителей
- •5.4.1. Введение
- •5.4.2. Область применения
- •5.4.3. Общие положения
- •5.4.4. Предельные содержания остаточных растворителей
- •5.5. Алкоголеметрические таблицы
- •5.6. Отчет об исследовании интерферонов
- •3.3. Процедура исследования
- •3.3.1. Определение уровня доза-ответ
- •5.7. Таблица физических упоминаемых в фармакопеи
- •Вероятность эмиссии
- •Энергия (мЭв)
- •Энергия (мЭв)
- •Вероят ность эмиссии (на
- •Энергия (мЭв)
- •Вероятность эмиссии
- •5.8. Биодоступность и биоэквивалентность генерических лекарственных средств
- •3. Регистрационная оценка взаимозаменяемых лекарственных
- •4. Исследования эквивалентности, необходимые для
- •4.2.1. Исследования биоэквивалентности/биодоступности (исследования на человеке)
- •4.2.2. Общие методические подходы к выполнению исследований биоэк- вивалентности/биодоступности
- •4.2.3. Исследования сравнительной кинетики растворения (исследования вне живого организма)
- •4.3. Отсутствие необходимости в исследованиях биоэквивалентности или биодоступности
- •5. Дизайн и проведение исследований биологической эквивалентности и биодоступности на людях 5.1. Общие требования.
- •5.2. Испытуемые
- •6. Регламент фармакокинетического исследования
- •7. Аналитический метод
- •8. Анализ фармакокинетических данных
- •8.1. Параметры, подлежащие оценке
- •8.1.1. Однократное введение лекарственного средства
- •8.1.2. Многократное введение лекарственного средства
- •9. Исключение резко выделяющихся наблюдений
- •12. Фармакодинамические исследования
- •13. Клинические испытания
- •14. Тест сравнительной кинетики растворения in vitro
- •15. Клинически значимые колебания биодоступности, обуславливающие отказ в регистрации лекарственного средства
- •Лабораторных животных
- •Участие в испытаниях биоэквивалентности/биодоступности
- •Номограмма для определения достаточного числа добровольцев по результатам проведенного исследования.
- •Хорошо растворимые лекарственные средства
- •Средства с высокой степенью абсорбции
- •Перечень терапевтических (лечебных) доз средств на основе лекарственного растительного сырья
- •Основная литература
- •6. Общие статьи на лекарственные формы и субстанции
1.2. Другие положения, распространяющиеся на общие и частные фармакопейные статьи
Количество вещества. При описании количественного определения или испытания с численно заданными пределами количество вещества, необходимое для проведения испытания может отклоняться в пределах +10% от указанного количества. Необходимо взять точную навеску анализируемого вещества (или отмерить его каким-либо другим способом) и все вычисления производить для этого точного количества вещества.
# Если в частной статье не указана точность взятия навески, вещество должно бьть точно взвешено («точная навеска») таким образом, чтобы неточность взвешивания (сумма случайной и систематической ошибки) не превышала 0,1% от желаемого.
Точность взвешивания считается удовлетворительной, когда утроенное значение стандартного отклонения не менее чем десяти повторных взвешиваний деленное на массу навески не превышает 0,001. Для титрометрического определения взвешивание должно обеспечивать то количество значащих цифр в навеске, которое соответствует количеству значащих цифр в концентрации титранта.
Если пределы испытания заданы не численно, а определяются путем сравнения со стандартом при тех же условиях, для испытания берут строго указанное количество вещества. Реактивы всегда берут в строго указанных количествах.
Если значения массы навесок или объемов не используют для дальнейших расчетов, то точность их взятия (отмеривания, отвешивания) должна согласовываться с указанной в статье точностью. Точность взвешивания должна быть +5 единиц после последней указанной цифры; например, навеска 0,25 г может находиться в пределах от 0,245 г до 0,255 г, а навеска 0,2 г - от 0,15 г до 0,25 г. Объемы отмеривают следующим образом: если после десятичной запятой стоит 0 или число, заканчивающееся 0 (например, 10,0 мл или 0,50 мл), требуемый объем отмеривают с помощью пипетки, мерной колбы или бюретки. В остальных случаях можно использовать градуированный мерный цилиндр или градуированную пипетку. Микролитры отмеривают с помощью микропипетки или микрошприца.
Оборудование и аналитические операции. Стеклянная мерная посуда должна соответствовать требованиям класса А Международного стандарта, выпущенного Международной организацией по стандартизации (ISO) # или национального стандарта Республики Беларусь.
Аналитические операции, если нет других указаний, осуществляются при температуре от 15оС до 25оС.
Сравнительные испытания, если нет других указаний, проводят с использованием пробирок из бесцветного прозрачного нейтрального стекла с плоским основанием и внутренним диаметром 16 мм. Сравнивают равные объемы жидкостей на белом (или, при необходимости, на черном) фоне. Испытания проводят в рассеянном свете.
Если для проведения испытания или количественного определения требуется использовать растворитель с растворенным в нем индикатором и при этом не предусмотрен контрольный опыт, этот растворитель предварительно нейтрализуют по этому индикатору.
Контрольный опыт. Под контрольным опытом подразумевают определение, проводимое с теми же количествами реактивов и в тех же условиях, но без испытуемого образца.
Водяная баня. Если нет других указаний, то подразумевается баня с кипящей водой. Можно использовать и другие способы нагревания, если они гарантированно обеспечивают температуру, близкую, но не превосходящую 100оС (или другую указанную температуру).
Ледяная баня. Подразумевается баня с температурой 0оС. Если необходимо охлаждение до более низкой температуры, применяют смесь льда с некоторыми электролитами (соли, кислоты).
Высушивание и прокаливание до постоянной массы. Результаты двух последних взвешиваний должны отличаться не более чем на 0,5 мг; интервал времени между двумя взвешиваниями определяется свойствами и количеством высушиваемого/прокаливаемого остатка.
В тех случаях, когда требуется высушивание «в эксикаторе» или «в вакууме», оно осуществляется в соответствии с условиями, описанными в статье «Потеря в массе при высушивании».
РЕАКТИВЫ
Надежность результатов, получаемых с помощью описанных в Фармакопейных статьях аналитических операций, зависит, в частности, от качества используемых реактивов. Реактивы описаны в общей Фармакопейной статье «Реактивы». Подразумеваемая степень чистоты - не ниже квалификации «аналитической чистоты» (analytical grade) или квалификации «чистый для анализа» (ч.д.а.). Для некоторых реактивов включены испытания для определения пригодности.
РАСТВОРИТЕЛИ
Если для растворов не указан растворитель, то подразумевают водные растворы. Для проведения описанных в Фармакопейных статьях аналитических операций и для приготовления реактивов используют воду, соответствующую требованиям частной статьи «Вода очищенная». Термин «вода дистиллированная» означает «вода очищенная», полученная путем дистилляции.
Термин «этанол» без уточнений означает абсолютный спирт. Термин «спирт» без уточнений означает этиловый спирт, содержащий примерно 96 объемных процентов этанола. Другие степени разбавления обозначаются термином «спирт» с указанием содержания этанола в объемных процентах.
# Термин «эфир» без уточнений означает диэтиловый эфир.
СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ
Выражение «%» может иметь одно из трех значений:
массовый процент (м/м) - число граммов вещества в 100 граммах конечного продукта;
объемный процент (об/об) - число миллилитров вещества в 100 миллилитрах конечного продукта;
# массо-объемный процент (м/об) - число граммов вещества в 100 миллилитрах конечного продукта.
Обозначение «ppm» (частей на миллион) подразумевает массовое соотношение.
# Если указано, что при приготовлении смеси растворителей их берут в соотношении (a:b), то имеется в виду соотношение объемов. Например, соотношение: гексан-бензол (1:3) означает, что смешивают 1 объем гексана с 3 объемами бензола.
ТЕМПЕРАТУРА
Кроме конкретного указания температуры при проведении испытаний используют также следующие термины:
глубокое охлаждение ниже -15оС;
в холодильнике от 2оС до 8оС;
в холодном или прохладном месте от 8оС до 15оС;
при комнатной температуре от 15оС до 25оС.
# Кроме терминов, приведенных выше, используются также следующие термины:
теплый от 40оС до 50оС;
горячий от 80оС до 90оС;
температура «водяной бани» от 98оС до 100оС;
- температура «ледяной бани» 0оС.
ОБЩИЕ ФАРМАКОПЕЙНЫЕ СТАТЬИ
КОНТЕЙНЕРЫ
Материалы, используемые для контейнеров, описаны в общей статье 3. «Контейнеры».
Для материалов, используемых для производства контейнеров, особенно для полимерных материалов, используют общие названия, каждое из которых охватывает ряд материалов, отличающихся как свойствами основного компонента, так и используемыми добавками. Испытания и пределы нормирования зависят от конкретного состава материала и таким образом применимы только при условии, что материал соответствует вводной части его спецификации. По согласованию с компетентным уполномоченным органом могут использоваться материалы других составов, а также испытания для них.
Спецификации на контейнеры, включенные в статью 3, разрабатывались для всех контейнеров указанной категории. Однако, учитывая большое разнообразие существующих контейнеров и возможность появления новых контейнеров, публикация спецификации не исключает возможности использования контейнеров, соответствующих другой спецификации, если это обосновано и согласовано с компетентным уполномоченным органом.
В статьях Фармакопеи могут даваться ссылки на определения и спецификации контейнеров. В разделах «Определение», «Производство» общих статей на лекарственные формы может содержаться требование по использованию определенного типа контейнера. В разделе «Хранение» некоторых статей может указываться тип рекомендуемого контейнера.
ЧАСТНЫЕ ФАРМАКОПЕЙНЫЕ СТАТЬИ
НАЗВАНИЯ
Кроме названий на русском языке, приводится также латинское название. Это название может использоваться вместо русского названия, равно как и любой другой синоним, который признан эквивалентным компетентным уполномоченным органом.
ОТНОСИТЕЛЬНЫЕ АТОМНЫЕ И МОЛЕКУЛЯРНЫЕ МАССЫ
Относительная атомная масса (А.м.) или относительная молекулярная масса (М.м.) указываются, когда это необходимо, в начале частной Фармакопейной статьи. Относительную атомную массу, относительную молекулярную массу, молекулярную формулу и графическую формулу приводят как информационный материал.
ВВОДНАЯ ЧАСТЬ ЧАСТНЫХ ФАРМАКОПЕЙНЫХ СТАТЕЙ
В вводной части, идущей после названия монографии, приводится официальное определение субстанции, готового лекарственного средства или иного продукта, являющегося предметом частной фармакопейной статьи.
Пределы содержания. Если указаны пределы содержания, то это пределы, полученные с использованием метода, указанного в разделе «Количественное определение».
Лекарственные средства, содержащие лекарственное растительное сырье. В частных статьях на лекарственные средства, содержащие лекарственное растительное сырье, вводная часть включает указание на предмет частной статьи. Это может быть, например, лекарственное растительное сырье в исходном виде или лекарственное растительное сырье, измельченное в порошок. Если частная статья распространяется на несколько вариантов, например, на оба из указанных, то это оговаривается во вводной части.
ПРОИЗВОДСТВО
Информация в разделе «Производство» призвана привлечь внимание к некоторым важным аспектам процесса производства и не обязательно является исчерпывающей. Содержащиеся в ней инструкции адресованы производителю. Они могут относиться, например, к материалам, к процессу производства, к его валидации и контролю, к постадийному контролю, а также к испытаниям, которые производитель должен проводить перед выпуском для каждой серии продукта или для выбранных серий. Эти положения обязательно должны быть подтверждены посредством анализа конечного продукта. Компетентным уполномоченным органом может быть установлено, что приведенные вышеуказанные аспекты были выполнены. Такое заключение может быть сделано на основании проверки полученных от производителя данных, или при инспектировании производства, или при испытании соответствующих образцов.
Отсутствие раздела «Производство» не означает, что аспекты процесса производства, отмеченные выше, не требуют внимания. Любой описанный в частной фармакопейной статье продукт должен производиться в соответствии с принципами надлежащей производственной практики (GMP) и соответствующими международными соглашениями, а также национальными и наднациональными законами, распространяющимися на продукты, предназначенные для использования в медицине.
В разделе «Производство» в частной фармакопейной статье на вакцину могут быть указаны свойства штамма и тестовые методы для подтверждения этих свойств. Эти методы приводятся для информации в качестве примера.
ОПИСАНИЕ (СВОЙСТВА)
Информация, приведенная в этом разделе, носит рекомендательный характер.
Растворимость. # Под «растворимостью» подразумевают свойство вещества растворяться в различных растворителях, принятых в ГФ РБ. Показатели растворимости вещества в различных растворителях приводятся в частных фармакопейных статьях.
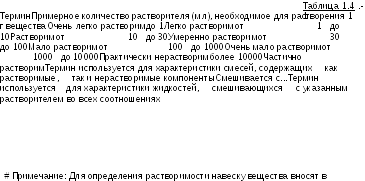 Для
обозначения растворимости в данном
подразделе используются описательные
термины, которые в температурном
интервале от 15оС
до 25оС
имеют смысл, обозначенный в Табл. 1.4.-1.
Для
обозначения растворимости в данном
подразделе используются описательные
термины, которые в температурном
интервале от 15оС
до 25оС
имеют смысл, обозначенный в Табл. 1.4.-1.
отмеренное количество растворителя и непрерывно встряхивают в течение 10 минут при температуре 20+5оС. Предварительно образец может быть растерт. Для медленно растворимых образцов, требующих для своего растворения более 10 минут, допускается также нагревание на водяной бане до 30оС; наблюдение производят после охлаждения раствора до температуры 20+5оС и энергичного встряхивания в течение 1-2 минут. Вещество считают растворившимся, если в растворе при наблюдении в проходящем свете не обнаруживаются частицы вещества. Для веществ, образующих при растворении мутные растворы, соответствующее указание должно быть приведено в частной фармакопейной статье. Если указано, что субстанция растворима в жирных маслах, то имеется в виду, что она растворима в любом масле, относящемуся к классу жирных масел.
ПОДЛИННОСТЬ (ИДЕНТИФИКАЦИЯ)
Приводимые в этом разделе испытания не рассчитаны на полное подтверждение химической структуры или состава продукта. Они предназначены для подтверждения с приемлемой степенью достоверности того, что продукт соответствует информации, приведенной на этикетке.
В некоторых частных фармакопейных статьях имеются подразделы «Первая идентификация» и «Вторая идентификация». Обычно используют первую идентификацию. Если имеется гарантия того, что данная серия субстанции была ранее сертифицирована на соответствие всем требованиям частной фармакопейной статьи, испытания из второго подраздела могут использоваться вместо испытаний из первого подраздела.
ИСПЫТАНИЯ И КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ
Область применения. Эти требования не рассчитаны на охват всех возможных примесей. В частности, если примесь не определяется с помощью описанных испытаний, а здравый смысл и надлежащая производственная практика не допускает ее присутствия, не следует делать вывод, что она допустима. См. также ниже раздел «Примеси».
Если в испытаниях с использованием хроматографических методов после указания вводимого или наносимого объема раствора в микролитрах в скобках указывается количество вещества в микрограммах, то имеется в виду приблизительное количество.
Если указано, что испытание проводят «в защищенном от света месте», то это означает, что следует принять меры для избежания попадания прямого солнечного света, любого другого яркого света, а также исключить попадание ультрафиолетового света, например, путем использования посуды из специального стекла, работы в затемненной комнате и т.д.
Расчеты. Если при проведении вычислений требуется выполнить пересчет на сухое вещество или безводное вещество или оговорено какое-либо другое условие, то потерю в массе при высушивании, содержание воды или иной показатель определяют с помощью метода, описанного в частной фармакопейной статье. Слова «сухое вещество» или «безводное вещество» и другие указываются в скобках после результата.
Пределы. Указываемые пределы основываются на результатах, полученных в рамках обычной аналитической практики; в них уже учтены обычные аналитические погрешности, допустимый разброс при производстве и приготовлении, а также ухудшение качества в процессе хранения в пределах, которые считаются приемлемыми. При определении соответствия продукта требованиям частной фармакопейной статьи к указанным пределам не должны добавляться никакие дополнительные допуски.
Результат, полученный в испытании, округляют до указанного в пределе количества значащих цифр (если нет других указаний). При этом последнюю цифру увеличивают на единицу, если цифра, отбрасываемая при округлении, больше или равна пяти. Если цифра, отбрасываемая при округлении, меньше пяти, последнюю цифру оставляют неизменной.
Определение и допустимый предел примесей. Примерное допустимое содержание примеси или суммы примесей может быть указано в скобках только для информации. Если для данной примеси не указано использование стандартного образца, ее содержание может быть выражено исходя из номинальной концентрации вещества, используемого для приготовления указанного в частной Фармакопейной статье раствора сравнения (если нет других указаний).
Лекарственные средства, содержащие лекарственное растительное сырье. Для лекарственного средства, содержащего лекарственное растительное сырье, сульфатная зола, общая зола, растворимые в воде посторонние вещества, растворимые в спирте посторонние вещества, содержание воды, содержание эфирных масел и содержание действующих веществ вычисляют в расчете на лекарственное средство, которое не было специально высушено (если нет других указаний в частной фармакопейной статье).
Эквиваленты (титры). В тех случаях, когда приводится эквивалент, он дается с таким количеством значащих цифр, которое требуется в данной монографии.
ХРАНЕНИЕ
Информация и рекомендации, приводимые в разделе «Хранение», не являются исчерпывающими фармакопейными требованиями, и компетентные уполномоченные органы могут указывать конкретные условия хранения, обязательные для исполнения.
Описанные в Фармакопее продукты следует хранить таким образом, чтобы предотвратить их загрязнение и, по возможности, разложение. Если рекомендуются особые условия хранения, включая тип контейнера (см. выше раздел «Контейнеры») и температурные пределы, эти рекомендации приводятся в монографии.
Ниже разъясняются термины, используемые в частных фармакопейных статьях в разделе «Хранение».
соответствии
с
# «Температура». Продукт должен храниться требованиями, указанными в Табл. 1.4.-2.
«Хранить
температуре 30оС»
или
от
15оС
