
- •12.1. Патофизиология энергетического и основного обменов
- •12.1.1. Нарушения обмена энергии
- •12.1.2. Нарушения основного обмена
- •12.2. Голодание
- •12.2.1. Лечение голоданием
- •12.2.2. Белково-калорийная недостаточность
- •12.4.7. Сахарный диабет
- •12.4.8. Метаболические осложнения сахарного диабета
- •12.5.5. Ожирение и жировая инфильтрация печени
12.4.8. Метаболические осложнения сахарного диабета
Основные патогенетические факторы метаболического повреждения включают следующие процессы:
1. Неферментативное гликозилирование белков - соединение глюкозы со свободными аминогруппами белков - коллагенов, кристаллинов, гемоглобина и др.
2. Ферментативное гликозилирование заключается в повышении скорости превращения глюкозы в сорбитол и маннитол, что приводит к их накоплению в клетках и межклеточном веществе сетчатки, хрусталика, клубочках почек, эндотелиоцитах, шванновских клетках, нейронах.
3. Резкие суточные колебания осмотического давления крови (из-за резкого повышения концентрации глюкозы после приема пищи).
4. Формирование внутриклеточной гиперосмолярности (за счет образования сорбитола).
5. Повреждение свободными радикалами («окислительный стресс»).
Патогенез диабетического кетоацидоза
Ведущие патогенетические звенья диабетического кетоацидоза, учитывающие нарушения всех видов обмена, представлены на интегральной схеме (рис. 12-28).
|
|
Среди важнейших метаболических нарушений при СД выделяются следующие:
1. Нарушения углеводного обмена при отсутствии инсулина (или его действия) характеризуются гипергликемией, глюкозурией и гиперлактатацидемией.
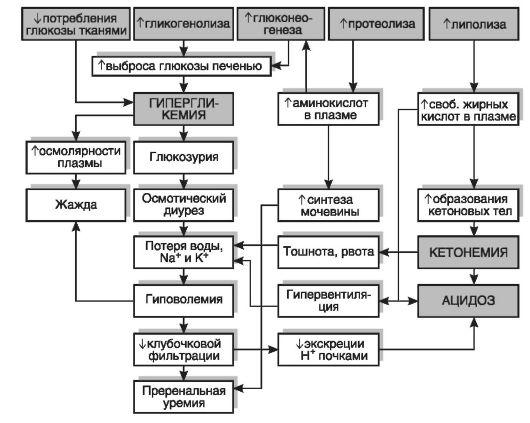 Рис.
12-28. Патогенез
диабетического кетоацидоза. Верхний
ряд показывает основные метаболические
эффекты при недостатке инсулина, которые
вызывают все последующие изменения
Рис.
12-28. Патогенез
диабетического кетоацидоза. Верхний
ряд показывает основные метаболические
эффекты при недостатке инсулина, которые
вызывают все последующие изменения
Гипергликемия обусловлена:
• нарушением поступления глюкозы из крови внутрь клеток;
• компенсаторным ускорением гликогенолиза;
• активацией глюконеогенеза вследствие снятия репрессивного действия инсулина на синтез ключевых ферментов этого метаболического пути;
• усилением секреции глюкокортикоидов, являющихся стимуляторами синтеза ключевых ферментов глюконеогенеза в печени и почках.
Глюкозурия и, как следствие, полиурия развиваются при достижении концентрации глюкозы в крови 9,9 ммоль/л, когда преодолевается почечный порог, и глюкоза появляется в моче.
Гиперлактатацидемия развивается вследствие торможения катаболизма лактата в ЦТК и нарушения ресинтеза пирувата из лактата (см. рис. 12-17).
2. Нарушения липидного обмена при отсутствии инсулина характеризуются усилением липолиза и снижением липогенеза. Дефицит инсулина при сахарном диабете приводит к тому, что:
а) контринсулярные гормоны (глюкагон, адреналин, глюкокортикоиды и др.) стимулируют мобилизацию липидов из жировых депо и доставку жирных кислот к органам, что является адаптивным механизмом, поставляющим альтернативный субстрат окисления в условиях снижения утилизации глюкозы клетками;
б) снижается активность ЛП-липазы адипоцитов, поэтому свободные жирные кислоты не поступают в жировую ткань;
в) начинает преобладать эффект глюкагона, стимулирующий кетогенез в печени и гормончувствительную ТАГ-липазу в адипоцитах;
|
|
г) в норме кетоновые тела стимулируют выход инсулина из поджелудочной железы, что угнетает липолиз и таким образом ограничивает доставку липидов в печень и соответственно кетогенез (при сахарном диабете этот регуляторный механизм нарушен: идет усиленная продукция кетоновых тел печенью благодаря интенсивному β-окислению жирных кислот);
д) при сахарном диабете в избыточном количестве образуется продукт β-окисления жирных кислот - ацетил-КоА, однако способность цикла Кребса утилизировать данный продукт существенно снижена. В результате этого избыток ацетил-КоА становится источником образования больших количеств кетоновых тел: β-оксимасляной, ацетоуксусной кислот и ацетона, что и приводит к кетонемии. Кетоновые тела начинают выделяться с мочой в виде натриевых солей (кетонурия), а ацетон - также и в составе выдыхаемого воздуха.
3. Нарушения белкового обмена при отсутствии инсулина характеризуются преобладанием процессов катаболизма вследствие активации глюконеогенеза из глюкогенных аминокислот и снижения проницаемости клеточных мембран для аминокислот, что приводит к недостатку в тканях свободных аминокислот и нарушению процесса синтеза белка. Стимулируется синтез мочевины, что характеризуется гиперазотемией и приводит к отрицательному азотистому балансу.
4. Нарушения кислотно-щелочного баланса организма развиваются в связи с накоплением кислых продуктов метаболизма в результате переключения аэробных путей утилизации глюкозы на анаэробный гликолиз с повышенной продукцией лактата и усиления ке-
тогенеза. По мере истощения емкости буферных систем организма формируется декомпенсированный метаболический ацидоз.
5. Водно-солевой обмен и дегидратация клеток. Нарушения водного обмена при СД проявляются полиурией (суточный диурез достигает 4-10 л) и полидипсией (до 9 л воды в сутки), обусловленной гипогидратацией организма и гиперосмией крови в связи с гипергликемией, гиперазотемией, кетонемией, гиперлактатацидемией, повышением содержания отдельных ионов. Именно эти явления дали основания для первоначального названия заболевания: diabetes mellitus (лат.) - сахарное мочеизнурение. Повышение осмотического давления крови сопровождается дегидратацией клеток, особенно чувствительны к этому клетки нервной ткани.
|
|
Необходимо особо отметить, что сочетание ацидоза и явлений дегидратации в эритроцитах приводит к снижению в этих клетках концентрации 2,3-дифосфоглицериновой кислоты - аллостерического модулятора функций гемоглобина. В этих условиях сродство гемоглобина к кислороду возрастает, но его способность отдавать кислород тканям уменьшается, вследствие чего гипоксия, вызванная глубокими метаболическими нарушениями при СД, усугубляется.
В результате перечисленных выше нарушений обмена веществ при СД могут развиваться серьезные осложнения, к которым относят комы и диабетические микро- и макроангиопатии (нефропатия, слепота, синдром «диабетической стопы»), вторичные инфекции из-за иммунодефицита.
Диабетическая кома. Критическая дегидратация тканей организма с поражением функций головного мозга ведет к развитию диабетической (гипергликемической) комы. Кома развивается при достижении концентрации глюкозы в крови от 19,4 до 33,3 ммоль/л и более. В этих условиях вследствие кетоацидоза ионы калия выходят во внеклеточное пространство (гиперкалиемия), что лежит в основе нарушения сократительной функции миокарда, а также дыхательной мускулатуры. Диабетическая кома может привести к летальному исходу, если больному не будет своевременно проведена специфическая противокоматозная терапия.
Различают следующие виды диабетической комы:
1. Гипергликемическая кетоацидотическая кома. Развивается чаще всего у больных СД 1 типа вследствие гипергликемии, гиперкетонемии и метаболического ацидоза. Глюкоза и кетоновые тела выводятся с мочой (глюкозурия и кетонурия), что способ-
ствует увеличению осмотического давления в первичной моче, потере ионов Na и сопровождается полиурией. При этом возникает обезвоживание, которое ведет к недостаточности периферического кровообращения и гипоксии тканей. Ацидоз вызывает дыхание Куссмауля, при котором теряется СО2и как следствие усугубляются нарушения водно-электролитного баланса, кислотно-щелочного равновесия, возникает резкое нарушение метаболизма и функций клеток ЦНС, что приводит к расстройству высшей нервной деятельности. К клиническим проявлениям комы относятся: слабость, головная боль, адинамия, диспепсические расстройства (в 30-50% случаев - «абдоминальный синдром» - клиника «острого живота»), дыхание Куссмауля с запахом ацетона в выдыхаемом воздухе, снижение кровяного давления и частый слабый пульс, нарастающая сухость кожи и слизистых оболочек. Затем наступает полная потеря сознания, расслабление мышц, зрачки сужаются, отмечаются характерные признаки энцефалопатии. Содержание глюкозы в крови превышает 22 ммоль/л, кетоновых тел - 17 ммоль/л, повышено содержание остаточного азота, мочевины, холестерина, жирных кислот, уровень натрия чаще нормальный, реже - снижен, уровень калия чаще нормальный, у больных с почечной недостаточностью может быть повышен.
|
|
2. Гипергликемическая гиперосмолярная кома. Встречается реже, чем кетоацидотическая, и развивается у больных СД 2 типа старше 50 лет при дополнительном воздействии обезвоживающих факторов (рвота, понос, ограничение приема жидкости, ожоги, кровопотеря, полиурия, прием диуретиков). Основными звеньями патогенеза этого вида комы являются дегидратация организма и развитие гиперосмолярности плазмы, уровень гликемии может достигать 55 ммоль/л. У больных нет выраженной гиперкетонемии и кетонурии, отсутствует запах ацетона изо рта и, если не обратиться к врачу, нарастает уровень глюкозы в крови до крайне высокой степени, что способствует усилению диуреза (глюкозурический осмотический диурез). Возникающее обезвоживание приводит к гиповолемии, стимуляции секреции альдостерона и задержке ионов Na и Cl. Показатель осмолярности плазмы повышается в 1,5-2 раза (в норме около 300 мосмоль/л, при коме достигает 500 мосмоль/л), что приводит к резко выраженной внутриклеточной дегидратации, нарушению водного и электролитного равновесия в клетках мозга, гипоксии ЦНС с выраженной неврологической симптоматикой и потере сознания.
3. Гипергликемическая кома с лактат-ацидозом (лактацидотическая). Это относительно редкое, но опасное осложнение СД. В механизме ее развития важную роль играют следующие факторы:
а) снижение активности ферментативного пируватдегидрогеназного комплекса (выявляется при дефиците инсулина), превращающего пируват в ацетил-КоА. Пируват в обратимой реакции, катализируемой лактатдегдрогеназой, превращается в молочную кислоту (см. рис. 12-17);
б) применение лекарственных препаратов, стимулирующих анаэробный гликолиз и тем самым повышающих содержание лактата и пирувата в организме (например, бигуаниды, повышающие утилизацию глюкозы за счет ее анаэробного распада). При поражении печени или почек может иметь место кумуляция этих препаратов в организме, в результате чего развиваются лактоацидоз и кома;
|
|
в) гипоксическое состояние (при котором, как правило, стимулируется гликолиз), вызванное физическим переутомлением, сердечной или дыхательной недостаточностью.
Как следствие в крови накапливается молочная кислота (содержание лактата в плазме превышает 5 ммоль/л), что сопровождается развитием коллапса, нарушением сердечной деятельности и функций дыхательного центра (возникает патологическое дыхание Куссмауля), угнетением сознания, нарушением чувствительности, дисфункцией желудочно-кишечного тракта, резко выраженной дегидратацией тканей. Гиперкетонемия и кетонурия отсутствуют, могут выявляться незначительная гипергликемия и небольшая глюкозурия. Вследствие несвоевременной диагностики и трудности лечения прогноз может быть неблагоприятным.
4. Гипогликемическая кома. Связана с передозировкой инсулина, препаратов сульфонилмочевины, развитием вторичного гипопитуитаризма (следствие ангиопатии сосудов гипофиза), ослабляющего ответ на гипогликемию, и явлениями диабетического нефросклероза, что удлиняет время циркуляции инсулина и, кроме того, еще более снижает почечный порог для глюкозы, способствуя ее потере.
Причинами гипогликемии могут быть также гиперпродукция инсулина опухолью поджелудочной железы (инсулиномой), недостаточность контринсулярных гормонов, печеночные формы гликогенозов, заболевания печени, голодание, нарушение расщепления и всасывания углеводов в желудочно-кишечном тракте и др.
В механизме развития гипогликемической комы решающее значение имеет снижение доставки глюкозы к нервным клеткам, что ведет к их энергетическому истощению и нарушению функций ЦНС. При снижении уровня глюкозы менее 3 ммоль/л возникают потливость, тремор, чувство тревоги и голода, слабость. Затем развивается состояние, напоминающее алкогольное опьянение и сопровождающееся дезориентацией, агрессивностью, галлюцинациями. При дальнейшем падении содержания глюкозы (менее 2,5 ммоль/л) возникают клонические судороги и потеря сознания. В тяжелых случаях могут наступать отек и некроз отдельных участков мозга.
|
|
Микро- и макроангиопатии относят к более поздним осложнениям, развивающимся при СД обоих типов.
1. Микроангиопатия. Это осложнение выражается в повреждении сосудов микроциркуляции и развивается вследствие метаболических нарушений в сосудистой стенке (гликозилирование белков) и развития васкулита. Чаще всего поражаются сосуды почек и сетчатки глаза.
Поражение почек - диабетическая нефропатия из-за развития макро- и микроангиопатии в настоящее время является основной причиной ранней смертности у больных диабетом молодого возраста. При этом происходит избыточное гликозилирование коллагена базальных мембран почечных клубочков, приводящее к существенным нарушениям структуры и функций почечного фильтра.
Если в суточной моче концентрация альбумина превышает 30 мг (микроальбуминурия), и эти значения повторяются несколько раз, то необходимо проводить лечение, так как данные изменения характерны для начинающейся диабетической нефропатии. По мере прогрессирования поражения почек при диабете развивается выраженная протеинурия. Тщательный контроль за уровнем глюкозы в крови и лечение любых форм гипертонии могут приостановить микроальбуминурию и предупредить развитие манифестной почечной недостаточности.
Поражение сетчатки глаз при диабете - диабетическая ретинопатия относится к числу одной из наиболее частых причин развивающейся слепоты при этой патологии. Основную роль в патогенезе развития отечно-геморрагических форм диабетической ретинопатии играют максимальные суточные колебания уровня глюкозы в крови. Так, при повышении уровня глюкозы на 5,55
ммоль/л осмолярность сыворотки повышается на 5,5 мосмоль/л, что соответствует увеличению давления на 86 мм рт.ст., поэтому если увеличение концентрации сахара в крови идет быстро (в постабсорбтивном периоде), то в капиллярах сетчатки резко возрастает трансмуральное (разница между давлением внутри и снаружи сосуда) осмотическое давление. Жидкость «вытягивается» из ткани сетчатки в кровь, что ведет к резкому повышению трансмурального гидростатического давления в сосудах сетчатки. Повышение гидростатического давления за счет миогенной ауторегуляции приводит к сужению артериол вплоть до полного перекрытия кровотока (с развитием микроинфарктов сетчатки), а капилляры растягиваются с образованием микроаневризм и развития кровоизлияний.
|
|
Другой причиной, приводящей к потере зрения, является диабетическая катаракта, в патогенезе которой важную роль играет длительно существующая гипергликемия. Она вызывает, с одной стороны, усиление синтеза сорбитола и маннитола (ферментативное гликозилирование) и накопление этих углеводов в хрусталике глаза, приводящее по осмотическому градиенту к увеличению содержания в нем воды. С другой стороны, гликозилирование белков хрусталика и его капсулы (неферментативное) также вызывает необратимые нарушения его структуры.
2. Макроангиопатия. Диабетическая макроангиопатия проявляется атеросклерозом вследствие выраженного нарушения обмена липопротеинов. Особенностями атеросклероза при СД являются большая распространенность (захват многих сосудистых бассейнов), быстрое прогрессирование, начало в более молодом возрасте. Патологический процесс охватывает сосуды головного мозга, сердца, почек, а также сосуды конечностей, в особенности сосуды голени и стопы. Диабет, даже в условиях его лечения современными средствами, характеризуется ускоренными темпами старения организма. Наличием диабета обусловлены высокая частота инфарктов миокарда, инсультов и случаев гангрены пальцев ног или стопы.
В настоящее время считают, что диабет ускоряет развитие атеросклероза в результате:
• дислипопротенемии (см. раздел 12.5.2);
• гиперхолестеринемии (см. раздел 12.5.8);
• эндотелиальной дисфункции, возникающей из-за окислительного стресса, основным фактором которого являются модифицированные ЛПНП;
• активации неспецифического звена системы иммунитета, сопровождающейся выработкой провоспалительных цитокинов;
• эффекта гормона роста вследствие отсутствия противодействия со стороны инсулина в условиях его абсолютного или относительного дефицита, приводящего к усилению процесса пролиферации гладкомышечных клеток;
|
|
• усиленного синтеза тромбоксана А2.
Диабетическая нейропатия - нарушение функции нервов - развивается вследствие ангиопатии из-за нарушения кровоснабжения нервов, гликозилирования белков нейронов и миелиновых оболочек, гиперосмолярного поражения шванновских клеток (проявление гиперосмотической дегидратации при СД). Эти нарушения способны вызывать дисфункции любой системы организма, имитируя многочисленные неврологические заболевания. В патологический процесс могут быть вовлечены как чувствительные, так и двигательные или вегетативные нервные волокна. В качестве типичных примеров клинического проявления диабетических нейропатий можно назвать образование трофических язв на стопах - «диабетическую стопу», различные расстройства функций желудочно-кишечного тракта, мочевого пузыря, импотенцию. При исследовании структуры нервных волокон диабетиков с помощью световой микроскопии часто выявляются их демиелинизация, истончение и склероз эпиневрия, отек и дистрофии нервных волокон, глиальная клеточная реакция.
Патогенез диабетических нейропатий полностью не раскрыт, однако в настоящее время можно назвать ряд факторов, безусловно определяющих развитие этого осложнения диабета:
1) нарушение структуры миелина, когда патологический процесс обусловливает изменение как химической структуры, так и количественного соотношения между основными биохимическими компонентами (холестерин, ТАГ, фосфолипиды, гликолипиды и белки) миелина нервных волокон. Клинические наблюдения свидетельствуют о том, что под влиянием заместительной терапии инсулином происходит существенная коррекция многих из указанных сдвигов;
2) сорбитоловый путь окисления глюкозы - в результате данного процесса происходит ферментативное окисление глюкозы с образованием сначала сорбитола, а затем фруктозы, повышенное количество которых приводит к гиперосмотической дегидратации нейронов;
|
|
3) токсическое действие пирувата.
Следует отметить, что общая черта всех вышеперечисленных нарушений, по крайней мере до развития глубоких морфологических изменений, - их обратимость под влиянием терапии, приводящей к снижению гипергликемии.
+++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++
|
|
Нарушения углеводного обмена
При нарушении углеводного обмена могут развиваться состояния гипергликемии (концентрация глюкозы в крови более
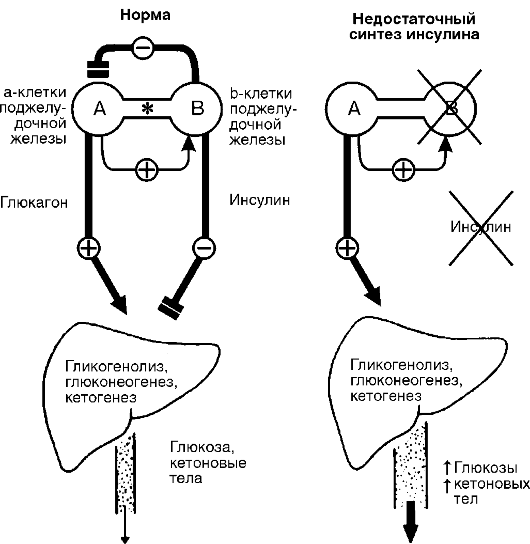 Рис.
12-21. Эффекты
инсулина и глюкагона в норме и при
инсулиновой недостаточности. В норме
печень образует примерно 10 г/ч глюкозы,
из них 65-75% в результате действия глюкагона
на гликогенолиз, глюконеогенез. Инсулин
может угнетать секрецию глюкагона
α-клетками независимо от уровня глюкозы
в крови. В печени инсулин угнетает
образование глюкозы и кетоновых тел.
При уменьшении отношения инсулин/глюка-
гон увеличивается образование глюкозы
и кетоновых тел в печени
Рис.
12-21. Эффекты
инсулина и глюкагона в норме и при
инсулиновой недостаточности. В норме
печень образует примерно 10 г/ч глюкозы,
из них 65-75% в результате действия глюкагона
на гликогенолиз, глюконеогенез. Инсулин
может угнетать секрецию глюкагона
α-клетками независимо от уровня глюкозы
в крови. В печени инсулин угнетает
образование глюкозы и кетоновых тел.
При уменьшении отношения инсулин/глюка-
гон увеличивается образование глюкозы
и кетоновых тел в печени
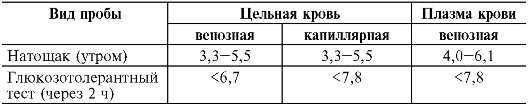
5,5 ммоль/л) и гипогликемии (менее 3,3 ммоль/л). Уровень глюкозы в крови зависит от вида пробы (цельная кровь, венозная или капиллярная, плазма) и от режима взятия пробы (натощак - уровень глюкозы утром после не менее чем 8-часового голодания; через 2 ч после глюкозотолерантного теста) (табл. 12-3). В клинике выделяют еще один показатель уровня глюкозы в крови - постпрандиальная гликемия - это уровень глюкозы через 2 ч после обычного приема пищи (не более 7,5 ммоль/л).
|
|
Таблица 12-3. Концентрация глюкозы в крови в норме (ммоль/л)
 Патогенез
гипогликемий
может быть
связан с недостаточным поступлением
глюкозы в кровь, ускоренным выведением
ее из крови либо комбинацией этих
факторов. Различают физиологическую и
патологическую гипогликемию.
Патогенез
гипогликемий
может быть
связан с недостаточным поступлением
глюкозы в кровь, ускоренным выведением
ее из крови либо комбинацией этих
факторов. Различают физиологическую и
патологическую гипогликемию.
Физиологическая гипогликемия. Выявляется при тяжелой и длительной физической нагрузке; длительном умственном напряжении; у женщин в период лактации; развивается сразу вслед за алиментарной гипергликемией благодаря компенсаторному выбросу в кровь инсулина.
Патологическая гипогликемия (гиперинсулинизм). Чаще возникает у больных сахарным диабетом в связи с передозировкой инсулина при лечении. Причиной ее могут быть также: аденома островковых клеток поджелудочной железы (инсулома); синдром Золлингера- Эллисона (аденома или карцинома поджелудочной железы, которая, по-видимому, развивается из α-клеток островков Лангерганса, ответственных за выделение глюкагона и гастрина).
Патологическая гипогликемия (без гиперинсулинизма). Выявляется: при патологии почек, сопровождающейся снижением порога для глюкозы, что приводит к потере глюкозы с мочой; нарушении всасывания углеводов; заболеваниях печени, сопровождающихся торможением синтеза гликогена и глюконеогенеза (острые и хронические гепатиты); недостаточности надпочечников (дефицит глюкокортикоидов); гипоавитаминозе В1, галактоземиях и при печеночных формах гликогенозов; голодании или недостаточном питании (алиментарная гипогликемия); недостаточности механизмов регуляции углеводного обмена у новорожденных.
Гипергликемия у человека встречается чаще, чем гипогликемия. Различают следующие типы гипергликемий.
Физиологические гипергликемии. Это быстрообратимые состояния. Нормализация уровня глюкозы в крови происходит без каких-либо внешних корригирующих воздействий. К ним относятся:
|
|
1. Алиментарная гипергликемия. Обусловлена приемом пищи, содержащей углеводы. Концентрация глюкозы в крови нарастает вследствие ее быстрого всасывания из кишечника. Активация секреции гормона β-клетками островков Лангерганса поджелудочной железы начинается рефлекторно, сразу после попадания пищи в полость рта и достигает максимума при продвижении пищи в двенадцатиперстную кишку и тонкий кишечник. Пики концентраций инсулина и глюкозы в крови совпадают по времени. Таким образом, инсулин не только обеспечивает доступность углеводов пищи к клеткам организма, но и ограничивает повышение концентрации глюкозы в крови, не допуская потерю ее с мочой.
2. Нейрогенная гипергликемия. Развивается в ответ на эмоциональный стресс и обусловлена выбросом в кровь большого количества катехоламинов, образующихся в мозговом веществе надпочечников и реализующих свои гипергликемические эффекты (см. табл. 12-2). Освобождающаяся глюкоза быстро выходит в кровь, обусловливая гипергликемию. Физиологический смысл этого феномена состоит в обеспечении срочной мобилизации резерва углеводов для использования их в качестве источников энергии (окисления) в предстоящей повышенной двигательной активности в условиях стресса.
Патологические гипергликемии. Причинами их развития являются:
1) нейроэндокринные расстройства, когда нарушены соотношения уровня гормонов гипо- и гипергликемического действия. Например, при заболеваниях гипофиза, опухолях коры надпочечников, при феохромоцитоме, гиперфункции щитовидной железы; при недостаточной продукции инсулина, глюкагономе;
2) органические поражения центральной нервной системы, расстройства мозгового кровообращения различной этиологии;
3) нарушения функций печени при циррозе;
4) судорожные состояния, когда происходит расщепление гликогена мышц и образование лактата, из которого в печени синтезируется глюкоза;
|
|
5) действие наркотических веществ (морфин, эфир), возбуждающих симпатическую нервную систему и тем самым способствующих развитию гипергликемии.
Наиболее часто встречается гипергликемия при недостаточности инсулина и (или) его действия, которая лежит в основе сахарного диабета.
Диагностика нарушений углеводного обмена методом нагрузок
Исследование состояния углеводного обмена с диагностической целью в клинике начинают с определения натощак содержания глюкозы в крови и анализа мочи на присутствие в ней глюкозы и кетоновых тел. Если результаты анализов свидетельствуют о наличии гипергликемии, глюкозурии и кетонурии, то этого оказывается достаточно для подтверждения диагноза сахарного диабета. Доказано, что ни одно из других заболеваний внутренних органов не дает всей триады: гипергликемии, глюкозо- и кетонурии. Лишь при сахарном диабете имеют место существенные нарушения не только углеводного, но и жирового обмена.
Для углубленного исследования состояния углеводного обмена используют методы «сахарных» нагрузок.
Проба с однократной сахарной нагрузкой для получения гликемической («сахарной») кривой. У обследуемого утром натощак берут кровь из пальца для определения концентрации глюкозы, после чего дают сахарную нагрузку: прием внутрь 100 г глюкозы, растворенной в 200 мл кипяченой воды. Время, в течение которого раствор следует выпить, не должно превышать 5 мин. Повторные заборы проб крови из пальца ведут с интервалом в 30 или 60 мин. Длительность пробы (у взрослых) составляет 3 ч. На основании полученных данных строят кривую, откладывая по оси ординат концентрацию глюкозы, а по оси абсцисс - время. Типы гликемических кривых, присущих норме или сахарному диабету, представлены на рис. 12-22.
|
|
Для гликемической кривой у здоровых субъектов характерны следующие признаки. Уже через 15 мин после приема раствора
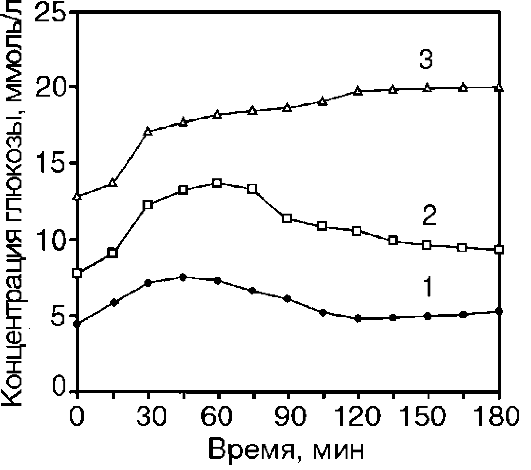 Рис.
12-22. Типы
гликемических кривых в норме и в
состояниях, характеризующихся пониженной
толерантностью к глюкозе: 1 - норма; 2 -
латентный сахарный диабет (легкая форма
заболевания); 3 - тяжелая форма сахарного
диабета
Рис.
12-22. Типы
гликемических кривых в норме и в
состояниях, характеризующихся пониженной
толерантностью к глюкозе: 1 - норма; 2 -
латентный сахарный диабет (легкая форма
заболевания); 3 - тяжелая форма сахарного
диабета
глюкозы внутрь в крови начинает расти концентрация глюкозы, достигая максимума к концу первого часа (в промежутке от 30-й до 60-й мин). При этом концентрация глюкозы превышает таковую натощак на 50-75%. Далее концентрация глюкозы в крови начинает снижаться, и к окончанию второго часа наблюдения она либо достигает исходного уровня (натощак), либо падает ниже исходного уровня (вариант физиологической гипогликемии), либо остается несколько повышенной, но не превышает 6,6 ммоль/л. К третьему часу во всех трех возможных вариантах концентрация глюкозы в крови не отличается от исходного значения (натощак).
У больных сахарным диабетом концентрация глюкозы натощак повышена, а нарастание гликемической кривой после сахарной нагрузки происходит медленнее. Максимальное значение показателя регистрируют только через 60-150 мин от начала наблюдения, при этом концентрация глюкозы может в 1,8 раза превышать ее исходное значение. Спад концентрации глюкозы крови (гипогликемическая фаза) также происходит чрезвычайно медленно (вплоть до отсутствия такового), что коррелирует со степенью тяжести заболевания. Если же понижение концентрации глюкозы все же происходит, то оно растягивается на 3-4 ч.
Тест толерантности к глюкозе (ГТТ). Кровь для проведения теста также берут из пальца дважды: натощак и спустя 120 мин после нагрузки глюкозой. Согласно критериям ВОЗ, у практически здорового человека концентрация глюкозы в крови натощак не должна превышать 5,5 ммоль/л. Спустя 120 мин после стандартной нагрузки глюкозой (одномоментный прием внутрь 75 г глюкозы в 300 мл воды) уровень глюкозы не должен превышать 6,7 ммоль/л. В случае если концентрация глюкозы в крови натощак превышает 6,1 ммоль/л, а тест свидетельствует о том, что спустя 120 мин уровень глюкозы остается выше 7,8 ммоль/л, то это веский аргумент в пользу если не диабета, то преддиабетического состояния у обследуемого.
++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++
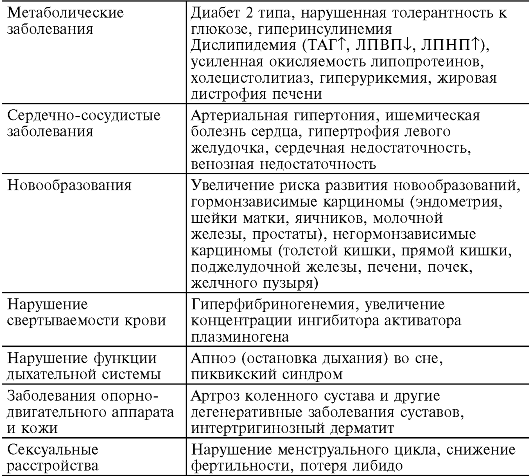
Ожирение - избыточное отложение жира в жировой ткани. Ожирение значительно повышает риск развития артериальной гипертонии, сахарного диабета 2 типа, атеросклероза, поэтому очень важно следить за своим весом. Считается, что человек страдает ожирением, если его масса превышает нормальную более чем на 20% и продолжает увеличиваться далее. Этим недугом страдает более трети взрослого населения России. В 1998 г. Всемирная организация здравоохранения (ВОЗ) признала ожирение хроническим заболеванием. По статистике ВОЗ, в экономически развитых странах около 30% взрослых и до 10% детей имеют ту или иную форму и степень ожирения. В возрастных группах после 50 лет это заболевание встречается чаще. За последнее десятилетие число таких больных в мире увеличилось почти в два раза и по оценке специалистов в 2025 г. их количество составит 300 млн человек. Ситуация тем более сложная, что с каждым годом увеличивается число молодых людей, страдающих ожирением, снижается общая продолжительность жизни населения земного шара в связи с тяжелыми заболеваниями, сопутствующими ожирению (см. табл. 12-5).
У тучных людей старше 50 лет смертность увеличивается на 50% по сравнению с лицами, не имеющими ожирения. У женщин с ожирением чаще встречаются рак эндометрия, яичника, шейки матки, желчного пузыря и молочной железы, у мужчин - рак предстательной железы и толстой кишки, снижение потенции. Жировая ткань, составляющая в норме 15-20% от массы тела у мужчин и 20-29% у женщин, - это метаболически активное образование.
Таблица 12-5. Заболевания, сопутствующие ожирению (по С. Бутровой,
2001;
Адипоциты секретируют гемопоэтины; выделяют цитокины - TNF-α, IL-6, трансформирующий фактор роста (TGF) β и соответствующие им растворимые рецепторы; синтезируют биоактивные вещества - ангиотензиноген, ингибитор активатора плазминогена; ряд ферментов (липопротеиновая липаза, индуцируемая NO-синтаза, аполипопротеин Е) и гормонов (лептин, резистин, адипонектин, эстрогены); выделяют свободные жирные кислоты. Увеличение массы жировой ткани влечет за собой повышение содержания лептина в крови, причем его продукция в подкожной жировой клетчатке выше, чем в висцеральных жировых депо. Уровень лептина отражает не только количество накопленного жира, но и нарушения энергетического обмена: при голодании он значи-
|
|
тельно снижается, при переедании - повышается. Избыток лептина вызывает инсулинорезистентность скелетных мышц и жировой ткани и подавляет действие инсулина на клетки печени (инсулин активирует адипоциты, повышая образование лептина, в свою очередь, лептин, воздействуя на собственные рецепторы, локализованные на поверхности β-клеток, тормозит секрецию инсулина).
У женщин наличие достаточно выраженной жировой ткани существенно для поддержания нормальной половой функции. Менструации у девочек, не достигших критической массы (около 48 кг), не начинаются, даже если пубертатный период пройден. При похудении на 10-15% нормы даже при сохранении цикла нет овуляции, возможна и полная аменорея. Эти изменения обратимы, при нормализации веса детородная функция восстанавливается. Вероятно, невозможность деторождения у женщин, не имеющих достаточных жировых запасов для успешного рождения и вскармливания ребенка, была выработана в процессе естественного отбора. У мужчин похудение и физические нагрузки приводят к уменьшению полового влечения, а если вес тела на 25% ниже нормы, выработка спермы угнетается. Следует отметить, что сильное развитие мускулатуры (например, у культуристов) действует на репродуктивные процессы так же, как и похудение. Избыток эстрогенов у полных мужчин приводит к снижению потенции, гинекомастии, гипогонадизму с понижением уровня тестостерона.
Классификация ожирения. Ожирение может возникать как самостоятельное заболевание - в этом случае говорят о первичном ожирении. Вторичное ожирение - это синдром, возникающий вследствие гормональных или других расстройств в организме.
Первичное ожирение возникает при нарушении гормональной связи между жировой тканью и гипоталамусом. Это генетически опосредованное нейроэндокринное заболевание, его главная черта - абсолютная или относительная лептиновая недостаточность. Около 20% больных имеют абсолютную лептиновую недостаточность, однако дефицит лептина1не является основной причиной развития ожирения. Более 80% пациентов с первичным ожирени-
|
|
1 Генетически опосредованный дефицит лептина проявляется ранним ожирением, пониженным обменом веществ, гипогонадотропным гипогонадизмом, гиперинсулинемией, нарушением гипоталамо-питуитарных и тиреоидальных взаимодействий и нарушением количества и функции Т-лимфоцитов, что повышает восприимчивость больных к инфекциям. Известны 5 отдельных мутаций в гене лептина, вызывающих развитие первичного ожирения.
ем имеют выраженную гиперлептинемию, что свидетельствует о резистентности к гормону. Известны следующие механизмы резистентности:
• нарушение транспорта лептина через гематоэнцефалический барьер (введение гормона даже в больших дозах не дает результата);
• нарушение переноса гормона транспортными белками;
• мутации рецептора лептина1 (несмотря на продукцию лептина, центр голода продолжает секрецию нейропептида Y);
• мутации генов, кодирующих рецепторы к меланокортину2 (4% всех больных с ожирением). Следует отметить, что на фоне введения лептина у млекопитающих снижается только масса жировой ткани, в то время как при голодании снижается также масса других тканей.
Вторичное ожирение - синдром, возникающий при нарушении соотношения между процессами липолиза и липогенеза, носит симптоматический характер и порождается различными расстройствами (эндокринопатии, опухоли мозга, нарушения мозгового кровообращения и пр.).
По степени увеличения массы тела различают ожирение I степени (масса тела увеличена на 30%); II степени (на 30-50%); III степени (более чем на 50%).
Одним из наиболее распространенных показателей для оценки степени ожирения является индекс массы тела (ИМТ), рассчитываемый следующим образом:
ИМТ= Вес (кг) / [Рост (м)]2.
Больные с ИМТ 30 кг/м2 и более, а также пациенты с ИМТ 27 кг/м2или более, ожирение которых связано с такими факторами риска, как диабет 2 типа или дислипопротеинемия, подлежат обязательному лечению (табл. 12-6).
|
|
1 Дети с дефектом рецептора лептина быстро набирают избыточную массу в течение первых месяцев жизни, отличаются гиперфагией и агрессивным поведением во время еды. Иногда дефект рецептора имеет более выраженные проявления (гипотиреоз), чем отсутствие лиганда.
2 Меланокортины (адренокортикотропный и меланоцитостимулирующий гормоны, а также и их фрагменты) образуются в гипофизе из проопиомеланокортина. Лептин стимулирует экспрессию гена проопиомеланокортина, образующийся проопиомеланокортин расщепляется до субстрата, который действует как супрессор пищевого поведения, возможно через MC4R. При снижении гипоталамического меланокортинэргетического сигнала через рецепторы MC4R наблюдаются гиперфагия и прибавка массы.
Таблица 12-6. Классификация избыточной массы у взрослых в зависимости от индекса массы тела (в соответствии с докладом ВОЗ 1998 г.)

Наиболее простым методом определения склонности к ожирению является измерение окружности талии. В идеале окружность талии не должна превышать 94 см у мужчин и 80 см у женщин. Если окружность талии у мужчин достигает 102 см, а у женщин - 88 см, возникает серьезная угроза увеличения риска заболевания.
По особенностям морфологии жировой ткани выделяют гипертрофическое и гиперпластическое ожирение.
Гипертрофическое ожирение связано с увеличением размеров адипоцитов (это лабильный фактор, зависимый от питания), чаще встречается в зрелом возрасте. При этом виде ожирения масса тела может увеличиваться в 3-3,3 раза.
Гиперпластическое ожирение сопровождается увеличением количества адипоцитов. Начинается, как правило, в детском возрасте, так как дифференцировка фибробластических клеток-предшественниц в новые адипоциты во взрослом организме - явление довольно редкое (это происходит в период внутриутробного развития и в раннем грудном возрасте). В развитии гиперпластического ожирения огромное значение имеет наследственность, определяющая пролиферативные возможности этих клеток. Избыток массы тела при гиперпластическом ожирении может достигать гигантских величин (до 1000%). Следует отметить, что в подростковый и предклимактерический периоды повышается пролиферативная активность преадипоцитов. Кроме того, их деление индуцируют избыточная калорийность пищи, сахарный диабет или переедание у беременных. В этих случаях гиперпластическое ожирение развивается у взрослых.
|
|
Жир может располагаться в подкожно-жировой клетчатке (подкожный жир) и вокруг внутренних органов (висцеральный жир), вместе подкожно-жировая клетчатка в области живота и висцеральный жир брюшной полости составляют абдоминальный жир. Разная локализация жировых отложений при различных формах первичного и вторичного ожирения зависит от влияния мужских и женских половых гормонов на распределение и катехоламиновых рецепторов в разных отсеках жировой ткани. Жировая ткань, локализованная в различных частях тела, отличается по своей гормональной функции (см. раздел 12.4). У людей, склонных к первичному ожирению, уменьшена экспрессия β-адренорецепторов на адипоцитах.
В зависимости от характера распределения жировой ткани различают:
• андроидный (яблочный) тип
ожирения, когда избыточные отложения жира располагаются на животе и верхней части туловища (наиболее характерен для мужчин) (рис. 12-34);
• гиноидный (грушевидный) тип ожирения, когда избыточные отложения жира располагаются на бедрах, ягодицах и в нижней части туловища (наиболее характерен для женщин);
• смешанный тип ожирения - комбинирует признаки андроидного и гиноидного типов.
Гиноидное ожирение чаще носит гиперпластический характер, поэтому оно более резистентно к диетотерапии. Однако более патогенным считается андроидное, а более благоприятными - гиноидное, смешанное.
Отложение жировой клетчатки в абдоминальной области (яблочный или верхний тип ожирения) больше связано с заболеваемо-
стью и смертностью, чем гиноидный или нижний тип ожирения, и даже больше, чем степень ожирения. Большое количество абдоминального жира способствует развитию дислипидемии, сахарного диабета, сердечно-сосудистых заболеваний, у женщин - возникновению саркомы. Эта зависимость не связана с общим содержанием жира в организме. При одинаковом ИМТ абдоминальное ожирение имеет более высокий риск развития сопутствующих заболеваний, чем ожирение по нижнему типу, что увеличивает смертность у людей.
|
|
|
|
По этиологии ожирение классифицируют на экзогенно-конституциональное, гипоталамическое, гормональное (эндокринное).
Экзогенно-конституциональное ожирение (часто, но не всегда относится к первичной форме ожирения). Нарушение пищевого поведения (например, синдром ночной еды, повышенное потребление пищи в ответ на стресс) приводит к отложению избытка жира в организме в соответствии с формулой:
Отложение жира = Поступление энергии - Расход энергии.
Длительное повышение активности «пищевого центра» ведет к повышению аппетита (гиперфагии) и ожирению (рис. 12-35). Привычка переедать может быть приобретена в детстве. Так, установлено, что избыточное кормление ребенка первого года жизниспособствует развитию гиперпластического ожирения, характеризующегося увеличением объема жировых клеток.
Гипоталамическое ожирение. Является следствием поражения области гипоталамуса. Причиной могут быть перенесенные травмы головного мозга, стойкая внутричерепная гипертензия, опухоли мозга, менингит, а также врожденные дегенеративные изменения гипоталамической области (например, синдром Фрелиха) (рис. 12-36).
Гормональное ожирение. Связано как с гипо-, так и с гиперфункцией желез внутренней секреции и развивается при гипотиреозе, гипофункции половых желез, а также при гиперинсулинизме и гиперкортицизме. В крови таких больных повышается содержание ЛПНП и ЛПОНП, НЭЖК. При гормональном ожирении рано развивается гипертриацилглицеролемия и несколько позже - гиперхолестеринемия. Нарушению обмена липидов сопутствует изменение углеводного обмена: развивается гипергликемия, стимулирующая секрецию инсулина и его предшественника. В свою очередь, секрецию проинсулина и инсулина стимулируют НЭЖК, ЛПОНП, ЛПНП. Усиленный выброс глюкокортикоидов, стимулирующих глюконеогенез, также повышает уровень инсулина в крови.
|
|
По патогенезу различают алиментарное, метаболическое и энергетическое ожирение.
Алиментарное ожирение - развивается при чрезмерном потреблении пищи, что может быть обусловлено:
а) нарушением деятельности гипоталамического пищевого центра (абсолютная или относительная лептиновая недостаточность, длительное возбуждение вентролатеральных ядер в результате травм, кровоизлияний, воспаления в диэнцефальной области (по этиологии это экзогенно-конституциональное или гипоталамическое ожирение);
б) афферентной импульсацией при частом возбуждении вкусовых рецепторов;
в) переходом от активного к малоподвижному образу жизни. При этом в некоторых случаях сохраняется высокий уровень возбудимости пищевого центра (характерный для лиц физического труда или спортсменов), что приводит к систематическому перееданию;
г) чрезмерным растяжением стенок желудка при его переполнении. Это снижает чувствительность нервных окончаний слизистой оболочки, и тормозящие импульсы передаются в пищевой центр только при очень большом скоплении пищи в желудке. В результате переедание становится постоянным и возникает ожирение;
д) пожилым возрастом, что объясняется несоответствием между прежним уровнем возбудимости центра голода и меньшими энергозатратами (после 25 лет основной обмен снижается в каждые последующие 10 лет примерно на 7,5%). Интересно отметить, что в глубокой старости часто развивается исхудание, поскольку угнетается активность пищевого центра и снижается переход углеводов в жиры.
Метаболическое ожирение обусловлено повышенным синтезом жира из углеводов. В обычных условиях до 30% поступающей в организм глюкозы под действием инсулина превращается в жир. При гиперфункции инсулярного аппарата этот процент возрастает. Аналогичное изменение метаболизма развивается при повышенной продукции пролактина (гормона передней доли гипофиза), глюкокортикоидов (по этиологии это гормональное ожирение).
|
|
Энергетическое ожирение обусловлено недостаточным использованием жиров в качестве источника энергии. Развивается при гиподинамии в сочетании с хорошим аппетитом, при снижении тонуса симпатической нервной системы и недостаточной продукции жиромобилизующих гормонов (СТГ, тиреоидные гормоны, катехоламины), поскольку задерживается выход жира из депо и использование его в качестве энергетического субстрата (по этиологии соответствует экзогенно-конституциональному или гормональному ожирению).
Последствия ожирения. При ожирении постепенно изменяется белковый обмен, который характеризуется снижением уровня общего белка крови преимущественно за счет уменьшения концентрации альбуминов, увеличением содержания фибриногена, продуктов деградации фибрина, снижением уровня гепарина. Следствием этого является нарушение транспорта НЭЖК и других липидов, снижение фибринолитической активности и повышение тромбогенных свойств крови, возникновение тромбоэмболических осложнений. Эти изменения являются факторами риска атеросклероза, ишемической болезни сердца, инсульта, гипертонической болезни. Возникают нарушения функций ЦНС: отмечаются утомляемость, сонливость, ухудшение памяти; развивается преждевременное старение, возникают изменения во внутренних
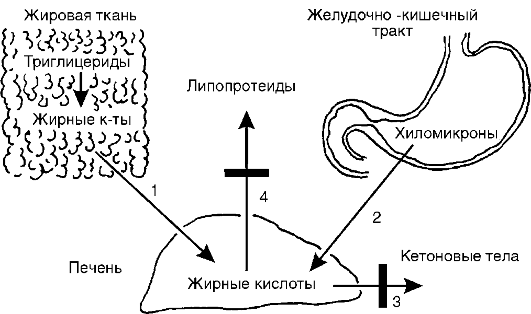 Рис.
12-37.
Рис.
12-37.
Причины жировой инфильтрации печени: 1 - усиленный выход неэтерифицированных жирных кислот из жировой ткани; 2 - интенсивное длительное поступление хиломикронов из кишечника в кровь, а затем в печень; 3 - задержка окисления жирных кислот в печени до кетоновых тел; 4 - задержка выхода из печени пре-β- и β-липопротеинов. Затемненные прямоугольники - места нарушения процесса
органах, например жировая инфильтрация (ожирение или жировая трансформация) печени (рис. 12-37).
|
|
При первичном ожирении многие из расстройств метаболизма после нормализации веса корректируются (уменьшается или совсем проходит инсулинорезистентность, гипер- и дислипопротеинемия). Тем не менее у больного сохраняется лептиновая недостаточность, повышена активность липопротеиновой липазы жировой ткани, снижена реакция центров насыщения на серотонин, а адипоцитов - на β-адреномиметики, нарушена рецепция инсулина в гипоталамусе, а при гиперпластическом и смешанном ожирении увеличено число адипоцитов и т.д.
При быстрой нормализации веса снижается продукция тиреотропина, ухудшается холодовая адаптация. При дальнейшем падении массы тела еще больше снижается основной обмен. Отмечается тенденция к лейкопении, брадикардии и гипотонии, снижается иммунитет. У женщин возможно нарушение овариально-менструального цикла, которое связано со снижением эстрогенпродуцирующей функции адипоцитов. Многие похудевшие пациенты испытывают дисфорию, отмечаются обсессивные неврозы в связи с понижением выработки опиатных пептидов. Не-
которые психосоматические особенности похудевших пациентов с первичным ожирением напоминают таковые при психогенной анорексии. При голодании, диетах отмечается недостаток выделения серотонина, норадреналина, β-эндорфина и других биологически активных веществ в кровь. Снижение уровня серотонина субъективно воспринимается организмом человека как состояние депрессии, уменьшение концентрации норадреналина - упадка сил, β-эндорфина - неудовольствия, дискомфорта. Напротив, выделение норадреналина после еды вызывает чувство прилива сил, энергии, увеличивает уровень основного обмена. У людей с нарушениями центральной серотонинергической системы особенно сильны негативные реакции на голод, выражающиеся в снижении продукции серотонина. Даже при незначительном голодании у них развивается выраженная депрессия.
|
|
Адекватное лечение больного ожирением возможно лишь под наблюдением врача и не должно быть только симптоматическим, т. е. сводиться к диетотерапии и лечебной гимнастике. После открытия лептина большие надежды связывали с его применением для лечения лептиновой недостаточности при первичном ожирении.
