
- •Лу́жні мета́ли — елементи головної підгрупи першої групи періодичної системи. Назва пов'язана з
- •Комплексонометрія (трілонометрія) - титриметричний метод, заснований на реакціях утворення
- •Завдання 2
- •Завдання 2
- •Завдання 2
- •Завдання 2
- •Завдання 2
- •Максимальне значення валентності елемента збігається з номером групи періодичної системи, у якій він
- •Завдання 2
- •Завдання 2
- •Завдання 2
- •Завдання 2
- •Завдання2
Завдання 2
-
У групах із зростанням порядкового номера металічні властивості елементів посилюються, а неметалічні послаблюються.
У кожному періоді зі зростанням порядкового номера елементів металеві властивості поступово слабшають і зростають неметалеві, закінчується період інертним газом
Порядковий номер елемента в періодичній системі (протонне число) дорівнює заряду ядра і показує кількість електронів у атомі.
-
Ступінь дисоціації або коефіцієнт дисоціації - доля дисоційованих молекул в електроліті.
Позначається зазвичай α і є безрозмірною величиною.
Ступінь
дисоціації залежить від концентрації.
Для слабих електролітів, у яких можна
знехтувати взаємодією йонів між собою,
справедливий закон розведення Освальда:
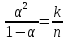 ,
,
де n - концентрація молекул, які дисоціюють, K - певний параметр, який залежить від тиску й температури.
Силу електролітів можна охарактеризувати за допомогою ступеня дисоціації.
Ступінь дисоціації електроліту-це частка від ділення числа продіссоціірованних молекул до загального числа молекул електроліту, введеного в розчин.
-
Сполуки бору в природі.
Оксид бору, або борний ангідрид B2O3 можна добути або безпосереднім сполученням бору з киснем, або прожарюванням борної кислоти.
В2О3+3Н2О→2Н3ВО3+76,5 к Дж.
Сп. одержання борної кислоти.
1.В промисловості з мінералу ашариту (борвмісний матеріал)
В2О3.2MgO.H2O+2H2SO4 H3BO3+MgSO4
2.В медицині борну кислоту одержують з бури дією на неї гарячим розчином соляної кислоти.
Очистку борної кислоти проводять методом перекристалізації з води.
В-9
Завдання 1
-
Катіони ІІІ групи – іони заліза, алюмінію, хрому, нікелю, кобальту, цинку, марганцю. Сульфіди і гідроксиди катіонів цієї групи не розчиняються у воді, але розчиняються в розведених кислотах. Розчин сульфіду амонію є груповим реактивом, при дії якого на нейтральний або слабко лужний розчин осаджуються сульфіди NiS, CoS, FeS, Fe2S3, MnS, ZnS і гідроксиди Cr(OH)3, Al(OH)3.
Катіони ІV групи – іони срібла, ртуті, свинцю, міді, вісмуту й кадмію. Сульфіди цих металів не розчиняються у воді і в розведеній соляній кислоті. Сірководень є груповим реактивом, який осаджує всі названі катіони з кислого розчину у вигляді сульфідів. Іони срібла і ртуті (І) і свинцю становлять окрему підгрупу ІV групи. Хлориди цих металів не розчинаються у воді.
Завдання 2
-
Максимальне значення валентності елемента збігається з номером групи періодичної системи, у якій він
розміщений. Проте трапляються і винятки - Нітроген, Оксиген, Флуор, Купрум тощо. Номер групи позначено римською цифрою над відповідним вертикальним стовпчиком періодичної системи.
Група періодичної системи — хімічні елементи, розташовані в одному стовпці періодичної системи елементів і характеризуються подібністю хімічних власивостей завдяки спільним рисам у електронній конфігурації атомів.
Існує 18 груп, які IUPAC з 1989 року рекомендує номерувати арабськими цифрами: група 1, група 2 тощо. Така нумерація була запропонована для того, щоб уникнути плутанини попередніх систем. В цих системах групи нумерувалися римськими цифрами, але ця нуменрація була різною в Європі і США.
-
Константа дисоціації — специфічний тип константи рівноваги, що описує схильність хімічного об'єкта оборотно
розпадатися на компоненти, наприклад, дисоціації комплексу на окремі молекули в його складі або розпаду солі на іони. Константа дисоціації позначається Kd і є зворотною величиною до константи спорідненості.
При ступінчастій дисоціації речовин розпад по наступному рівні завжди відбувається в меншому ступені, ніж за попередній. Дотримується нерівність: К1> К2> К3 ...
Це пояснюється тим, що енергія, яку потрібно затратити для відриву іона, мінімальна при відриві його від нейтральної молекули і стає більше при дисоціації за кожної наступної ступені.
-
АЛЮМІНІЮ СПОЛУКИ- хімічні сполуки, до складу яких входить алюміній, переважно в ступені окислення +3. А. с.- безбарвні або білі тверді речовини кристалічної будови. Алюмінію оксид (глинозем, корунд) А12O3 - тугоплавкий (tпл 2050°С) порошок, нерозчинний у воді, хімічно дуже стійкий. При сплавленні з лугами або з оксидами металів утворює алюмінати. Застосовують для одержання алюмінію, виготовлення вогнетривів, абразивів, каталізаторів, сорбентів тощо. Фторид алюмінію АlF3 малолеткий, tпл1040°С, погано розчинний у воді, к-тах, лугах. Безводні хлорид, бромід, йодид алюмінію леткі [АlСl3 сублімується (див. Сублімація) при 180,5°С, АlBr3 плавиться при т-рі 98° С, А1I3 - при 188°С], гігроскопічні, димлять на повітрі внаслідок гідролізу, розчинні у воді й багатьох органічних розчинниках, легко утворюють координаційні сполуки з відповідними галогенідами металів. Хлорид алюмінію застосовують як каталізатор в органічному синтезі. Солі алюмінію та сильних к-т добре розчинні у воді, значно гідролізуються в розчині, утворюють кристалогідрати, напр. А1С13o 6Н2О. Сульфат алюмінію Аl2(SО4)3 o18Н2O і сульфат калію-алюмінію (галун) КА1(SО4)2o 12Н2O застосовують як дубильні засоби, протраву при фарбуванні, у виробн. паперу, для очищення води тощо. Як протраву в текст. пром-сті використовують також нітрат алюмінію і розчин ацетату алюмінію. Серед координаційних сполук алюмінію найбільше значення має гексафтороалюмінат натрію (кріоліт) Nа3АlF6, (tпл 1012° С), який використовують для одержання алюмінію.
В-10
Завдання 1
-
Катіони І групи. Сюди належать іони калію, натрію амонію, іноді до цієї групи відносять також іони магнію. Для
катіонів І групи характерна розчинність карбонатів і сульфідів названих металів у воді. Другою особливістю є відсутність групового реактиву, за допомогою якого можна було б перевести в осад усі катіони І групи.Катіони ІІ групи – іони кальцію, стронцію і барію – утворюють нерозчинні у воді карбонати. Груповим реактивом є розчин карбонату амонію (NH4)2CO3
Катіони s-елементів, що мають 2 - і 8-електронним зовнішнім шаром (Li +, Na +, K +, Mg2 +, Са2 +, Sr2 +, Ba2 + тощо). Катіони Ag +, Hg2 +, As (III), As (V), Sn +, Sb (III), Pb2 +, Bi3 + та ін, що мають багато електронної зовнішнім шаром (18 і 18 + 2), є сильними поляризаторами і в той же час легко поляризуються самі. Відповідно до цього всі катіони, що володіють зовнішньої електронної структурою 18е-або (18 + 2e-) як правило, утворюють сульфіди з дуже малими значеннями констант розчинності і тому належать до IV і V аналітичним групам.
Катіони з перехідною електронної структурою, тобто з незакінченою 18-електронним зовнішнім шаром (Mn2 +, Fc2 +, Fe3 +, Co2 +, Ni2 + та ін), займають проміжне положення. Будучи порівняно сильними поляризаторами, вони в той же час помітно поляризуються самі і тому при взаємодії з сульфід-іонами дають важкорозчинні сульфіди. Ці катіони утворюють III аналітичну групу. Їх сульфіди мають значно більші значення констант розчинності, ніж катіони IV і V груп.
Таким чином, сульфідна класифікація катіонів, заснована на ознаці, що має на перший погляд суто практичний характер, ні в якій мірі не випадкова, а пов'язана з електронною конфігурацією атомів і іонів.
